El tratamiento conservador es el de elección en el cáncer de mama en estadios iniciales. La irradiación parcial acelerada de la mama es una estrategia que permite tratar únicamente el lecho quirúrgico con 1-2cm de margen, en contraposición al tratamiento clásico, que consiste en irradiar toda la mama. La reducción del volumen a irradiar nos permite aumentar la dosis/fracción administrada, acortando la duración total del tratamiento. El interés creciente por este esquema terapéutico ha motivado la realización de ensayos fase i-iii, que evalúan esta modalidad terapéutica mediante diferentes técnicas: braquiterapia intersticial multicatéter, braquiterapia intracavitaria mediante balón, radioterapia externa conformada y radioterapia intraoperatoria. La braquiterapia mediante balón incluye MammoSite, Axxent y Contura, y dispositivos híbridos como SAVI y ClearPath. Este artículo revisa las diferentes técnicas, reflejando las ventajas e inconvenientes de cada una de ellas. Aunque estamos a la espera de los resultados a largo plazo de los ensayos fase iii, parece evidente que la irradiación parcial acelerada de la mama tendrá un papel importante en el manejo de un grupo seleccionado de pacientes con cáncer de mama precoz
Breast conservation therapy is the procedure of choice of early-stage breast cancer. Accelerated partial breast irradiation is an approach that treats only the lumpectomy bed plus a 1-2cm margin, rather than the whole breast. Because of the small volume of irradiation, a higher dose can be delivered, thus reducing the total length of treatment. Growing interest in accelerated partial breast irradiation has prompted the development of phase i-iii clinical studies evaluating distinct techniques within this therapeutic modality; these techniques include multicatheter interstitial brachytherapy, balloon-catheter brachytherapy, conformal external beam radiation therapy, and intraoperative radiation therapy. Balloon-based brachytherapy approaches include MammoSite, Axxent and Contura electronic brachytherapy. Hybrid brachytherapy devices include SAVI and ClearPath. This article reviews the different techniques, identifying the weaknesses and strengths of each approach, and proposes a direction for future research and development. Although further follow-up and mature phase iii data are needed, it seems evident that accelerated partial breast irradiation will play a role in the management of a selected group of patients with early-stage breast cancer.
Los estudios aleatorizados han demostrado que la cirugía conservadora y la radioterapia son tan efectivas como la mastectomía en el tratamiento de la neoplasia de mama en estadios iniciales (i-ii), tanto en control local como en supervivencia global1–3. Por ello, actualmente, el tratamiento conservador es el procedimiento más habitual del carcinoma precoz de mama. La radioterapia con el esquema clásico de fracciones de 1,8-2Gy/d, 5 veces por semana hasta una dosis total de 50-70Gy, es decir 5-7 semanas de tratamiento, obtiene unos excelentes resultados en cuanto a curación y cosmética4,5. El reto actual de los oncólogos radioterápicos está en la definición de nuevos esquemas de irradiación más cómodos y más fáciles de integrar con la terapia sistémica, pero manteniendo estos excelentes resultados.
Aprovechando el hecho de que en pacientes seleccionadas las recidivas locales se producen casi exclusivamente en la vecindad del lecho tumoral6,7, y en un intento de reducir el número de fracciones de tratamiento, desde hace unos años se plantea un cambio de estrategia, consistente en la irradiación parcial acelerada de la mama (IPAM)8,9. Así, se pasa de tratar todo el volumen mamario a irradiar únicamente el cuadrante afecto o el lecho tumoral. Esta irradiación de una parte del volumen mamario se puede realizar en una única sesión intraoperatoria o en varias sesiones administradas en una semana con diversas técnicas10,11.
Esta reducción del volumen a tratar pretende mejorar la cosmética de los esquemas hipofraccionados, que ya se emplean de forma habitual tras la cirugía conservadora12–15. Para ello, es necesario localizar correctamente el lecho tumoral, bien sea mediante pruebas de imagen tipo mamografía, ecografía o RMN, bien con marcas metálicas (clips) que deja el cirujano durante el acto quirúrgico, llevando la unidad de tratamiento al quirófano para realizar el tratamiento de forma intraoperatoria o dejando un catéter en el momento de la intervención para que después sirva de guía para la irradiación 16. Así mismo, las técnicas de irradiación deberán ser más sofisticadas, ya que se pretende irradiar un volumen menor y el resto de la mama pasa a ser un órgano crítico, y se debe intentar que reciba la mínima dosis posible.
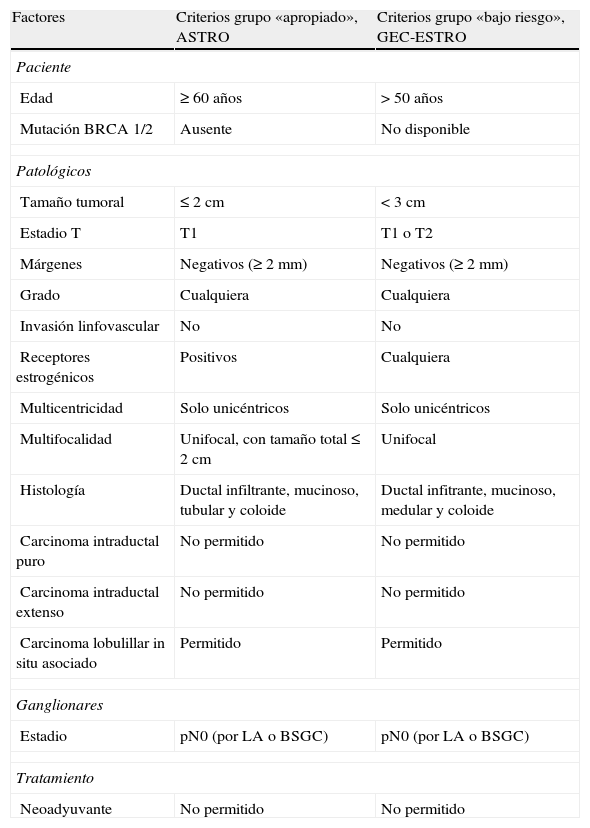
Esta estrategia actualmente se contempla en forma de ensayo y se dirige, como ya se ha mencionado, a un grupo seleccionado de pacientes. En este sentido, el panel de expertos de la Sociedad Americana de Radioterapia17 y el grupo de braquiterapia de la Sociedad Europea de Oncología Radioterápica18 han publicado recientemente unas recomendaciones para extender la indicación de la IPAM a pacientes fuera de ensayo clínico (tabla 1). Hacen énfasis en que la mayoría de la evidencia disponible a largo plazo a favor del uso de la IPAM está basada en ensayos realizados con la técnica de braquiterapia intersticial multicatéter, aunque estas recomendaciones son probablemente válidas para otras técnicas alternativas tanto de braquiterapia como de radioterapia externa. La Sociedad Americana de Radioterapia establece 3 grupos de pacientes cara a la administración del tratamiento fuera del ámbito del ensayo: 1) pacientes en las que sería «apropiado» realizar la IPAM fuera de ensayo clínico; 2) pacientes en la que se podría realizar «con precaución», y 3) pacientes en las que «no sería apropiado». Hay que tener en cuenta que la clasificación se basa en los criterios de inclusión empleados en los diferentes estudios realizados con IPAM, y que en algunos trabajos recientes se muestra la ausencia de correlación con los resultados19.
Criterios de la ASTRO y de GEC-ESTRO para indicar la irradiación parcial acelerada de la mama en pacientes de bajo riesgo fuera de ensayo clínico
| Factores | Criterios grupo «apropiado», ASTRO | Criterios grupo «bajo riesgo», GEC-ESTRO |
| Paciente | ||
| Edad | ≥60 años | >50 años |
| Mutación BRCA 1/2 | Ausente | No disponible |
| Patológicos | ||
| Tamaño tumoral | ≤2cm | <3cm |
| Estadio T | T1 | T1 o T2 |
| Márgenes | Negativos (≥2mm) | Negativos (≥2mm) |
| Grado | Cualquiera | Cualquiera |
| Invasión linfovascular | No | No |
| Receptores estrogénicos | Positivos | Cualquiera |
| Multicentricidad | Solo unicéntricos | Solo unicéntricos |
| Multifocalidad | Unifocal, con tamaño total≤2cm | Unifocal |
| Histología | Ductal infiltrante, mucinoso, tubular y coloide | Ductal infitrante, mucinoso, medular y coloide |
| Carcinoma intraductal puro | No permitido | No permitido |
| Carcinoma intraductal extenso | No permitido | No permitido |
| Carcinoma lobulillar in situ asociado | Permitido | Permitido |
| Ganglionares | ||
| Estadio | pN0 (por LA o BSGC) | pN0 (por LA o BSGC) |
| Tratamiento | ||
| Neoadyuvante | No permitido | No permitido |
A continuación se detallan las diferentes modalidades de radioterapia que permiten realizar este esquema terapéutico.
Material y métodosSe realizó una búsqueda de la literatura científica, desde enero de 2000 hasta julio de 2013, en las siguientes bases de datos: MEDLINE (PubMed), EMBASE (Ovid), Web of Science (Web of Knowledge). Las palabras clave empleadas fueron: partial breast irradiation, accelerated partial breast irradiation, brachytherapy, mammosite, 3D-conformal radiotherapy, intraoperative radiotherapy.
BraquiterapiaSe emplean fundamentalmente 2 técnicas dependiendo de la disponibilidad de cada centro: intersticial multicatéter e intracavitaria mediante balón. También se está empezando a administrar la braquiterapia mediante dispositivos «híbridos» (SAVI, ClearPath) que reúnen las ventajas de los 2 anteriores, pero, por el momento, la experiencia es limitada20.
Braquiterapia intersticial multicatéterLa técnica es la misma que se utiliza habitualmente como sobreimpresión del lecho operatorio después de la irradiación de toda la mama. Consiste en realizar un implante mediante la colocación de unos vectores (agujas metálicas) alrededor del lecho quirúrgico para irradiar esta zona con 1-3cm de margen.
Previa a la realización del implante, se puede hacer una simulación con TC para prever la geometría y la colocación teórica de los vectores21. La colocación de los catéteres se debe hacer en quirófano, bajo condiciones de asepsia. Con la ayuda del ecógrafo se localiza el lecho quirúrgico, se determina el volumen que queremos tratar y se decide el número de planos y vectores y los puntos de entrada y salida de los mismos. Los vectores deben colocarse paralelos entre sí, separados aproximadamente 1-1,6cm y guardando una determinada geometría (generalmente triángulos). Para mantener el paralelismo de los vectores se utilizan unas plantillas de plástico rígido con unos orificios predeterminados que se sujetan entre sí con un puente metálico; una vez finalizada su colocación, estos se sustituyen por tubos plásticos, que se pueden cortar cerca de la superficie de la piel y sujetarse con botones plásticos.
Tras finalizar el implante, se efectúa otra TC para planificar el tratamiento, se contornea el lecho quirúrgico, con el margen adecuado, y también los órganos de riesgo. Interesa que la piel no reciba demasiada dosis (en general, menos del 70% de la dosis en el lecho operatorio), así como el músculo pectoral y las costillas. Posteriormente, se administra el tratamiento, que puede realizarse de forma ambulatoria.
Hasta ahora se han publicado varios ensayos de braquiterapia con tasas de dosis baja, alta o pulsada22–24. La dosis que recomiendan los diferentes autores depende de la tasa de dosis utilizada: las dosis con tasas bajas y pulsadas oscilan entre 45 y 50Gy; con tasas altas, Vicini et al.25 utilizaban 34Gy en 10 fracciones de 3,4Gy; en el ensayo europeo, Polgár et al.23 empleaban 8 fracciones de 4Gy. Se suelen administrar 2 fracciones al día, con un intervalo entre ellas de al menos 6h.
En nuestro entorno, Gutiérrez et al. realizaron un estudio fase ii para validar la técnica en el Instituto Catalán de Oncología con la dosis y el fraccionamiento recomendados en el ensayo americano, y solo observaron una recidiva local a 5 años, siendo los resultados estéticos excelentes o buenos26.
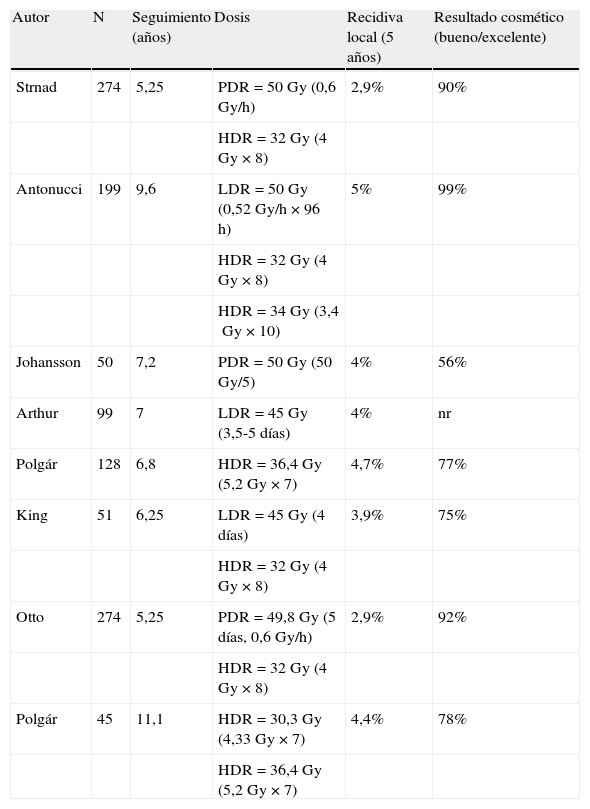
Hasta la fecha, se han tratado dentro de diferentes ensayos más de 2.000 pacientes en todo el mundo11,27 (tabla 2), obteniendo, con unos seguimientos relativamente largos (entre 23 y 84 meses), un control local y supervivencias exactamente superponibles a los obtenidos con el tratamiento conservador28. La tasa de recidivas locales a los 5 años varía entre el 0,9 y el 4,7%, dependiendo de los centros, con un resultado estético excelente o bueno en más del 85% de las pacientes. No se describen prácticamente complicaciones agudas. En cuanto a las tardías, está descrita la fibrosis moderada, en relación con el volumen implantado; la necrosis grasa, si hay zonas dentro del volumen tratado que reciben dosis muy altas, o telangiectasias si los catéteres han quedado demasiado superficiales. Estas complicaciones aparecen hasta en el 20% de los casos en algunas de las series publicadas.
Estudios de irradiación parcial acelerada de la mama mediante braquiterapia intersticial multicatéter
| Autor | N | Seguimiento (años) | Dosis | Recidiva local (5 años) | Resultado cosmético (bueno/excelente) |
| Strnad | 274 | 5,25 | PDR=50Gy (0,6Gy/h) | 2,9% | 90% |
| HDR=32Gy (4Gy×8) | |||||
| Antonucci | 199 | 9,6 | LDR=50Gy (0,52Gy/h×96h) | 5% | 99% |
| HDR=32Gy (4Gy×8) | |||||
| HDR=34Gy (3,4Gy×10) | |||||
| Johansson | 50 | 7,2 | PDR=50Gy (50Gy/5) | 4% | 56% |
| Arthur | 99 | 7 | LDR=45Gy (3,5-5 días) | 4% | nr |
| Polgár | 128 | 6,8 | HDR=36,4Gy (5,2Gy×7) | 4,7% | 77% |
| King | 51 | 6,25 | LDR=45Gy (4 días) | 3,9% | 75% |
| HDR=32Gy (4Gy×8) | |||||
| Otto | 274 | 5,25 | PDR=49,8Gy (5 días, 0,6Gy/h) | 2,9% | 92% |
| HDR=32Gy (4Gy×8) | |||||
| Polgár | 45 | 11,1 | HDR=30,3Gy (4,33Gy×7) | 4,4% | 78% |
| HDR=36,4Gy (5,2Gy×7) |
nr: no reportado.
Fuente: Offersen et al.27.
Los principales inconvenientes de esta técnica son que requiere una infraestructura (un quirófano para colocar los tubos, material adecuado y módulos de planificación y dosimetría especiales) y que es una técnica que depende de la habilidad del médico que coloca los catéteres. La optimización en la disposición de los vectores guiados por la imagen y la dosimetría en 3D nos proporcionan en la actualidad herramientas más fiables para la distribución de las fuentes y permiten mejorar los resultados.
Braquiterapia intracavitaria mediante balónLa FDA aprobó el catéter de MammoSite para la IPAM en el año 2002. El aplicador consta de un globo de silicona que se rellena con suero salino y contraste, adoptando una forma esférica o elipsoidal en función del aplicador que mejor se adapte a la cavidad de tumorectomía. Dentro del globo se encuentra un catéter de silicona en cuyo interior se introduce la fuente radiactiva. El aplicador finaliza en 2 tubos obturados: uno con un tapón de color rojo (el que se conecta al equipo de tasas de dosis altas) y otro de color azul (por el que se introduce el suero salino)29,30.
El aplicador se puede colocar en el mismo acto quirúrgico o de forma diferida. Cuando se realiza en el mismo acto quirúrgico se evita un nuevo procedimiento invasivo, con el inconveniente de que en ese momento no se tiene el informe completo de Anatomía Patológica, en relación, sobre todo, con el estado de los márgenes quirúrgicos31. La colocación del aplicador se realiza con la cavidad de tumorectomía todavía abierta, a través de una incisión lateral independiente de la cicatriz de tumorectomía. Posteriormente, se procede al rellenado del globo con la mezcla de una solución que contenga 5cc de contraste yodado en 100cc de suero salino.
Otra opción consiste en colocar el catéter de forma postoperatoria a las 4-6 semanas de la intervención. Los criterios para la colocación y rellenado del globo son los mismos que con la técnica intraoperatoria, siendo los resultados similares con ambas técnicas32.
Para la planificación, se realiza una TC en la que se debe comprobar que el aplicador se adapta a la cavidad de tumorectomía (el volumen mamario tiene que permitir al menos una cavidad de tumorectomía de 3cm), que la distancia a la piel es mayor de 7mm para evitar necrosis cutánea, y que la fuente se encuentra equidistante y centrada dentro del globo. Antes de cada aplicación se comprueba mediante ecografía que el globo mantiene el volumen inicial, la simetría y que la cantidad de seroma que rodea la cavidad es menor del 10% del volumen. Cuando se administra la última sesión de radioterapia, se desinfla el catéter, comprobando que se retira toda la cantidad de líquido introducido en el globo, y se retira el aplicador.
Las dosis administradas son similares a las empleadas en la braquiterapia intersticial: 34Gy de dosis total calculado a la curva de isodosis del 100% a 1cm de la superficie del globo, administrando 2 sesiones al día de 3,4Gy/sesión separadas al menos 6h, durante 5 días.
La principal ventaja es que requiere una sola incisión. Las desventajas son que la distribución de la dosis es esférica y no permite una buena conformación en caso de volúmenes irregulares, y la dosis en piel en tumores próximos a esta33. Están surgiendo dispositivos con más de una fuente que permiten una mayor conformación de las dosis.
Los efectos secundarios agudos más frecuentes son: eritema, presente en el 57%, y la descamación húmeda en un 5%, según trabajos publicados. El resultado estético fue de bueno a excelente en el 88% de las pacientes tratados. El índice de recidivas locales a 5 años se sitúa entre el 0,8 y el 4%32.
Radioterapia intraoperatoriaConsiste en la irradiación de la cavidad de tumorectomía estando abierto el campo quirúrgico. La irradiación se realiza con una energía de electrones procedente de un acelerador lineal (Mobetron, Novac-7), o mediante rayos X de 50Kv (Intrabeam). Uno de los trabajos más importantes de RIO es el ELIOT, desarrollado por el grupo de Milán; la primera paciente se trató en 1999 y recientemente han finalizado la inclusión de pacientes en el ensayo fase iii. El ensayo fase i/ii34 previo estableció la dosis de 21Gy, administrados en una fracción, mediante electrones de 3-12MeV procedentes de un acelerador lineal que era trasladado al quirófano35. A las pacientes se les realizaba una cuadrantectomía, seguidamente se reconstruía el lecho tumoral mediante suturas, y sobre esta zona, se colocaba un aplicador que iba conectado al acelerador, aplicando un margen de 1,5-3cm. Posteriormente, se retiraba el aplicador y se reconstruía la mama.
La otra alternativa es el Intrabeam, que emplea rayos X de 50Kv para administrar 20Gy en una fracción, prescribiendo la dosis a 1mm de la superficie del aplicador. A las pacientes se les realiza una tumorectomía, y en función del tamaño de la cavidad, existen diferentes aplicadores. Recientemente, se han publicado los resultados del ensayo fase iii TARGIT-A36, en el que tras 4 años de seguimiento no se observaron diferencias en la recidiva local, pero la toxicidad grado 3 fue menor en el grupo de RIO (p=0,002).
Las grandes ventajas de la RIO son la delimitación más precisa del lecho tumoral como zona a irradiar, y el hecho de que cuando la paciente sale del quirófano ya han finalizado todos los tratamientos locales. Los inconvenientes son la ausencia de un informe anatomopatológico completo en el momento de administrar la radiación, la dedicación de una unidad de tratamiento prácticamente en exclusiva para estos tratamientos, y la necesidad de una excelente coordinación entre un grupo multidisciplinar de cirujanos, anestesistas, médicos nucleares, oncólogos radioterápicos y radiofísicos.
Radioterapia externa conformada tridimensionalLas principales ventajas de la IPAM mediante radioterapia externa es que podemos conseguir una mayor homogeneidad en la distribución de la dosis, nos permite administrar la irradiación tras el informe completo de Anatomía Patológica, el oncólogo radioterápico no precisa de un periodo de aprendizaje específico y no requiere un desarrollo tecnológico especial, ya que un acelerador lineal con planificación 3D debe estar disponible en la actualidad en todos los servicios de Oncología Radioterápica.
La principal desventaja es que al ser la mama un órgano móvil, para asegurar una correcta inclusión del lecho quirúrgico en el volumen de tratamiento se va a delimitar un volumen mayor de tejido sano si lo comparamos con la braquiterapia o la RIO.
El volumen de tratamiento se define como el lecho quirúrgico con margen de 2-2,5cm. La delimitación de este volumen es uno de los puntos críticos en la IPAM con radioterapia externa, algunos investigadores apoyan el empleo de clips quirúrgicos, otros delimitar la zona del seroma en la TC o emplear técnicas de imagen como la ecografía16.
Además del volumen de tratamiento, se delimitan los órganos de riesgo, que serán el resto de la mama, la mama contralateral, el corazón, ambos pulmones y la piel. Los límites de dosis empleados por la mayoría de los trabajos son los recogidos en los ensayos RTOG 031937 y RTOG 0413/NSABP B3938.
Al disminuir el volumen a tratar se debe aumentar el control de calidad para asegurar que en cada fracción de tratamiento el lecho tumoral está incluido en el volumen de irradiación; esto es posible porque actualmente las unidades de tratamiento pueden realizar radiografías y TC de una excelente calidad, antes de cada fracción. El esquema de irradiación es el mismo que el utilizado en braquiterapia: 2 fracciones diarias de 3,4-3,85Gy durante 5 días.
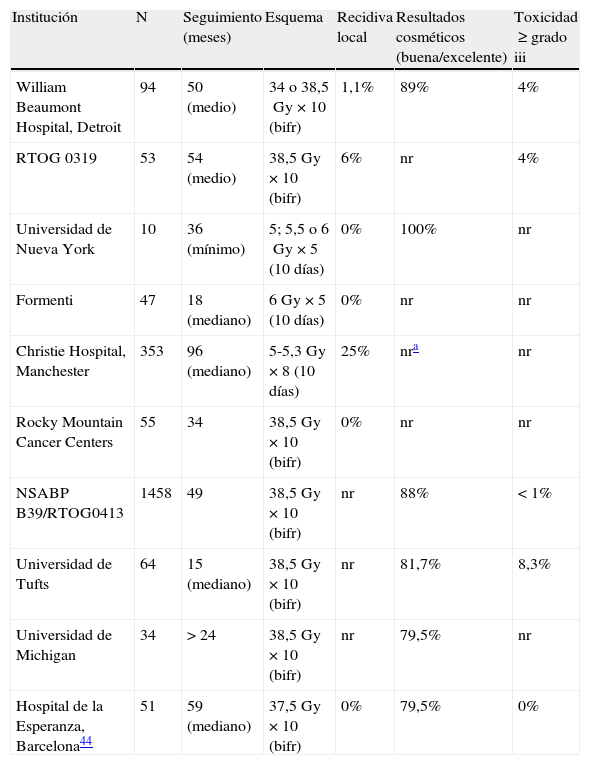
Moon et al.39 compararon distintos métodos para la realización de la IPAM con radioterapia externa: radioterapia conformada tridimensional, radioterapia de intensidad modulada, tomoterapia y protones, y observaron que las 4 técnicas obtienen una cobertura aceptable del volumen de tratamiento. En cuanto a los órganos de riesgo, los protones y la radioterapia de intensidad modulada ofrecen la ventaja, respecto a la tomoterapia, de poder reducir las dosis sobre el resto de la mama sin necesidad de aumentar la dosis en corazón y pulmón. La tabla 3 recoge algunos de los trabajos de IPAM mediante radioterapia conformada tridimensional40. Estudios recientes han apuntado que la IPAM aumentaría la toxicidad tardía moderada-severa, observando una correlación entre el volumen de tejido mamario irradiado y el resultado cosmético global41,42. Sin embargo, trabajos con mayor número de pacientes y seguimientos más largos, y el análisis preliminar de las pacientes con un seguimiento mínimo de 36 meses del ensayo RTOG 0413 no han observado esta correlación y muestran unos resultados cosméticos excelentes/buenos y una mínima toxicidad grado≥3. Shaitelman et al.43 observan que, de forma similar a lo que ocurre con otras técnicas de IPAM, la distancia entre la superficie cutánea y los límites de la zona a irradiar se asocia a un aumento del riesgo de toxicidad. Rodríguez et al.44 han finalizado la selección de pacientes del estudio aleatorizado que compara la IPAM frente al tratamiento estándar. Tras un seguimiento medio de 5 años, no se ha detectado ninguna recidiva local. Tal como era de esperar, la IPAM produce una dermatitis aguda de menor grado, pero más precoz, y consigue una reducción de la dosis en los órganos de riesgo. No se han observado tampoco diferencias en los efectos secundarios tardíos, que en ambos grupos fueron≤grado 2 de la RTOG, ni en el resultado cosmético45.
Estudios de irradiación parcial acelerada de la mama mediante radioterapia externa (radioterapia conformada tridimensional)
| Institución | N | Seguimiento (meses) | Esquema | Recidiva local | Resultados cosméticos (buena/excelente) | Toxicidad≥grado iii |
| William Beaumont Hospital, Detroit | 94 | 50 (medio) | 34 o 38,5Gy×10 (bifr) | 1,1% | 89% | 4% |
| RTOG 0319 | 53 | 54 (medio) | 38,5Gy×10 (bifr) | 6% | nr | 4% |
| Universidad de Nueva York | 10 | 36 (mínimo) | 5; 5,5 o 6Gy×5 (10 días) | 0% | 100% | nr |
| Formenti | 47 | 18 (mediano) | 6Gy×5 (10 días) | 0% | nr | nr |
| Christie Hospital, Manchester | 353 | 96 (mediano) | 5-5,3Gy×8 (10 días) | 25% | nra | nr |
| Rocky Mountain Cancer Centers | 55 | 34 | 38,5Gy×10 (bifr) | 0% | nr | nr |
| NSABP B39/RTOG0413 | 1458 | 49 | 38,5Gy×10 (bifr) | nr | 88% | <1% |
| Universidad de Tufts | 64 | 15 (mediano) | 38,5Gy×10 (bifr) | nr | 81,7% | 8,3% |
| Universidad de Michigan | 34 | >24 | 38,5Gy×10 (bifr) | nr | 79,5% | nr |
| Hospital de la Esperanza, Barcelona44 | 51 | 59 (mediano) | 37,5Gy×10 (bifr) | 0% | 79,5% | 0% |
bifr: 2 sesiones/día; nr: no reportada.
Pacientes con irradiación parcial que presentaron una mayor incidencia de fibrosis, telangiectasias y necrosis grasa.
Fuente: Vicini et al.40.
La IPAM es una nueva estrategia que permite, en pacientes seleccionadas, administrar la radioterapia tras el tratamiento quirúrgico conservador de una forma más rápida, ofreciendo además la posibilidad de reducir la irradiación de la mama no afecta y de los otros órganos de riesgo adyacentes. La incorporación de tecnologías como la braquiterapia de alta tasa, la irradiación intraoperatoria, los sistemas de control del volumen irradiado y la modulación de intensidad nos facilitarán administrar dosis por fracción mayores sin perjuicio de los resultados, consiguiendo un mayor bienestar para las pacientes y una mayor facilidad de integración de la radioterapia dentro del esquema multidisciplinar del tratamiento.
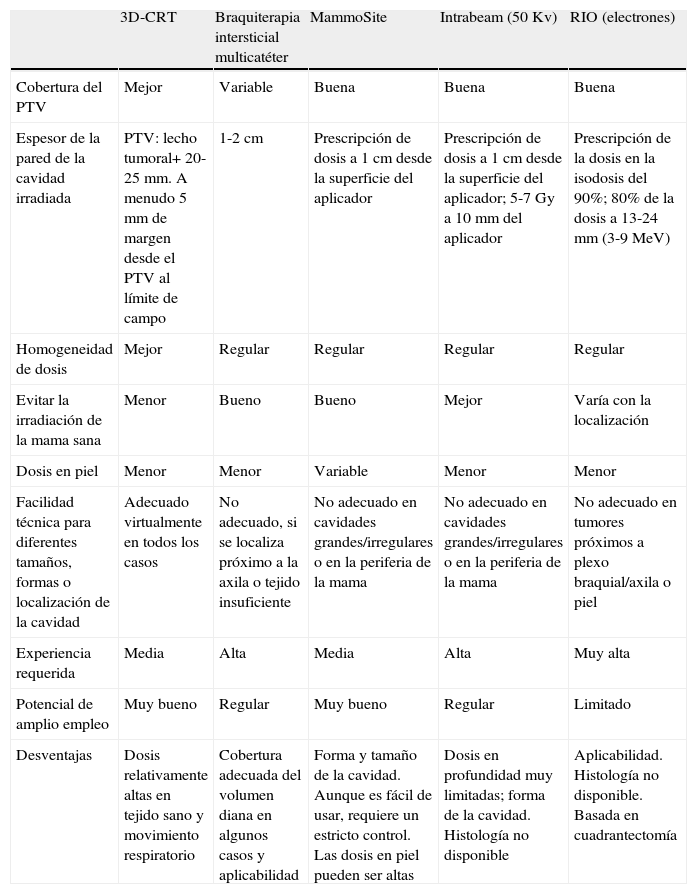
La tabla 4 resume las diferentes técnicas de irradiación parcial expuestas con anterioridad. El empleo de una u otra dependerá de la disponibilidad de cada centro. Esta disminución del tiempo de irradiación permitiría poder tratar a la paciente la semana después de la cirugía, antes de la quimioterapia, y, finalmente, disminuir la carga de trabajo de las unidades de radioterapia, con una reducción de los costes sanitarios46–48.
Comparación de las diferentes técnicas de irradiación parcial
| 3D-CRT | Braquiterapia intersticial multicatéter | MammoSite | Intrabeam (50Kv) | RIO (electrones) | |
| Cobertura del PTV | Mejor | Variable | Buena | Buena | Buena |
| Espesor de la pared de la cavidad irradiada | PTV: lecho tumoral+ 20-25mm. A menudo 5mm de margen desde el PTV al límite de campo | 1-2cm | Prescripción de dosis a 1cm desde la superficie del aplicador | Prescripción de dosis a 1cm desde la superficie del aplicador; 5-7Gy a 10mm del aplicador | Prescripción de la dosis en la isodosis del 90%; 80% de la dosis a 13-24mm (3-9MeV) |
| Homogeneidad de dosis | Mejor | Regular | Regular | Regular | Regular |
| Evitar la irradiación de la mama sana | Menor | Bueno | Bueno | Mejor | Varía con la localización |
| Dosis en piel | Menor | Menor | Variable | Menor | Menor |
| Facilidad técnica para diferentes tamaños, formas o localización de la cavidad | Adecuado virtualmente en todos los casos | No adecuado, si se localiza próximo a la axila o tejido insuficiente | No adecuado en cavidades grandes/irregulares o en la periferia de la mama | No adecuado en cavidades grandes/irregulares o en la periferia de la mama | No adecuado en tumores próximos a plexo braquial/axila o piel |
| Experiencia requerida | Media | Alta | Media | Alta | Muy alta |
| Potencial de amplio empleo | Muy bueno | Regular | Muy bueno | Regular | Limitado |
| Desventajas | Dosis relativamente altas en tejido sano y movimiento respiratorio | Cobertura adecuada del volumen diana en algunos casos y aplicabilidad | Forma y tamaño de la cavidad. Aunque es fácil de usar, requiere un estricto control. Las dosis en piel pueden ser altas | Dosis en profundidad muy limitadas; forma de la cavidad. Histología no disponible | Aplicabilidad. Histología no disponible. Basada en cuadrantectomía |
RIO: radioterapia intraoperatoria; 3D-CRT: radioterapia conformada tridimensional.
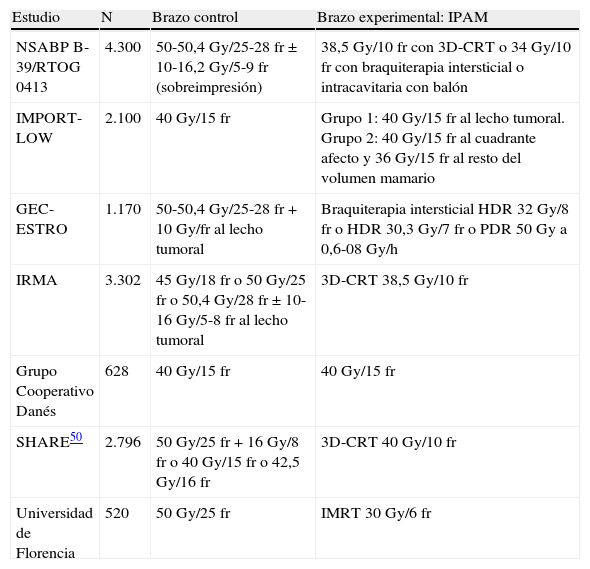
Los resultados de los trabajos aleatorizados publicados y los que están aún en curso49,50 (tabla 5) permitirán evaluar su importancia en el tratamiento conservador y definir sus indicaciones clínicas asistenciales.
Estudios fase iii en marcha que comparan la irradiación parcial acelerada de la mama con la irradiación estándar de la mama
| Estudio | N | Brazo control | Brazo experimental: IPAM |
| NSABP B-39/RTOG 0413 | 4.300 | 50-50,4Gy/25-28 fr±10-16,2Gy/5-9 fr (sobreimpresión) | 38,5Gy/10 fr con 3D-CRT o 34Gy/10 fr con braquiterapia intersticial o intracavitaria con balón |
| IMPORT-LOW | 2.100 | 40Gy/15 fr | Grupo 1: 40Gy/15 fr al lecho tumoral. Grupo 2: 40Gy/15 fr al cuadrante afecto y 36Gy/15 fr al resto del volumen mamario |
| GEC-ESTRO | 1.170 | 50-50,4Gy/25-28 fr+10Gy/fr al lecho tumoral | Braquiterapia intersticial HDR 32Gy/8 fr o HDR 30,3Gy/7 fr o PDR 50Gy a 0,6-08Gy/h |
| IRMA | 3.302 | 45Gy/18 fr o 50Gy/25 fr o 50,4Gy/28 fr±10-16Gy/5-8 fr al lecho tumoral | 3D-CRT 38,5Gy/10 fr |
| Grupo Cooperativo Danés | 628 | 40Gy/15 fr | 40Gy/15 fr |
| SHARE50 | 2.796 | 50Gy/25 fr+16Gy/8 fr o 40Gy/15 fr o 42,5Gy/16 fr | 3D-CRT 40Gy/10 fr |
| Universidad de Florencia | 520 | 50Gy/25 fr | IMRT 30Gy/6 fr |
fr: fracciones; HDR: tasas de dosis alta; IMRT: radioterapia de intensidad modulada; IPAM: irradiación parcial acelerada de la mama; PDR: tasas de dosis pulsada; 3D-CRT: radioterapia conformada tridimensional.
Fuente: Njeh et al.49.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AutoríaLos autores han leído y aprobado el manuscrito y que los requisitos para la autoría se han cumplido.