El linfedema (LE) es una de las secuelas más graves e incapacitantes secundarias al tratamiento en el cáncer de mama debido a las limitaciones funcionales, implicaciones estéticas y riesgo de infección que conlleva. Se estima que entre el 29 y 39% de las pacientes que se sujetan a una linfadenectomía axilar desarrollan LE, frente a entre 5 y 7% de los que casos que se realiza una biopsia selectiva de ganglio centinela. Para intentar reducir su incidencia, se ha desarrollado el mapeo axilar inverso. El objetivo de esta técnica es diferenciar las distintas vías de drenaje linfático axilar y del brazo mediante la inyección de un colorante azul en el brazo ipsilateral, para poder respetar los linfáticos que drenan la extremidad superior durante la disección linfática axilar. Otra posibilidad es usar verde de indocianina y así combinar el procedimiento de mapeo axilar inverso con el trazador dual estándar en la biopsia selectiva de ganglio centinela. Gracias a la microcirugía se han desarrollado técnicas como la anastomosis linfático-venosa para la prevención secundaria de LE, de manera que los linfáticos aferentes del brazo se pueden redirigir a ramas colaterales de la vena axilar para restaurar el flujo linfático fisiológico. Este procedimiento es más eficaz en las etapas precoces de LE. En los últimos años se está llevando a cabo la técnica LYMPHA, que consiste en anastomosar los vasos linfáticos del brazo a una rama colateral de la vena axilar en el momento de la disección ganglionar. Esta se ha demostrado útil en la prevención primaria de LE y en la reducción de complicaciones tempranas.
Lymphoedema (LE) is one of the most serious and disabling sequelae secondary to breast cancer treatment due to the functional limitations, cosmetic implications and risk of infection it entails. Twenty-nine to thirty-nine per cent of patients who undergo axillary lymphadenectomy (AL) are estimated to develop LE, compared to 5-7% in those who undergo selective sentinel lymph node biopsy (SLNB). In an attempt to reduce its incidence, Reverse Axillary Mapping (ARM) has been developed. The aim of this technique is to differentiate the different axillary and arm lymphatic drainage pathways by injecting a blue dye into the ipsilateral arm, in order to respect the lymphatics draining the upper extremity during axillary lymphatic dissection. Another possibility is to use indocyanine green and thus combine the ARM procedure with the standard dual tracer in SLNB. Thanks to microsurgery, techniques such as lymphatic-venous anastomosis (LVA) have been developed for secondary prevention of lymphoedema, so that afferent lymphatics in the arm can be redirected to collateral branches of the axillary vein to restore physiological lymphatic flow. In recent years, the LYMPHA technique, which involves anastomosing the lymphatic vessels of the arm to a collateral branch of the axillary vein at the time of lymph node dissection, has been implemented. This has been shown to be useful in the primary prevention of LE and in the reduction of early complications.
Hasta 250 millones de personas en todo el mundo padecen linfedema (LE). Se puede dividir en 2 tipos principales1: LE primario, se debe a anomalías genéticas o del desarrollo, y LE secundario, resultado de causas posnatales que incluyen traumatismos, infecciones, neoplasias o radiaciones al sistema linfático2.
El LE es una de las secuelas más graves e incapacitantes secundarias al cáncer de mama y sus tratamientos complementarios. Varios estudios sobre calidad de vida confirman que el LE es aún más incapacitante que la asimetría o amastia mamaria debido a sus limitaciones funcionales, implicaciones estéticas y mayor riesgo de erisipela o linfangitis recurrente3.
Se estima que entre el 29 y 49% de los pacientes sujetos a una linfadenectomía axilar (LA) desarrollará LE, aunque solo entre el 5 y 7% de los pacientes a biopsia selectiva del ganglio centinela (BSGC) tendrá el mismo destino. En promedio, estos pacientes desarrollan LE dentro de los primeros 8 meses de la cirugía, con un 75% de posibilidades de desarrollar signos de LE dentro de los primeros 3 años. Esta variabilidad en la incidencia, aparición y progresión está asociada a varios factores de riesgo independientes para el desarrollo de LE: obesidad, radiación, infección y genética. También la progresión de la enfermedad difiere ampliamente entre los pacientes4–6. Los síntomas del LE progresan generando una gruesa capa de tejido adiposo fibrótica, una extremidad edematosa, que es dolorosa y debilitante, y que perjudica las actividades diarias del paciente7.
Preservando las vías de drenaje linfáticoLa prevención de daños significativos en el sistema linfático se considera primordial para reducir el riesgo de desarrollar LE. Múltiples estudios demuestran que la BSGC reduce el riesgo de LE posterior. Sin embargo, solo entre el 5 y 7% de los pacientes sujetos a BSGC tendrá el mismo destino.
Esto condujo al desarrollo de una técnica novedosa, el Mapeo Axilar Inverso (Axillary Reverse Mapping, ARM).
En 2007, se publicaron los primeros estudios sobre ARM8, un procedimiento que permite la discriminación del drenaje linfático de la extremidad superior y el drenaje linfático mamario en la región axilar. El concepto fundamental del ARM se basa en el supuesto de que la extremidad superior y la mama tienen sus propias vías discretas de drenaje linfático a través de la axila. Aunque se ha demostrado que existen interconexiones entre ambas vías.
Se han descrito 3 técnicas de visualización del drenaje linfático del miembro superior: radioisótopos, colorante fluorescente y colorante azul.
El colorante azul (usualmente azul de metileno) es el que se ha usado con mayor frecuencia. La técnica implica la inyección de 2 a 5 ml de colorante9,10 por vía dérmica o subcutánea en la cara interna y superior del brazo a lo largo del surco intramuscular medial ipsilateral.
Las tasas de visualización en la axila de los ganglios linfáticos con ARM en LA variaron de 39 a 90% y la visualización de los linfáticos de 47 a 86%. Las tasas de visualización en BSGC variaron de 20 a 47%. El amplio rango de las tasas de visualización (20-90%) posiblemente puede explicarse por varios factores8: primero, la posibilidad de encontrar vasos linfáticos de las extremidades superiores o los ganglios correspondientes depende de la extensión de la cirugía axilar, en segundo lugar, la definición de un procedimiento ARM exitoso difiere entre los diferentes estudios. Algunos estudios informaron tasas de visualización de solo los vasos linfáticos ARM, otros solo los ganglios linfáticos ARM y, finalmente, algunos estudios informaron ambos. Los aspectos técnicos del procedimiento ARM son un posible tercer factor que podría explicar la diferencia en las tasas de visualización.
El procedimiento ARM que usa solo Tc-99m no puede llevarse a cabo simultáneamente con la técnica BSGC de doble trazador en la que también se usa Tc-99m. Además de la mayor duración de la cirugía, una limitación importante del uso de Tc-99m es la imposibilidad de mapear los vasos linfáticos ARM, que también deben conservarse para realizar un procedimiento ARM completo.
Una ventaja importante de usar el verde de indocianina en comparación con otras técnicas es la posibilidad de combinar el procedimiento ARM con el trazador estándar en BSGC. Además, no se han reportado reacciones alérgicas sistémicas y el «tatuaje verde» desaparece un poco más rápido en comparación con el tinte azul (en unos días, hasta unos pocos meses).
El uso de verde para identificar los ganglios procedentes del miembro superior permite además la utilización de otros trazadores para determinar el drenaje mamario e identificar el GC, como el Tc o el azul11,12.
El mapeo de los vasos linfáticos permitiría entonces la identificación y preservación de los vasos linfáticos de drenaje del brazo durante la disección de los ganglios linfáticos axilares. Los resultados de ARM ilustraron la variabilidad significativa en la ubicación anatómica de los linfáticos del brazo, que eran distintos de los linfáticos adyacentes de la mama13. De esta forma, el procedimiento ARM brinda al cirujano de mama la oportunidad de adaptar la disección ganglionar a la anatomía linfática individual de una paciente para preservar el drenaje linfático del brazo durante una BSGC o LA.
La preservación de los vasos linfáticos del brazo, en teoría, debería conducir a una disminución del riesgo de LE de las extremidades superiores14. Un metaanálisis publicado en 201615 mostró una incidencia de LE del 4,1% en pacientes con ARM sujetos a BSGC o LA. Otros 2 metaanálisis más recientes16,17 mostraron que globalmente una gran mayoría de los pacientes obtienen más beneficios con la microcirugía linfática que del tratamiento convencional.
Un metaanálisis reciente15 mostró una incidencia de LE del 4,1% en pacientes con ARM sujetos a BSGC o LA. Sin embargo, el potencial de dejar una enfermedad residual oculta en la axila es una preocupación importante. La resección oncológica no debe verse comprometida para reducir el riesgo del LE. En un estudio que investiga la utilidad de ARM en las mujeres con ganglios positivos, se encontró la enfermedad metastásica en el 18% de los ganglios linfáticos ARM, lo que sugiere que esta técnica no es apropiada para tumores malignos más avanzados18.
De esta forma algunas instituciones han comenzado a realizar ARM19, inyectando azul vital en el brazo cuando se realiza una disección de ganglios linfáticos axilares para el cáncer de mama, en un esfuerzo por identificar y preservar los ganglios linfáticos que drenan la extremidad superior15.
Un reciente artículo de revisión14 muestra que el ARM puede ser utilizado en casos en los cuales el ganglio centinela también sea parte del drenaje linfático del miembro superior. En tales casos, una vez resecado el ganglio, podría realizarse una anastomosis linfático-venosa (Lymphatic Venous Anastomosis [LVA]) inmediatamente después como procedimiento profiláctico secundario. Empleando este algoritmo, a los 14 meses de seguimiento, la tasa global del LE fue del 18,7% cuando se seccionó un canal linfático azul identificado sin un procedimiento de reanastomosis correctiva; esta tasa bajó al 0% cuando se realizó una reanastomosis inmediata.
La técnica ARM ayuda a definir la anatomía linfática axilar para que el cirujano durante la intervención pueda evitar lesiones inadvertidas en los vasos linfáticos del brazo y también preservar los ganglios que drenan el brazo, realizando así una disección de ganglios axilares más selectiva e informada20,21.
En 2020, Siyao Liu et al. concluyeron que en las pacientes sujetas a ARM y BSGC se puede evitar la resección innecesaria de ganglios no centinelas. También establecieron una relación entre los ARM residuales y la presencia de LE en aquellas sujetas a LA22.
Reconstrucción inmediata de vías de drenaje linfáticoEn 1969, se describió por primera vez el bypass linfático-venoso como un enfoque de tratamiento para la LE crónica, donde los linfáticos enfermos se puenteaban mediante la realización de anastomosis de linfáticos sanos a una vena cercana para facilitar el flujo normal.
Como se detalló anteriormente, el ARM proporcionó un plano individualizado de los ganglios linfáticos y, por lo tanto, sus canales linfáticos individuales drenando el brazo. Al realizar una LVA inmediatamente después de la linfadenectomía, los linfáticos aferentes del brazo se pueden redirigir a ramas colaterales de la vena axilar para restaurar el flujo linfático fisiológico. Más importante aún, esta técnica también eliminó el potencial de dejar malignidad oculta residual en la axila23.
Con el advenimiento de las técnicas microquirúrgicas fue posible disponer de nuevas técnicas quirúrgicas para el tratamiento del LE, englobadas dentro de la categoría de procedimientos fisiológicos. Los procedimientos más practicados incluyen LVA y Transferencia de Ganglios Linfáticos Vascularizados (Vascularized Lymph Node Transfer [VLNT]), aunque esta última excede los alcances de esta revisión. Estas cirugías apuntan a abordar el deterioro fisiológico que resulta en LE, tratando de eludir las áreas de los linfáticos dañados al desviar la linfa en el sistema venoso o mediante la sustitución de los canales y ganglios linfáticos perdidos, respectivamente.
La LVA es una de las técnicas quirúrgicas linfáticas que se utilizan actualmente. Sus raíces comenzaron con Jacobson en 1962, quien describió por primera vez la idea de crear una derivación linfovenosa en un modelo canino24. Unos años más tarde, Sedlacek empleó por primera vez esta técnica en humanos, realizando derivaciones linfovenosas termino-laterales a la vena safena. Los resultados de este estudio, así como otros, destacaron el problema del flujo de retorno en las grandes venas receptoras. Esto llevó a Yamada a tratar de remediar este problema ligando ramas de la vena safena al realizar las anastomosis linfovenosas, en un intento de reducir el flujo de retorno a los vasos linfáticos. Este trabajo destacó la importancia de utilizar la técnica microquirúrgica para la anastomosis a las vénulas de bajo flujo en lugar de sistemas de alto flujo.
El tiempo, número, ubicación y configuración de las anastomosis varía en función de los cirujanos25. La LVA se ha realizado en todas las etapas del LE pero en general se acepta que es más fácil y eficaz en estadios precoces que tardíos19,26,27.
Principalmente tenemos que tener en cuenta que existe un grupo de pacientes en los cuales el procedimiento podría tener mejores beneficios, pacientes con factores de riesgo para desarrollar LE poscirugía14: obesidad, uso de quimioterapia (taxanos), más de 5 ganglios extirpados y uso de radioterapia.
Para cualquier técnica que se emplee, hay factores que influyen en el éxito de LVA. Se debe identificar una vena adecuada para anastomosis. Esta debe ser de tamaño compatible, en la ubicación apropiada y mostrar un mínimo, si lo hay, de reflujo cuando se divide. Las venas más grandes pueden tener un aumento de la presión intraluminal que puede resultar en reflujo venoso en el canal linfático después de la anastomosis28. Koshima et al. han intentado superar este problema con el uso de técnicas supermicroquirúrgicas, donde el tamaño de los canales linfáticos y las venas utilizadas son inferiores a 0,8 mm de diámetro.
La LVA clásica que utiliza la técnica supermicroquirúrgica se ha convertido en el método preferido de bypass linfático. La disección se realiza bajo el microscopio en el plano subcutáneo superficial para localizar una buena vénula receptora de 1 mm y un canal linfático (o varios). Una vez que se determina un sitio de derivación, el linfático se anastomosa (usualmente en forma término terminal) a la vénula utilizando nylon 11-0 o 12-0 con gran aumento.
Incluso con una variación significativa en las técnicas quirúrgicas, la LVA se ha establecido como una herramienta esencial en la gestión del LE. En el seguimiento a largo plazo de 90 pacientes sujetos a LVA, O'Brien et al. encontraron mejoras objetivas en un 42% de los pacientes, mejoras subjetivas en el 73% y una reducción media del volumen en todos los pacientes del 44%29. Chang et al. también publicaron recientemente un análisis prospectivo de LVA en 100 pacientes y a los 12 meses posteriores encontró una reducción del volumen medio del 61% en el LE de la extremidad superior en etapa temprana y 17% en estadio avanzado26. Otros estudios han corroborado estos hallazgos al tiempo que apoyan una disminución en el volumen del miembro superior, una disminución de las tasas de infección y una disminución de la necesidad del uso de prendas de compresión después de LVA30–32. Las complicaciones de LVA son inusuales o mínimas, incluyendo infección, fístula linfática y problemas de cicatrización de heridas.
Para la LVA, la mayoría de los estudios han citado una disminución de la tasa de celulitis. Además, la volumetría ha mostrado en el mejor de los casos una disminución del 75% del volumen en el 73% de los pacientes y, en el peor de los casos, ningún cambio en el 50%, con una reducción de volumen promedio del 55%3. Un metaanálisis reciente identificó 22 estudios que utilizaron el bypass linfovenoso, demostrando que el 89% de los pacientes informan una mejoría subjetiva, el 88% experimenta una mejora cuantitativa y el 56% pudo suspender la terapia de compresión30. La idea de una mayor eficacia en la enfermedad en etapa temprana es respaldada por un estudio reciente que compara el bypass linfovenoso con la transferencia de ganglios linfáticos para el estadio clínico II o LE de las extremidades31.
Todas estas técnicas también pueden ser aplicadas en la prevención primaria del LE32–37.
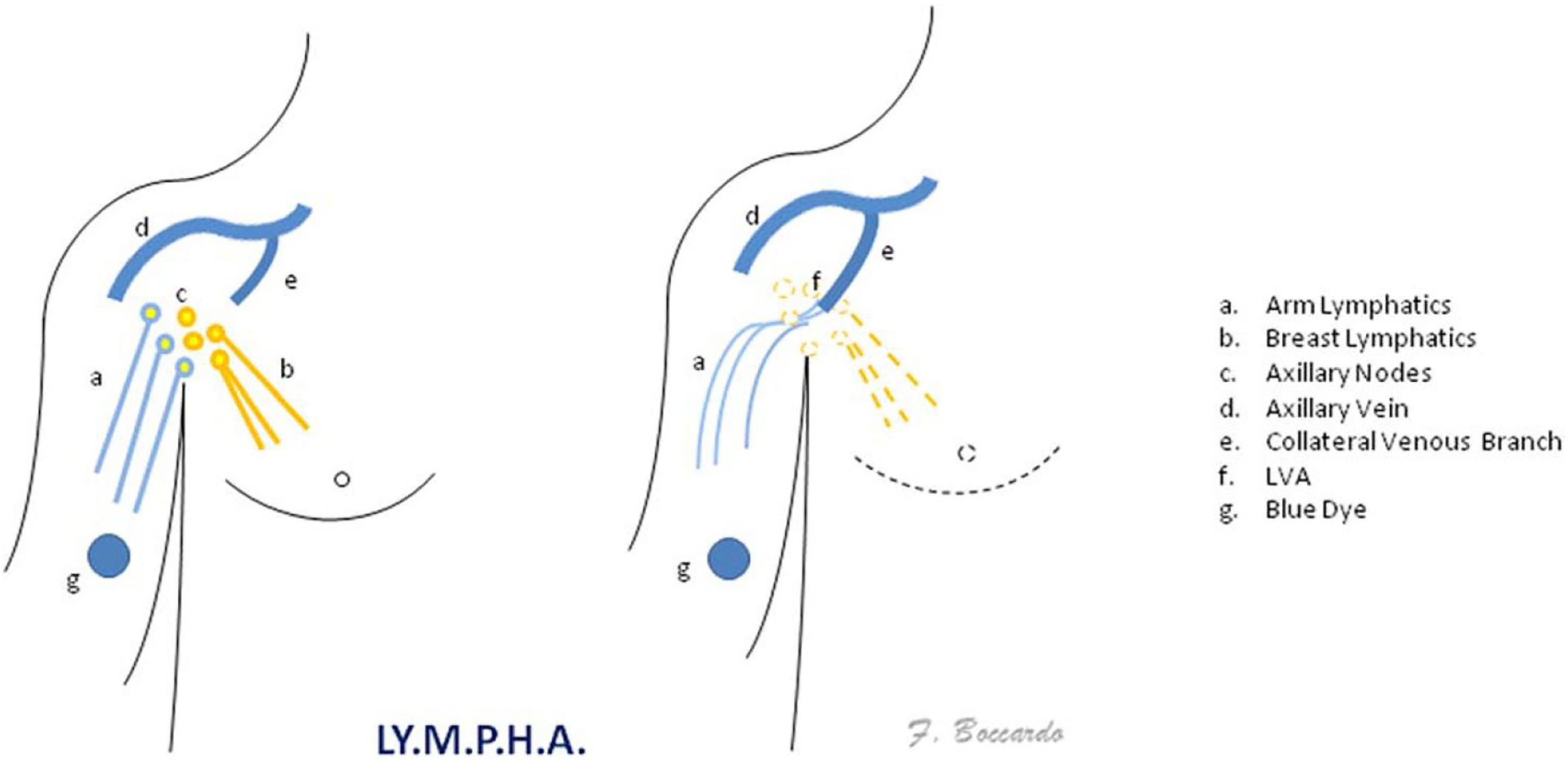
Un procedimiento especialmente diseñado para ayudar a prevenir el LE asociado con la cirugía de cáncer de mama es Lymphatic Microsurgical Preventing Healing Approach (LYMPHA)38 (en español, Enfoque de Curación Microquirúrgico Linfático), que consiste en anastomosar los vasos linfáticos del brazo a una rama colateral de la vena axilar en el momento de la disección ganglionar, para tratar de prevenir el LE tras inyectar por vía intradérmica y subcutánea una pequeña cantidad (1-2 ml) de tinte azul en la superficie medial del brazo, lo que ayuda a localizar las vías linfáticas de drenaje del brazo39. Se resecan todos los ganglios azules y se preparan de 2 a 4 linfáticos aferentes principales del brazo, los cuales se utilizan para la anastomosis. Los vasos linfáticos se introducen dentro de la vena seleccionada con un punto en forma de U en forma «telescópica». Se dan otros pocos puntos para fijar la adventicia linfática a la pared de la vena (fig. 1).
Dibujo esquemático de la técnica LYMPHA (con el permiso de F. Boccardo y John Wiley and Sons39).
Las indicaciones de la técnica LYMPHA se basan en parámetros clínicos y linfogammagráficos. Es bien sabido que la obesidad predispone al LE y, por lo tanto, los pacientes con un índice de masa corporal superior a 30 se consideran de alto riesgo y son candidatos para LYMPHA.
La técnica demostró no solo prevenir el LE, sino también reducir las complicaciones linfáticas tempranas (linforrea y linfocele) gracias a la presión intralinfática regional reducida. Los resultados informados durante 4 años en 74 pacientes que han recibido este procedimiento, han demostrado que solo 3 pacientes han desarrollado LE, según lo determinado por volumetría y linfogammagrafía. Este riesgo de LE del 4% se compara favorablemente con la incidencia del LE de 13 a 65% en las mujeres sujetas a disección de ganglios linfáticos axilares.
Estos resultados se replicaron en los Estados Unidos en 2 estudios de un solo centro donde se informaron tasas de LE del 12,5% después de LA con LYMPHA. Esta técnica se modificó aún más utilizando isotiocianato de fluoresceína para identificar los linfáticos del brazo. Esta modificación se hizo necesaria ya que los cirujanos de la mama a menudo eligen el colorante azul para la identificación de los linfáticos mamarios y los ganglios centinelas, lo que complica la capacidad del cirujano reconstructivo para diferenciar entre los linfáticos del brazo y de la mama40 (fig. 2).
Esquema modificado de la técnica LYMPHA. A) El colorante azul y el radiotrazador nuclear están reservados para la identificación de los ganglios linfáticos centinela de la mama. El isotiocianato de fluoresceína (FITC) se inyecta en la cara interna y superior del brazo proximal. B) Después de completar la disección axilar y la extracción de los ganglios linfáticos de los niveles 1 y 2, se identifican los canales linfáticos del brazo, ahora «resplandecientes» de la inyección de FITC, y se vuelven a dirigir en una vena axilar afluente (con el permiso de Singhal Dhruv y John Wiley and Sons40).
La duración del procedimiento en sí (linfoanastomosis) es de unos 15 min, y la identificación de linfáticos y ganglios que drenan el brazo es factible en el 85,7%41.
Campisi et al.42 han desarrollado técnicas de Múltiples Anastomosis Venosas-Linfáticas /Múltiples Anastomosis Linfáticas-Venosas-Linfáticas. Las anastomosis se realizan, al igual que en el procedimiento LYMPHA, en un solo sitio utilizando vasos linfáticos más grandes unidos a las ramas colaterales de las venas principales cercanas a las válvulas venosas para evitar el flujo de sangre hacia atrás y el cierre de la anastomosis.
En 2017, algunos autores25,43–46 han descrito unas modificaciones del procedimiento LYMPHA, algunas de las cuales no requieren la utilización de técnicas de microcirugía. Durante la linfadenectomía, se identifican los canales linfáticos azules seccionados y al finalizar la disección, esos canales se disecan cuidadosamente y se invaginan utilizando una técnica de manga en el extremo cortado de una vena vecina con 2 puntos de sutura no absorbibles 7-0. El microscopio no se usa en ninguna parte de esta cirugía.
El bypass linfovascular conlleva bajas tasas de complicaciones. Las complicaciones más comúnmente citadas incluyen la necesidad de un procedimiento adicional (10%), linforrea (4%) y celulitis (4%)24. Probablemente la mayor dificultad en instaurar un programa de tratamiento quirúrgico combinado3 sea la necesidad de contar con equipos multidisciplinares.
En cuanto a las contras de utilizar la LVA, tendremos en consideración:
El LE tiene costes sustanciales independientemente de la modalidad de tratamiento. El costo del bypass linfovenoso parece comparable al de la terapia descongestiva completa sola: los costos quirúrgicos del bypass linfovenoso se compensan con los ahorros de la terapia continua47.
La linfoanastomosis profiláctica parece ser económicamente preferible al compararlo con la mastectomía asociada a la LA sola, desde una perspectiva de minimización de costes, y da como resultado un ahorro de costos promedio de 7.646,65 dólares (45,2%) por paciente a lo largo de su vida48.
Sin duda, habrá que tener en cuenta el tiempo destinado al procedimiento a la hora de planificar las intervenciones del día.
ConclusionesSin duda la mayor aplicación de los procedimientos de prevención quirúrgica del LE estará asociada a un tratamiento axilar personalizado49.
Los estudios publicados son en general de baja calidad y un con un alto riesgo de sesgo, e impiden la formulación de recomendaciones sólidas a favor de la preservación linfática, a pesar de que los informes preliminares indican teóricamente que la inclusión de estos procedimientos puede disminuir significativamente la incidencia del LE17.
Los primeros resultados son prometedores y el seguimiento a largo plazo puede hacer que el procedimiento sea una rutina3,35,50.
FinanciaciónNinguna
Consideraciones éticasNo existe conflicto ético.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. Todos los autores han cumplido con las condiciones estipuladas para la publicación y declaran que no existe conflicto de intereses en relación con el presente manuscrito, de acuerdo con las instrucciones a los autores.
Contribución de los autoresLos 3 autores han participado por igual en la confección del manuscrito.