Determinar si las pacientes de más de 70 años con diagnóstico de cáncer de mama reciben un infratratamiento en comparación a las mujeres de menos de 70 años.
Pacientes y métodosSe han incluido 140 pacientes con diagnóstico de cáncer de mama en los años 2012 y 2013 en el Servicio de Patología Mamaria del Hospital Universitario Parc Taulí (Sabadell, Barcelona). Las pacientes se han clasificado en función de su edad en el momento del diagnóstico: <70 años (grupo A, n=70) y ≥70 años (grupo B, n=70). Entre ambos grupos se ha comparado si existen diferencias en el modo de presentación, el tipo y grado histológico, el estadio anatómico, el inmunofenotipo, la técnica quirúrgica utilizada en la mama y axila, así como el tratamiento adyuvante recibido.
ResultadosLas pacientes añosas presentan tumores de mayor tamaño y en estadios más avanzados en el momento del diagnóstico. También presentan una menor tasa de cirugía en la mama (grupo A: 98,6% vs. grupo B: 78,6%), axila (grupo A: 98,6% vs. grupo B: 69,1%), menor ampliación en caso de márgenes afectos (grupo A: 100% vs. grupo B: 55%) y mayor uso de la hormonoterapia como tratamiento primario (grupo A: 0% vs. grupo B: 17,1%).
ConclusionesHemos realizado un infratratamiento a igual estadificación en las pacientes añosas, especialmente a partir de los 85 años. En este subgrupo poblacional existe una mayor comorbilidad que ha sido un factor clave a la hora de indicar la opción terapéutica. Consideramos que las pacientes añosas deben recibir un asesoramiento geriátrico integral y multidisciplinar.
The aim of this study was to determine if patients older than 70 years with breast cancer received inferior treatment compared with women younger than 70 years.
Patients and methodsThe study population consisted of 140 patients with primary breast cancer treated at Parc Taulí Hospital (Sabadell, Barcelona) between 2012 and 2013. Patients were classified based on their age at diagnosis: <70 years (group A, n=70) and ≥70 years (group B, n=70). Age groups were compared to determine the presence of possible differences in the mode of presentation, tumoral grade and histology, anatomical stage, immunophenotype, the breast and axillary surgical technique used, and adjuvant therapy.
ResultsOlder patients had larger tumours in more advanced stages at the time of diagnosis. These patients were less likely to undergo breast surgery (group A: 98.6% and group B: 78.6%) and axillary surgery (group A: 98.6% and group B: 69.1%), underwent lower amplification of the affected margins (group A: 100% and group B: 55%) and were more likely to receive primary endocrine treatment (group A: 0% and group B: 17.4%).
ConclusionElderly patients were under-treated compared with younger patients with the same tumoral stage, especially those older than 85 years. This subgroup has major comorbidity, which is a key factor in indicating the therapeutic option. We believe that elderly patients should receive multidisciplinary and comprehensive geriatric counselling.
El cáncer de mama es la neoplasia maligna más frecuente en la mujer con una incidencia que aumenta con la edad. Según la Agencia Internacional de Investigación sobre el Cáncer en 2018 en España se diagnosticaron 32.825 casos nuevos de cáncer de mama femenino de los cuales 9.954 (30,3%) correspondieron a mujeres de 70 años o más. Según la misma fuente, y con respecto a la mortalidad, fallecieron en este mismo año 6.421 mujeres con cáncer de mama en España, de las cuales 3.665 (57%) eran mujeres de 70 años o más. Por tanto, el cáncer de mama es una patología prevalente en la población añosa y que se asocia a una mortalidad elevada.
Existe la percepción de que el cáncer de mama en la mujer mayor tiende a comportarse de forma más indolente, sin embargo y como apuntan los datos anteriores, la mortalidad en este subgrupo poblacional es elevada. Este peor pronóstico puede estar en relación con que no existen programas de detección precoz del cáncer de mama en esta franja de edad, por lo que el diagnóstico se limita al screening oportunista, a la consulta de la propia paciente por la aparición de alguna manifestación clínica o al hallazgo incidental. Todo ello contribuye a un retraso en el diagnóstico, con la consecuente presentación de tumores de mayor tamaño, estadio anatómico y mayor frecuencia de afectación ganglionar.
Las recomendaciones actuales de la European Society of Mastology (EUSOMA) y la International Society of Geriatric Oncology (SIOG)1 es que las pacientes de 70 años o más deben recibir el mismo tratamiento quirúrgico que las pacientes más jóvenes. Sin embargo, dicho tratamiento no siempre se lleva a cabo debido al estado funcional, comorbilidad y esperanza de vida de la paciente añosa así como el temor a las complicaciones y toxicidades inducidas por los tratamientos y las actitudes negativas por parte de enfermas y sus familiares. Concretamente, se modifica la técnica quirúrgica en la mama y/o se prescinde de la cirugía axilar, así como también no completar el tratamiento con quimioterapia o radioterapia, u ofrecer tratamiento hormonal primario con el objetivo de obviar la cirugía2–5.
Por lo tanto, por un lado, las mujeres de 70 años o más pueden presentar un retraso en el diagnóstico de cáncer de mama que junto con las comorbilidades asociadas conlleva que dichas pacientes tengan una menor probabilidad de recibir el tratamiento estándar para su enfermedad6,7.
Nos planteamos como objetivo de este trabajo revisar si las pacientes de 70 años o más con diagnóstico de cáncer de mama en nuestro centro se les ha realizado o no un infratratamiento.
MétodosDiseño y participantesEstudio observacional retrospectivo en el que se han incluido 140 pacientes diagnosticadas de cáncer de mama en los años 2012 y 2013 en el Servicio de Patología Mamaria del Hospital Universitario Parc Taulí (Sabadell, Barcelona).
VariablesLa principal variable de estudio ha sido la edad de la paciente en el momento del diagnóstico (≥70 años, <70). Entre ambos grupos se ha comparado si existen diferencias en el modo de presentación, la histología (según WHO), el estadio anatómico (según AJCC), el grado histológico (según Elston y Ellis), el perfil biológico (según Walker), la técnica quirúrgica utilizada en la mama y la axila, así como el tratamiento adyuvante recibido. Dentro de la cirugía conservadora incluimos la tumorectomía, segmentectomía y cuadrantectomía. El término metástasis a distancia no incluye la afectación ganglionar.
AnálisisLos datos han sido obtenidos de nuestra historia informatizada.
Se ha realizado el análisis descriptivo de todas las variables. Las variables cualitativas se han descrito mediante tablas de frecuencias de las diferentes categorías. Las variables cuantitativas se han descrito según su media, desviación estándar y rango. En el caso de comparación entre variables cualitativas, se ha utilizado el test de la chi al cuadrado. Para la comparación de una variable cuantitativa y una cualitativa se ha utilizado el test de la t de Student. En caso de no cumplirse las condiciones de aplicación, se han utilizado pruebas no paramétricas.
Para las pruebas de hipótesis se ha considerado el valor de p<0,05 el nivel de significación estadística. Las variables de estudio han sido analizadas con el paquete estadístico SPSS v. 17.0.
ResultadosSe han analizado 140 historias de pacientes con diagnóstico de cáncer de mama; 70 (grupo A) con una edad inferior a los 70 años en el momento del diagnóstico y 70 (grupo B), con una edad igual o superior a los 70 años.
La edad media en el momento del diagnóstico de las pacientes incluidas en el grupo A fue de 56 años (31-69) y en el grupo B de 78 años (70-93).
La mayoría de las pacientes con una edad inferior a 70 años fueron diagnosticadas dentro del programa de detección precoz del cáncer de mama. En cambio, el motivo de diagnóstico de las mujeres con una edad superior a los 70 fue el hallazgo, por la propia paciente o familiares, de una tumoración palpable a nivel de la mama o axila así como la existencia de síntomas o signos clínicos sospechosos de patología subyacente (tabla 1).
Motivo de diagnóstico del cáncer de mama en función de la edad
| Grupo A (<70 años) | Grupo B (≥70 años) | |
|---|---|---|
| PCCM | 60% (n=42) | 15,7 (n=11) |
| Clínica | 32,9% (n=23) | 72,9 (n=51) |
| Tumoración palpable mama o axilar | 32,9% (n=23) | 62,9 (n=44) |
| Lesión ulcerada | - | 4,3 (n=3) |
| Retracción del CAP | - | 5,7 (n=4) |
| AP neoplasia de mama | 1,4% (n=1) | 5,7 (n=4) |
| AP lesión premaligna | 2,9% (n=2) | 1,4% (n=1) |
| Antecedente familiar/portador BRCA | 1,4% (n=1) | 1,4% (n=1) |
| Clínica a distancia | - | 2,9 (n=2) |
| NC | 1,4% (n=1) | - |
AP: antecedente personal; CAP: complejo aréola pezón; NC: no consta; PCCM: programa de detección precoz del cáncer de mama.
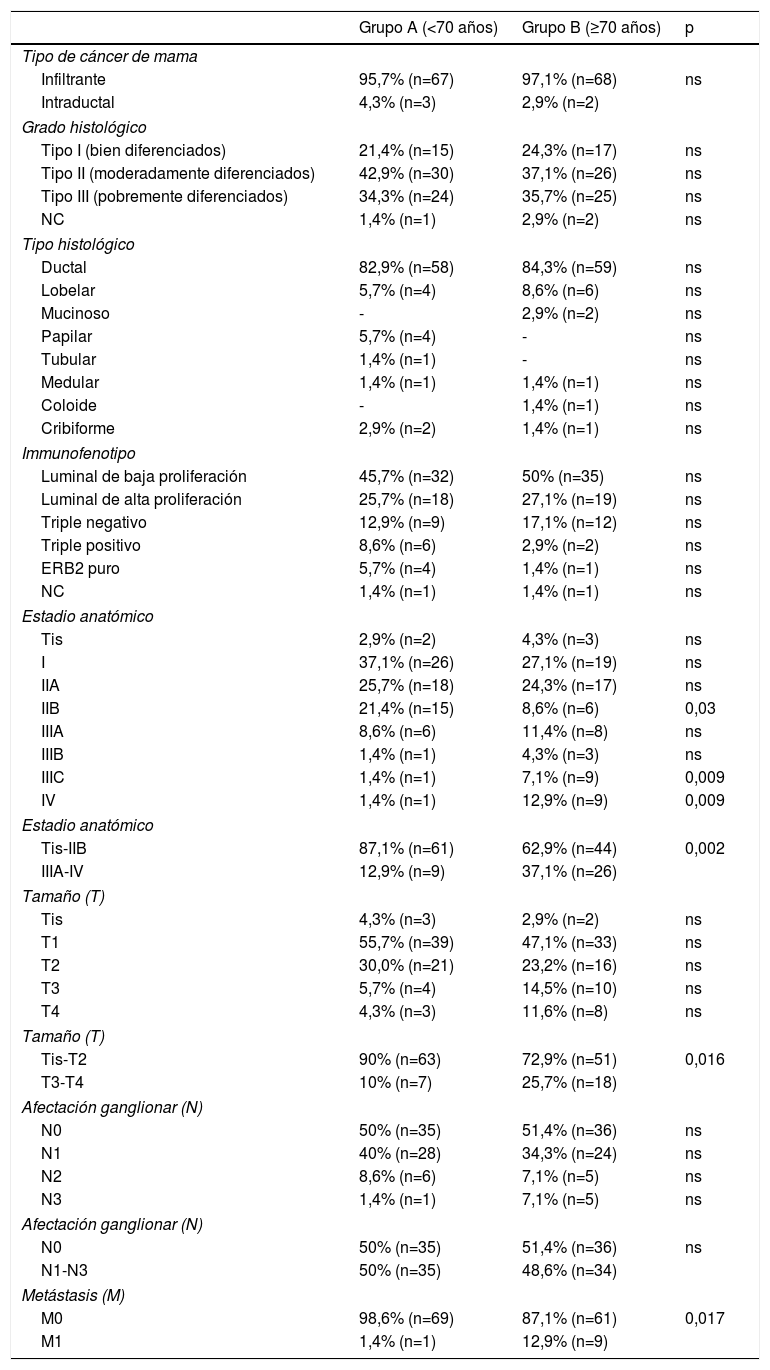
El estudio descriptivo (tabla 2) de la muestra refleja que no existen diferencias en la biología tumoral en función de la edad, dado que en ambos grupos los tumores ductales infiltrantes de fenotipo luminal son los más frecuentes. La mayor parte de las pacientes de menos de 70 años presentaron tumores T1-T2 (90%) y se diagnosticaron en estadios precoces, principalmente estadios I (37%) y IIA (26%), sin enfermedad a distancia (M1=1,4%). Al comparar los dos grupos observamos, con diferencias estadísticamente significativas (p<0,05), que las pacientes añosas presentan tumores de mayor tamaño, en estadio más avanzado (mayor porcentaje de neoplasias en estadio ≥IIIA) así como mayor porcentaje de metástasis. Las metástasis más frecuentes en este subgrupo han sido a nivel óseo, seguidas de las de hígado, piel, pulmón y pleura. No existen diferencias estadísticamente significativas respecto a la afectación ganglionar.
Características histológicas, estadio y TNM
| Grupo A (<70 años) | Grupo B (≥70 años) | p | |
|---|---|---|---|
| Tipo de cáncer de mama | |||
| Infiltrante | 95,7% (n=67) | 97,1% (n=68) | ns |
| Intraductal | 4,3% (n=3) | 2,9% (n=2) | |
| Grado histológico | |||
| Tipo I (bien diferenciados) | 21,4% (n=15) | 24,3% (n=17) | ns |
| Tipo II (moderadamente diferenciados) | 42,9% (n=30) | 37,1% (n=26) | ns |
| Tipo III (pobremente diferenciados) | 34,3% (n=24) | 35,7% (n=25) | ns |
| NC | 1,4% (n=1) | 2,9% (n=2) | ns |
| Tipo histológico | |||
| Ductal | 82,9% (n=58) | 84,3% (n=59) | ns |
| Lobelar | 5,7% (n=4) | 8,6% (n=6) | ns |
| Mucinoso | - | 2,9% (n=2) | ns |
| Papilar | 5,7% (n=4) | - | ns |
| Tubular | 1,4% (n=1) | - | ns |
| Medular | 1,4% (n=1) | 1,4% (n=1) | ns |
| Coloide | - | 1,4% (n=1) | ns |
| Cribiforme | 2,9% (n=2) | 1,4% (n=1) | ns |
| Immunofenotipo | |||
| Luminal de baja proliferación | 45,7% (n=32) | 50% (n=35) | ns |
| Luminal de alta proliferación | 25,7% (n=18) | 27,1% (n=19) | ns |
| Triple negativo | 12,9% (n=9) | 17,1% (n=12) | ns |
| Triple positivo | 8,6% (n=6) | 2,9% (n=2) | ns |
| ERB2 puro | 5,7% (n=4) | 1,4% (n=1) | ns |
| NC | 1,4% (n=1) | 1,4% (n=1) | ns |
| Estadio anatómico | |||
| Tis | 2,9% (n=2) | 4,3% (n=3) | ns |
| I | 37,1% (n=26) | 27,1% (n=19) | ns |
| IIA | 25,7% (n=18) | 24,3% (n=17) | ns |
| IIB | 21,4% (n=15) | 8,6% (n=6) | 0,03 |
| IIIA | 8,6% (n=6) | 11,4% (n=8) | ns |
| IIIB | 1,4% (n=1) | 4,3% (n=3) | ns |
| IIIC | 1,4% (n=1) | 7,1% (n=9) | 0,009 |
| IV | 1,4% (n=1) | 12,9% (n=9) | 0,009 |
| Estadio anatómico | |||
| Tis-IIB | 87,1% (n=61) | 62,9% (n=44) | 0,002 |
| IIIA-IV | 12,9% (n=9) | 37,1% (n=26) | |
| Tamaño (T) | |||
| Tis | 4,3% (n=3) | 2,9% (n=2) | ns |
| T1 | 55,7% (n=39) | 47,1% (n=33) | ns |
| T2 | 30,0% (n=21) | 23,2% (n=16) | ns |
| T3 | 5,7% (n=4) | 14,5% (n=10) | ns |
| T4 | 4,3% (n=3) | 11,6% (n=8) | ns |
| Tamaño (T) | |||
| Tis-T2 | 90% (n=63) | 72,9% (n=51) | 0,016 |
| T3-T4 | 10% (n=7) | 25,7% (n=18) | |
| Afectación ganglionar (N) | |||
| N0 | 50% (n=35) | 51,4% (n=36) | ns |
| N1 | 40% (n=28) | 34,3% (n=24) | ns |
| N2 | 8,6% (n=6) | 7,1% (n=5) | ns |
| N3 | 1,4% (n=1) | 7,1% (n=5) | ns |
| Afectación ganglionar (N) | |||
| N0 | 50% (n=35) | 51,4% (n=36) | ns |
| N1-N3 | 50% (n=35) | 48,6% (n=34) | |
| Metástasis (M) | |||
| M0 | 98,6% (n=69) | 87,1% (n=61) | 0,017 |
| M1 | 1,4% (n=1) | 12,9% (n=9) | |
NC: no consta; ns: no diferencias estadísticamente significativas.
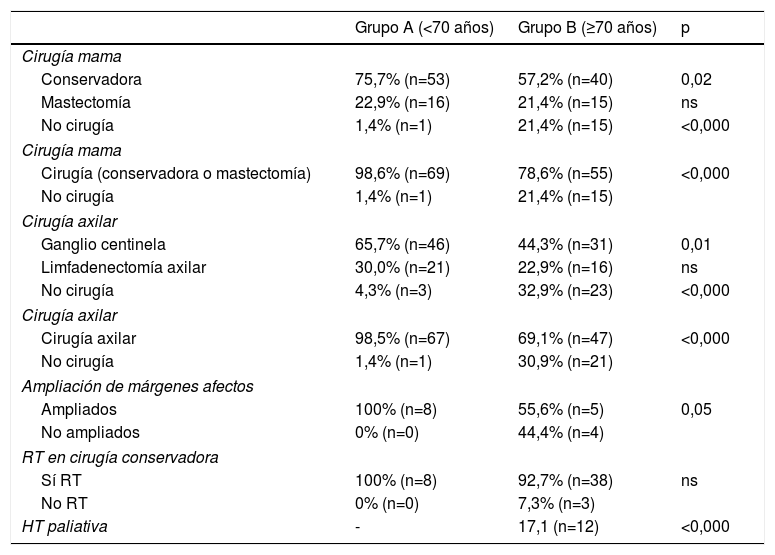
En la tabla 3 se recogen los resultados obtenidos después de realizar un análisis descriptivo y comparativo de las variables correspondientes al tratamiento del cáncer de mama. Ella muestra que, de forma estadísticamente significativa, existe una mayor adecuación del tratamiento entre la población añosa, con una menor tasa de cirugía mamaria (grupo A: 98,6% vs. grupo B: 78,6%), menor tasa de cirugía axilar (grupo A: 98,6% vs. grupo B: 69,1%) y menor tasa de ampliación en caso de márgenes afectos (grupo A: 100% vs. grupo B: 55%). De las pacientes de más de 70 años en las que se desestimó el tratamiento quirúrgico (21,4%), el 17,1% realizó hormonoterapia.
Características del tratamiento quirúrgico y adyuvante
| Grupo A (<70 años) | Grupo B (≥70 años) | p | |
|---|---|---|---|
| Cirugía mama | |||
| Conservadora | 75,7% (n=53) | 57,2% (n=40) | 0,02 |
| Mastectomía | 22,9% (n=16) | 21,4% (n=15) | ns |
| No cirugía | 1,4% (n=1) | 21,4% (n=15) | <0,000 |
| Cirugía mama | |||
| Cirugía (conservadora o mastectomía) | 98,6% (n=69) | 78,6% (n=55) | <0,000 |
| No cirugía | 1,4% (n=1) | 21,4% (n=15) | |
| Cirugía axilar | |||
| Ganglio centinela | 65,7% (n=46) | 44,3% (n=31) | 0,01 |
| Limfadenectomía axilar | 30,0% (n=21) | 22,9% (n=16) | ns |
| No cirugía | 4,3% (n=3) | 32,9% (n=23) | <0,000 |
| Cirugía axilar | |||
| Cirugía axilar | 98,5% (n=67) | 69,1% (n=47) | <0,000 |
| No cirugía | 1,4% (n=1) | 30,9% (n=21) | |
| Ampliación de márgenes afectos | |||
| Ampliados | 100% (n=8) | 55,6% (n=5) | 0,05 |
| No ampliados | 0% (n=0) | 44,4% (n=4) | |
| RT en cirugía conservadora | |||
| Sí RT | 100% (n=8) | 92,7% (n=38) | ns |
| No RT | 0% (n=0) | 7,3% (n=3) | |
| HT paliativa | - | 17,1 (n=12) | <0,000 |
HT: hormonoterapia; RT: radioterapia.
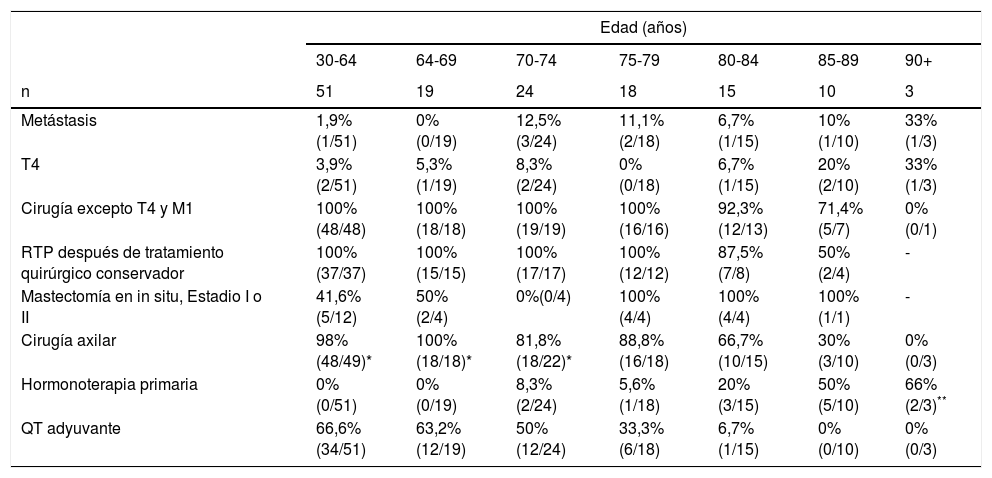
Los resultados anteriores estadificados por subgrupos de edad se reflejan en la tabla 4. Dicho análisis pone de manifiesto que la adecuación del tratamiento se realiza sobre todo a partir de los 85 años, con una menor tasa de cirugía en mama y axila, radioterapia después del tratamiento quirúrgico conservador, de quimioterapia y mayor uso de la hormonoterapia primaria.
Características por subgrupos de edad
| Edad (años) | |||||||
|---|---|---|---|---|---|---|---|
| 30-64 | 64-69 | 70-74 | 75-79 | 80-84 | 85-89 | 90+ | |
| n | 51 | 19 | 24 | 18 | 15 | 10 | 3 |
| Metástasis | 1,9%(1/51) | 0%(0/19) | 12,5%(3/24) | 11,1%(2/18) | 6,7%(1/15) | 10%(1/10) | 33%(1/3) |
| T4 | 3,9%(2/51) | 5,3%(1/19) | 8,3%(2/24) | 0%(0/18) | 6,7%(1/15) | 20%(2/10) | 33%(1/3) |
| Cirugía excepto T4 y M1 | 100%(48/48) | 100%(18/18) | 100%(19/19) | 100%(16/16) | 92,3%(12/13) | 71,4%(5/7) | 0%(0/1) |
| RTP después de tratamiento quirúrgico conservador | 100%(37/37) | 100%(15/15) | 100%(17/17) | 100%(12/12) | 87,5%(7/8) | 50%(2/4) | - |
| Mastectomía en in situ, Estadio I o II | 41,6%(5/12) | 50%(2/4) | 0%(0/4) | 100%(4/4) | 100%(4/4) | 100%(1/1) | - |
| Cirugía axilar | 98%(48/49)* | 100%(18/18)* | 81,8%(18/22)* | 88,8%(16/18) | 66,7%(10/15) | 30%(3/10) | 0%(0/3) |
| Hormonoterapia primaria | 0%(0/51) | 0%(0/19) | 8,3%(2/24) | 5,6%(1/18) | 20%(3/15) | 50%(5/10) | 66%(2/3)** |
| QT adyuvante | 66,6%(34/51) | 63,2%(12/19) | 50%(12/24) | 33,3%(6/18) | 6,7%(1/15) | 0%(0/10) | 0%(0/3) |
El cáncer de mama es la neoplasia maligna más frecuente en la mujer cuyo riesgo aumenta con la edad. De hecho, aproximadamente la tercera parte de las pacientes con diagnóstico de cáncer de mama tienen 70 años o más8,9, y ello, en parte, es debido a los continuos progresos científicos y el mejor control de las enfermedades crónicas que han permitido aumentar de forma considerable la esperanza de vida en los países desarrollados.
En este subgrupo poblacional se plantea el hecho de que existen pocos estudios que incluyan a pacientes añosas dentro de su población diana, especialmente aquellas que revelan fragilidad, y por tanto existe una falta de evidencia científica y protocolos de actuación específicos para el manejo terapéutico del cáncer de mama en estas mujeres. Por otra parte existe una mayor tasa de comorbilidad, estado funcional y dependencia. Debido a esto en las pacientes de 70 años o más se tiende a realizar una adecuación del tratamiento oncológico, como la omisión del tratamiento quirúrgico o adyuvante, lo que conlleva a peores resultados en cuanto a supervivencia global respecto a la población más joven10.
Las pacientes sanas de 70 años o más pueden y deben recibir el mismo tratamiento quirúrgico y radioterápico adyuvante que las pacientes jóvenes11–13. Debemos evitar el sobrediagnóstico de fragilidad mediante el asesoramiento geriátrico integral14–18, que permitirá seleccionar aquellas pacientes mayores que deben beneficiarse del tratamiento estándar y que corresponde a su estadificación, de aquellas que no son candidatas a terapias con intención curativa por incluirse dentro de la denominada población frágil. Es la situación funcional de la paciente, especialmente aquella con una adecuada expectativa de vida, el elemento fundamental capaz de condicionar la elección de cada tipo de tratamiento.
Los hallazgos de nuestro estudio se corroboran con los datos obtenidos en la mayoría de los trabajos publicados a este respecto. En las pacientes añosas encontramos tumores de mayor tamaño, en estadios más avanzados y con mayor afectación de órganos a distancia (grupo A: 1,4%; grupo B: 12,9%). Ello ha contribuido a una mayor adecuación del tratamiento entre dicha población, con una menor tasa de cirugía en mama y axila, menor tasa de ampliación de aquellos márgenes tumorales afectos, así como un mayor uso de la hormonoterapia como tratamiento primario paliativo (grupo A: 0%; grupo B: 17,1%).
En conclusión, nuestros resultados corroboran el objetivo del trabajo: tendemos a realizar un infratratamiento a igual estadiaje en las pacientes añosas, especialmente a partir de los 85 años. Sin embargo, consideramos que la edad cronológica por sí sola no debe ser una limitación para el tratamiento médico o quirúrgico del cáncer de mama y por ello, en nuestro centro actualmente realizamos un asesoramiento geriátrico integral y multidisciplinar con el fin de valorar otros factores, como la comorbilidad, los efectos adversos o el deseo de la paciente para indicar la mejor opción terapéutica en cada caso, independientemente de la edad.
LimitacionesLa principal limitación de nuestro estudio es que se trata de un análisis retrospectivo por lo que algunas variables, como el asesoramiento geriátrico, no han podido ser incluidos en el trabajo. Además el tamaño muestral (n=140) puede ser considerado pequeño cuando es comparado con otros grupos de trabajo.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.