El Consenso de Cáncer de Mama y Fertilidad de la Sociedad Española de Senología y Patología Mamaria es un documento elaborado por un amplio grupo de expertos de todas las especialidades implicadas en cáncer de mama. El presente documento se concluyó en el Primer Congreso Español de la Mama, celebrado en Madrid en octubre de 2014, y es una actualización del consenso que fue publicado en Revista de Senología y Patología Mamaria en 2009. Los avances que se están produciendo, tanto en el campo de la fertilidad como en la oncología, obligarán sin ninguna duda a una nueva revisión de las recomendaciones en un futuro cercano.
The Consensus on Breast Cancer and Fertility of the Spanish Society of Senology and Breast Pathology (Sociedad Española de Senología y Patología Mamaria) is a document prepared by a wide group of experts in all the specialties involved in breast cancer. This document was finished at the 1st Spanish Congress on Breast Cancer, held in Madrid in October 2014, and is an update of the consensus document published in Revista de Senología y Patología Mamaria in 2009. Because of the advances currently taking place in the fields of both fertility and oncology, a new review of the recommendations will undoubtedly be needed in the near future.
La mujer de los países occidentales ha cambiado radicalmente su forma de vida desde la mitad del sigloxx. Los cambios sociológicos han provocado que el inicio de la maternidad se retrase de manera considerable y que se reduzcan el número de gestaciones por mujer. Han aparecido en consecuencia 2 terapias propias de este siglo hasta ahora no consideradas, como son la anticoncepción y el tratamiento de la esterilidad.
Por otra parte, también en Occidente, el cáncer de mama (CM) ha experimentado un incremento en su incidencia, y la edad de aparición es cada vez menor. El diagnóstico temprano y la actual terapéutica han conseguido unas tasas de curación muy favorables, con supervivencias superiores al 80%. La mujer superviviente desea muchas veces completar su deseo genésico, muchas veces mermado por los tratamientos recibidos.
Ante estas realidades, es obvio que aparezca una interacción entre la fertilidad y el CM. Es importante saber cómo impactan los tratamientos de anticoncepción y fertilidad en la aparición de un futuro cáncer mamario. Es imprescindible conocer cómo orientar y tratar a una mujer que sufre la enfermedad durante la gestación. Es deseable ayudar a aquellas mujeres que han sufrido un cáncer y desean ser madres.
Este Consenso de Cáncer de Mama y Fertilidad de la SESPM ha sido elaborado con alto rigor científico por un amplio y representativo grupo de especialistas implicados de alguna manera en este importante tema. El objetivo ha sido establecer las distintas recomendaciones basadas en la evidencia existente en este momento. En octubre del 2013, en el Primer Congreso de la Mama, celebrado en Madrid, se realizó una revisión del original con algunas modificaciones puntuales que hemos plasmado en este artículo. El progreso que se está produciendo tanto en el campo de la fertilidad como en el de la oncología obligará, en un futuro no muy lejano, realizar una nueva versión con los datos bibliográficos actualizados.
IntroducciónEn este momento todavía existe controversia respecto a cuál es la relación entre el CM y la fertilidad. Es necesario analizar los diferentes aspectos que abarcan este tema de forma independiente.
Los tratamientos actuales para el CM han mejorado de forma drástica la supervivencia, de forma que más del 90% de los CM se diagnostican en etapa local o locorregional, con una supervivencia a los 5años del 97 y del 79%, respectivamente. Asimismo, aproximadamente el 25% de las mujeres que padecen CM son premenopáusicas, y el 15% tienen menos de 45años. La incidencia de esta enfermedad ha aumentado anualmente en un 0,5% en la última década, y de manera más remarcable en mujeres por debajo de los 50 años.
Al mismo tiempo hay que tener en cuenta que la incidencia de embarazos a término tras el diagnóstico de CM es muy pequeña, alrededor del 3-8%, y corresponde solo al 20% de las pacientes que desearían tener descendencia. Por otra parte, se produce un incremento en el porcentaje de abortos espontáneos (asociándose un riesgo relativo de 1,7 [IC95%: 1,1-2,8]).
La infertilidad es un problema en pacientes jóvenes en las que se diagnostica un CM. La mayor parte de las pacientes que van a someterse a un tratamiento por CM no reciben información sobre los cambios que se van a producir en su capacidad genésica. Los tratamientos oncológicos conllevan la aparición de amenorrea, que en muchos casos es definitiva.
El diagnóstico de CM en una mujer joven en estadios iniciales y con una buena supervivencia conlleva el planteamiento de su futuro reproductivo. Existe, por tanto, un aumento progresivo de la demanda, por parte de mujeres jóvenes con CM, de una opción de preservación de la fertilidad.
Otro aspecto importante es qué papel juegan el embarazo y los tratamientos hormonales, ya sean los anticonceptivos, ya sean los tratamientos inductores de la ovulación, en la etiología del CM.
Cáncer de mama y anticoncepciónAnticonceptivos hormonales y riesgo de cáncer de mama en la población generalComparando con las mujeres que nunca han usado anticonceptivos hormonales (ACH), entre las mujeres jóvenes de menos de 45 años, usuarias actuales, existe un ligero aumento del riesgo de CM (RR=1,24; IC95%: 1,15-1,33). Este aumento de riesgo desaparece con el tiempo tras el cese de la toma (Collaborative Group on Hormonal Factors in Breast Cancer, 1996) y después de 10 años de suspender los anticonceptivos. Existe un aumento de riesgo demostrado en dosis mayores de 35μg de etinilestradiol.
Los contraceptivos orales (combinados y solo progestágeno) e inyectables parecen tener similares patrones de riesgo. No se dispone de evidencia sobre las vías transdérmica y vaginal.
Podemos afirmar que el uso de ACH es un factor de riesgo relativamente débil frente a otros cuantitativamente más importantes; se deben analizar otros elementos de riesgo y no se debe contraindicar la prescripción (Categoría 1 OMS).
Los resultados de preparaciones de altas dosis de estrógenos no difirieren significativamente de las preparaciones de baja dosis. No hay diferencias significativas en el riesgo de CM en relación con el tipo de progestágeno.
El uso de solo gestágenos, incluido el dispositivo intrauterino de liberación de levonorgestrel (DIU-LNG), no aumenta el riesgo de CM en la población general.
No parece existir especificidad de riesgo con el tipo de estrógeno o progestágeno, formulación o dosis.
Se ha modificado el perfil de la población: primer embarazo más tardío, hábitos dietéticos diferentes, sobrepeso, etc., que también pueden modificar el impacto del uso de ACH sobre el riesgo de CM, y por tanto es importante que se continúen realizando estudios epidemiológicos sobre este aspecto.
Posibles factores: edad, dosis y tiempoEn la población que utilizó anticonceptivos antes de 1975, el aumento de riesgo de CM se presenta en las mujeres <45años, especialmente en el grupo de mujeres que han tomado ACH durante 4 años antes del primer embarazo. Este riesgo desaparece a los 10 años de haber cesado en el empleo de ACH. (No confirmado en los estudios posteriores.)
No se dispone de estudios recientes de la misma categoría que el Estudio Colaborativo (1996) que analicen el impacto de los ACH actuales (menor dosis de estrógeno y gestágenos modernos) sobre el riesgo de CM.
Anticonceptivos hormonales y riesgo de cáncer de mama en mujeres con antecedentes familiares de cáncer de mama (sin diferenciar portadoras mutaciones)En este subgrupo de pacientes los estudios son contradictorios: estudios anteriores a 2000 indican aumento de riesgo en pacientes con historia familiar; trabajos posteriores a 2000 indican no aumento o incluso reducción de riesgo (Categoría 3 OMS).
Anticonceptivos hormonales y riesgo de cáncer de mama en mujeres portadoras de BRCA1/2Estudios recientes realizados en cohortes de mujeres portadoras de las mutaciones BRCA1/BRCA2 (con riesgo elevado de CM precoz) presentan resultados contradictorios: mientras que en un estudio se observó una reducción del riesgo de CM con el uso de ACH (después de 1975) entre las portadoras de BRCA1 (OR=0,22; IC95%: 0,10-0,49), otros estudios con 1.593 portadoras de mutaciones BRCA1/2 muestran un aumento del riesgo de CM en BRCA1/2 (HR=1,47; IC95%: 1,16-1,87) cuando su uso fue antes del primer parto. Asimismo, el riesgo es mayor cuando su uso se prolonga más de 5 años.
Por lo tanto, no hay evidencia suficiente para hacer recomendación en ningún sentido.
La ACH disminuye el riesgo de cáncer de ovario en la población general y en las portadoras de mutación, por lo que debe considerarse el balance riesgo/beneficio.
Anticonceptivos hormonales y riesgo de cáncer de mama en paciente con antecedente personal de cáncer de mamaEn el caso de mujeres con antecedente personal de CM no se recomienda utilizar ACH (Categoría 4 OMS).
Por tanto, en este subgrupo de pacientes se aconseja un método anticonceptivo no hormonal, como los métodos de barrera, dispositivo intrauterino de cobre, ligadura de trompas o vasectomía (Categoría 1 OMS).
Respecto a los DIU de progesterona, no hay evidencia científica suficiente de ausencia de riesgo. Varios estudios muestran la eficacia de estos dispositivos para reducir los efectos endometriales del tratamiento con tamoxifeno, sin que hasta el momento exista un incremento en las recidivas (Categoría 2 OMS).
Se deben utilizar los criterios de elegibilidad médica de la OMS, que clasifican los problemas de salud en 4 categorías:
Categoría 1. Ninguna restricción (se puede usar el método).
Categoría 2. Los beneficios superan a los riesgos.
Categoría 3. Los riesgos superan a los beneficios.
Categoría 4. No se deben usar.
Reducen el riesgo de CM con receptores hormonales positivos: el embarazo, el número de embarazos y la edad del primer embarazo a término (cuanto más joven, mayor reducción de riesgo).
En mujeres portadoras de mutaciones en BRCA2 el embarazo aumenta el riesgo de cáncer en mujeres premenopáusicas, por lo que es necesario un control estricto. En caso de decidir embarazo no hay evidencia suficiente para desaconsejarlo, pero se debe informar bien a la paciente. Hay un riesgo aumentado durante los 2 primeros años posdiagnóstico, y por lo tanto es preceptivo informar a la paciente y extremar los controles en este periodo. Asimismo, si la mujer decide lactancia materna en este caso, es obligatorio llevar un control estricto de la mama.
La lactancia materna disminuye el riesgo de CM, especialmente de tumores RH− y Her2+, de manera directamente proporcional a su duración, añadiéndose a la protección del embarazo por sí mismo.
Embarazo en paciente con historia personal de cáncer de mamaNo hay evidencia de que la gestación en las pacientes con antecedente personal de CM empeore el pronóstico; es necesario informar a estas mujeres antes y después del tratamiento con quimioterapia.
El tiempo de espera recomendado para la gestación tras finalizar el tratamiento del CM está en función del estadio inicial de la enfermedad, la edad de la paciente y la evolución posterior. No es aceptable un intervalo menor de 6 meses, siendo recomendable una demora de 2 años tras la finalización del tratamiento.
En pacientes con tumores RE+ se debe esperar de 3-6 meses tras finalizar el tratamiento con tamoxifeno para evitar su teratogenicidad.
Es obligatoria una re-estadificación exhaustiva previa a gestación mediante exploración clínica, estudio por imagen completo de la mama (la resonancia magnética previa a la gestación es optativa) y estudio de extensión.
El control de la mama durante el embarazo en estas mujeres debe realizarse mediante exploración física con periodicidad a criterio de la unidad de referencia. No está indicada la mamografía de control rutinario.
El control obstétrico del embarazo debe realizarse en una unidad de alto riego obstétrico.
Cáncer de mama durante el embarazoSe considera CM durante la gestación aquel cáncer diagnosticado en una mujer gestante o tras el primer año después del parto.
Su aparición implica problemas en cuanto al diagnóstico y el tratamiento que hace de esta patología un caso particular. Además, hay una implicación de los facultativos en el correcto desarrollo y finalización de la gestación.
Diagnóstico de cáncer de mama en la paciente gestanteEn la consulta obstétrica, antes de iniciar la gestación es necesario clasificar a las mujeres en función de los factores de riesgo de CM. Esta clasificación por categoría de riesgo permitirá establecer las recomendaciones adecuadas en cada caso.
En la Conferencia Internacional de Consenso sobre riesgo de CM publicada en la revista Cancer en 2008, se establecieron 4 categorías de riesgo:
- 1.
Riesgo que afecta a la población general.
- 2.
Riesgo moderado, que incluye a las mujeres con riesgo relativo (RR)<5.
- 3.
Riesgo alto, mujeres con RR<10: carcinoma lobulillar in situ, hiperplasia ductal o lobulillar atípica y 2 antecedentes de CM pero sin mutación de los genes BRCA1-2.
- 4.
Muy alto riesgo, mujeres con mutación conocida de los genes BRCA1-2 o con antecedente de radioterapia en mama o pared torácica antes de los 30 años.
Las mujeres de alto y muy alto riesgo se deben realizar, antes del embarazo, exploración clínica, mamografía y ecografía. En el resto de mujeres (riesgo moderado y riesgo que afecta a la población general) se recomienda el mismo protocolo a partir de los 40 años.
Es recomendable una exploración clínica de las mamas en cada trimestre a todas las gestantes.
La metodología diagnóstica de CM en caso de nódulo seguirá las siguientes pautas:
- 1.
Ecografía en lesión palpable en cualquier trimestre y punción con aguja gruesa.
- 2.
En caso de sospecha, mamografía (recomendable digital) con protección abdominal.
- 3.
Biopsia diagnóstica con aguja gruesa.
- 4.
La resonancia magnética no es recomendable, porque el gadolinio se encuentra en el grupo C de medicamentos de la FDA. Además, la posición prona puede no ser recomendable en algunas fases de la gestación.
Durante la lactancia se puede utilizar cualquier método diagnóstico.
En caso de diagnóstico de CM se puede realizar un estudio de extensión estándar:
- •
Radiografía de tórax con protección abdominal.
- •
Ecografía hepática.
- •
Analítica.
- •
Demorar la gammagrafía ósea y la TAC hasta finalizar la gestación.
En caso de sospecha clínica de metástasis pueden realizarse:
- •
Gammagrafía ósea, TAC y RM sin gadolinio pasado el primer trimestre.
- •
No se dispone de información suficiente respecto al PET en la mujer gestante con CM.
Durante la lactancia pueden realizarse todos los métodos de extensión citados: radiografía de tórax, ecografía, TAC, resonancia, gammagrafía. Si se utilizan contrastes o radiofármacos, debe suspenderse la lactancia en las 24-36h posteriores.
Tratamiento del cáncer de mama durante la gestaciónNo es necesario el aborto en ningún caso, porque no mejora los resultados. La paciente podrá optar por la interrupción voluntaria del embarazo si así lo decide tras recibir una información completa y dentro del periodo legal.
Tratamiento quirúrgicoEl planteamiento quirúrgico recomendado en función del trimestre de gestación seguirá las siguientes pautas
- •
Primero y segundo trimestres:
- -
Mastectomía en los casos que precise radioterapia (RT) inmediata.
- -
Se puede optar por cirugía conservadora en los casos en que esté indicada.
- -
- •
Tercer trimestre:
- -
Cualquier cirugía es válida.
- -
Biopsia selectiva del ganglio centinela (BSGC) en mujeres gestantes. La dosis de radiación expuesta al feto es inferior a la ambiental y no han sido reportados problemas; por lo tanto, se puede realizar advirtiendo a la paciente de la escasa información que tenemos al respecto. Los colorantes están contraindicados.
Tratamiento sistémicoEl tratamiento sistémico del CM durante la gestación debe seguir las siguientes recomendaciones:
- •
Debe ser manejado por unidades multidisciplinarias con experiencia y formadas por oncólogos, obstetras, radiólogos, cirujanos de mama, radioterapeutas y pediatras neonatólogos.
- •
Evitar el tratamiento las 3 semanas previas al parto por riesgo de sepsis y hemorragia.
- •
En el segundo y tercer trimestres se puede producir retraso de crecimiento uterino. Ninguna serie ha reportado un número mayor de muertes fetales.
- •
El tratamiento hormonal está contraindicado durante toda la gestación (Categoría 4 OMS).
- •
El tratamiento de quimioterapia está contraindicado durante el primer trimestre (Categoría 4 OMS).
- •
En el segundo y tercer trimestres se recomienda emplear los esquemas en los que hay amplia experiencia, siempre que sea posible.
- •
Hay amplia experiencia en el empleo seguro de esquemas que incluyen antraciclinas, ciclofosfamida y 5-fluorouracilo (Categoría 1 OMS).
- •
Hay menos experiencia para el empleo de taxanos, Navelbine y sales de platino.
- •
Está contraindicado el empleo de trastuzumab (Herceptin) (Categoría 4 OMS).
- •
Lapatinib no debe emplearse de forma rutinaria (Categoría 3 OMS). Por su mecanismo de acción (inhibición del dominio intracelular de la tirosín cinasa) puede tener efectos sobre el feto. Deberían individualizarse los casos y valorar el riesgo-beneficio.
- •
La radioterapia está contraindicada en toda la gestación (Categoría 4 OMS).
- •
Excepcionalmente, e incrementando las precauciones y la protección fetal, se puede valorar la RT mediante acelerador de electrones, en el segundo y tercer trimestres, para el tratamiento específico de metástasis (Categoría 3 OMS).
- •
El control fetal durante el tratamiento del CM debe ser idéntico que en el caso de embarazo de alto riesgo.
- •
Se recomienda control de flujos vasculares fetales el mismo día, tras cada ciclo de quimioterapia.
- •
No es recomendable administrar quimioterapia 2 a 3 semanas antes de la finalización del embarazo.
- •
El parto se llevará a cabo preferiblemente por vía vaginal cuando el feto sea maduro.
- •
En cáncer diagnosticado en el tercer trimestre (cuando se precise tratamiento adyuvante): se valorará la maduración fetal (cuando esté indicada) y la finalización del embarazo con el fin de iniciar los tratamientos lo más precozmente posible y evitar la exposición fetal.
- •
La finalización del embarazo dependerá de: la edad gestacional en el momento del diagnóstico, el tipo de tratamiento, el estadio del tumor y el estado de bienestar fetal.
En pacientes con antecedente de CM no hay contraindicación para la lactancia natural, aunque, con tratamiento conservador, puede haber mayor dificultad en la lactancia en la mama tratada. Asimismo, la lactancia puede dificultar el seguimiento locorregional.
En el CM durante la gestación se puede realizar la lactancia natural si el tratamiento ha sido una mastectomía y no precisa tratamiento neoadyuvante.
La lactancia está contraindicada si la paciente está en tratamiento con quimioterapia, hormonoterapia o precisa tratamiento con radioterapia (Categoría 4 OMS).
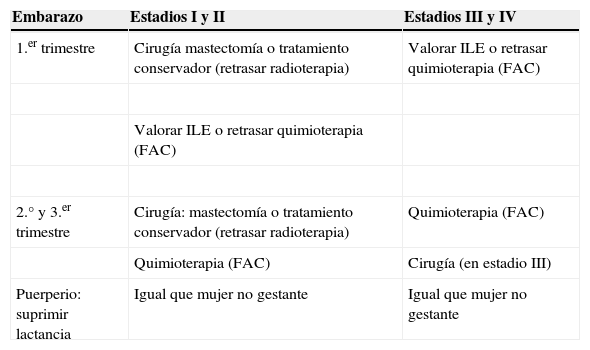
El tratamiento quirúrgico del CM durante la lactancia es el estándar en función de los parámetros habituales. Se recomienda suprimir la lactancia antes del tratamiento quirúrgico del CM (tabla 1).
Esquema de tratamiento del cáncer de mama durante la gestación
| Embarazo | Estadios I y II | Estadios III y IV |
|---|---|---|
| 1.er trimestre | Cirugía mastectomía o tratamiento conservador (retrasar radioterapia) | Valorar ILE o retrasar quimioterapia (FAC) |
| Valorar ILE o retrasar quimioterapia (FAC) | ||
| 2.° y 3.er trimestre | Cirugía: mastectomía o tratamiento conservador (retrasar radioterapia) | Quimioterapia (FAC) |
| Quimioterapia (FAC) | Cirugía (en estadio III) | |
| Puerperio: suprimir lactancia | Igual que mujer no gestante | Igual que mujer no gestante |
FAC: fluorouracilo, adriamicina y cicloforfamida; ILE: interrupción legal del embarazo.
Existe evidencia de que los tratamientos quimioterápicos que se administran para el tratamiento del CM tienen un impacto negativo en la fertilidad a consecuencia de un efecto directo sobre el ovario con una disminución de la reserva, presumiblemente a través de la muerte celular apoptósica. Los efectos adversos dependen del tipo de quimioterapia (mayores efectos secundarios con fármacos alquilantes), de la dosis y de la duración del tratamiento, y son tanto más evidentes cuanto mayor es la edad de la paciente.
El tratamiento con tamoxifeno solo tiene un riesgo bajo de fallo ovárico, y es dependiente de la edad: en mujeres <45años, el riesgo es el mismo que en las no tratadas. En mayores de 45años, el riesgo de fallo ovárico es un 10% mayor que en las no tratadas.
La eficacia de los diferentes métodos utilizados para preservar la fertilidad se ve comprometida por la edad de la paciente. Se ha planteado el uso de análogos de la hormona liberadora de gonadotrofina con la intención de proteger el ovario de este efecto tóxico de la quimioterapia, pero no hay evidencia para la utilización de los análogos de la LHRH a modo de protección ovárica. Posteriormente a la elaboración de este consenso ha sido publicado un estudio del grupo POEMS en el que parecen encontrar una evidente eficacia de los análogos de la LHRH en la conservación de la actividad ovárica tras los tratamientos con quimioterapia.
No es necesario mantener la función endometrial en previsión a la utilización de los métodos de preservación de la fertilidad.
En las pacientes oncológicas, puesto que no hay evidencia en cuanto a la asociación entre tratamientos de fertilidad y CM, se pueden plantear tratamientos combinados (criopreservación de gametos y embriones y criopreservación de tejido ovárico) con la intención de aumentar la probabilidad de fertilidad (Categoría 1 OMS).
Métodos de preservación de fertilidadActualmente EUSOMA recomienda informar a toda paciente joven con CM sobre la posibilidad de preservar su fertilidad antes de iniciar cualquier tratamiento sistémico
Criopreservación de embrionesEs el método más utilizado en tratamientos de fertilidad, y por lo tanto del que se dispone de más experiencia. Requiere pareja o donante.
El procedimiento requiere aproximadamente 2 semanas de estimulación ovárica, comenzando al principio del ciclo menstrual de la paciente. De este modo es muy importante que a estas pacientes se les informe adecuadamente y acudan a centros de reproducción asistida tan pronto como se diagnostica el cáncer.
Los protocolos de estimulación ovárica recomendados son aquellos que produzcan el menor incremento estrogénico, pero con la pretensión de obtener el mayor reclutamiento folicular posible.
Criopreservación de ovocitosEs en la actualidad el método más recomendado por la American Society of Clinical Oncology (ASCO).
La criopreservación de ovocitos es una alternativa a considerar en mujeres sin pareja y que no deseen usar esperma de donante y/o que no acepten la criopreservación de embriones.
El procedimiento requiere aproximadamente 2 semanas de estimulación ovárica, comenzando al principio del ciclo menstrual de la paciente. De este modo es muy importante que a estas pacientes se les informe adecuadamente y acudan a centros de reproducción asistida tan pronto como se diagnostica el cáncer.
Los protocolos de estimulación ovárica recomendados son aquellos que produzcan el menor incremento estrogénico. La evidencia actual indica que la técnica aconsejada es la vitrificación de ovocitos (Categoría 1 OMS). Actualmente la vitrificación ya no se considera una técnica experimental. Hay varios hijos nacidos vivos de mujeres con cáncer y que previamente vitrificaron sus ovocitos.
Criopreservación de tejido ováricoCuando las condiciones de la paciente (clínicas, logísticas o de otro tipo) no permitan la criopreservación de embriones u ovocitos, se puede plantear la criopreservación de tejido ovárico, teniendo en cuenta que actualmente sigue siendo una técnica experimental de investigación.
En las pacientes oncológicas, puesto que no hay evidencia en cuanto a la asociación entre tratamientos de fertilidad y CM, se pueden plantear tratamientos combinados (criopreservación de gametos y embriones y criopreservación de tejido ovárico) con la intención de aumentar la probabilidad de fertilidad.
Existen situaciones especiales, como el cáncer localmente avanzado o el cáncer inflamatorio, que requieren un inicio inmediato de la quimioterapia neoadyuvante que no permitirá una demora del mismo.
No es prudente demorar el inicio de la quimioterapia adyuvante más de 6 semanas; por tanto, se debe realizar en este periodo de tiempo.
Se extrae tejido ovárico, se incluye una porción del espécimen en parafina y se estudia microscópicamente para descartar patología. El resto se criopreserva y se trasplanta cuando se requiera.
Tratamientos inductores de la ovulación y cáncer de mamaTratamientos de fertilidad como riesgo de cáncer de mamaNo existen estudios prospectivos y aleatorizados que demuestren el aumento del CM con la utilización de los tratamientos de fertilidad. Algunos estudios introducen variables que modifican el riesgo potencial aumentándolo en pacientes con riesgo familiar o en nulíparas.
Solo serían evaluables los estudios que comparan población estéril que utiliza tratamientos de fertilidad con población estéril. La comparación con la población general sería comparar con una población distinta.
El nivel de recomendación debería ser B, explicando que los estudios epidemiológicos no ven aumentado el riesgo de CM con la utilización de tratamientos de fertilidad en pacientes estériles.
No existe evidencia clínica de aumento de riesgo de CM en mujeres sanas sometidas a tratamiento de fertilidad. No hay datos específicos para mujeres con alto riesgo de CM (riesgo familiar).
No hay evidencia de que ningún tratamiento de fertilidad aumente el riesgo de CM.
Es recomendable realizar una mamografía antes de la técnica de reproducción asistida, especialmente en mujeres mayores de 40 años.
Tratamientos de fertilidad en pacientes con cáncer de mamaExiste acuerdo en la literatura acerca de la ausencia de riesgo adicional de recidiva de CM en pacientes que reciben fármacos inductores de la ovulación, aunque sin suficiente evidencia.
Se autorizará el tratamiento inductor de la ovulación cuando se autorice el embarazo. Si se autoriza un embarazo, no se considera un factor de riesgo la vía por la que este se consigue, ya sea espontánea o bien inducida.
El protocolo más utilizado-recomendado será el mismo que el de las mujeres sin CM. No hay evidencia de que el número de ciclos de tratamiento se asocie a un mayor riesgo.
No existe evidencia clínica de que un control «intensivo» afecte a la supervivencia de estas pacientes. El seguimiento será el habitual en una paciente con CM.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- •
Emilio Alba (Hospital Universitario Virgen de la Victoria, Málaga)
- •
Marina Álvarez (Hospital Universitario Reina Sofía, Córdoba)
- •
Carmen Ara (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Pere N. Barri (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Montse Boada (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Justo Callejo (Hospital de Sant Joan de Déu, Barcelona)
- •
Octavi Córdoba (Hospital Vall d’Hebron, Barcelona)
- •
Ventura Coroleu (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Maite Cusidó (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Miguel Ángel Checa (Hospital del Mar, Barcelona)
- •
José Luis Doval (Complexo Hospitalario de Ourense, Ourense)
- •
Rafael Fábregas (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Jaume Fernandez (Hospital Quirón, Barcelona)
- •
Ramón Florensa (Corporación Sanitaria Parc Taulí, Sabadell, Barcelona)
- •
Juan A. Garcia Velasco (Instituto Valenciano de Fertilidad. Valencia)
- •
M. Julia Giménez (Instituto Valenciano de Oncología, Valencia)
- •
Maria Gonzalez Cao (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Alfonso Herruzo (Catedrático de Obstetricia y Ginecología, Facultad de Medicina de Bilbao)
- •
Edelmiro Iglesias (Hospital Arnau de Vilanova, Lérida)
- •
Maximo Izquierdo (Institut Universitari Quirón-Dexeus, Barcelona)
- •
José M. Lailla (Presidente de Sociedad Española de Ginecología y Obstetricia, SEGO)
- •
Salvador Luján (Hospital de Cruces, Bilbao)
- •
Ana Lluch (Hospital Clínico Universitario de Valencia, Valencia)
- •
Josep Mallafré (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Javier Marina (Grupo Oncológico Ginecológico Español, GOGE)
- •
Francísca Martínez (Institut Universitari Quirón-Dexeus, Barcelona)
- •
José M. Medina (Consulta privada, Valladolid)
- •
Salomón Menjón (Hospital Materno Infantil, Granada)
- •
Alfonso Modolell (Instituto de Oncología Corachán, Barcelona)
- •
Juan Montero (Hospital General Yagüe, Burgos)
- •
Carmen Moriyón (Hospital de Cabueñes, Gijón)
- •
Ángel de la Orden (C H Universitario de Vigo, Pontevedra)
- •
Antonio Pellicer (Hospital La Fe de Valencia, Valencia)
- •
Antonio Piñero (Hospital Virgen de la Arrixaca, Murcia)
- •
Miguel Prats Puig (Clínica del Pilar, Barcelona)
- •
Jose M. Román (Hospital Quirón San Camilo, Madrid)
- •
Amparo Ruiz (IVO, Valencia)
- •
Manuel Ruiz Borrego (Hospital Universitario Virgen del Rocío, Sevilla)
- •
Dolors Sabadell (Hospital del Mar, Barcelona)
- •
José Schneider (Hospital Universitário Marqués de Valdecilla, Santander)
- •
Melcior Sentis (Corporació Parc Taulí, Hospital Universitari, Sabadell, Barcelona)
- •
Bernat Serra (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Juan Torrecabota (Hospital Son Espases, Palma de Mallorca)
- •
Francesc Tresserra (Hospital Universitario Quirón Dexeus)
- •
Rafael Torrejón (Hospital Virgen del Rocío, Sevilla)
- •
Belén Ubeda (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Lisardo Ujidos (HM hospitales, Madrid)
- •
Ander Urruticoechea (H Okologikoa, San Sebastián)
- •
Carlos Vazquez (Presidente de la Sociedad Española de Senología y Patología Mamaria, SESPM)
- •
M. del Mar Vernet (Hospital del Mar, Barcelona)
- •
Santiago Viteri (Institut Universitari Quirón-Dexeus, Barcelona)
- •
Esther de la Viuda (Hospital Universitario de Guadalajara, Guadalajara)
- •
Jordi Xercavins (Hospital Vall d¿Hebron, Barcelona)
- •
Gabriel Zanón (Hospital Clínico de Barcelona, Barcelona)