Los pacientes con factores de riesgo preexistentes de enfermedad cerebrovascular tienen durante la cirugía coronaria un mayor riesgo de presentar un ictus postoperatorio. Entre los principales factores de riesgo a considerar esta la edad, las comorbilidades y la técnica quirúrgica, en especial la manipulación de la aorta. Este artículo revisa la información médico-quirúrgica actual de la lesión neurológica tipo ictus durante la CABG aislada.
Patients with preexisting risk factors for cerebrovascular disease have an increased risk of postoperative stroke during coronary surgery. Among the main risk factors to consider are age, comorbidities and surgical technique, especially manipulation of the aorta. This paper reviews current medical surgical information on stroke-type neurological injury during CABG alone.
La lesión neurológica durante la cirugía coronaria (CABG, coronary artery bypass graft) es una de las mayores complicaciones relacionadas con esta técnica quirúrgica. En las últimas décadas conocemos mejor los posibles mecanismos permitiendo una mayor prevención. Hoy en día tenemos recursos quirúrgicos con los que prevenir el ictus durante la CABG. Y es por ello que el grado de lesión neurológica post-CABG sea considerado en la actualidad un índice de calidad quirúrgico dentro de la excelencia de la práctica clínica1.
Clásicamente, la lesión neurológica en la CABG se ha dividido en 2 entidades nosológicas. La lesión focal neurológica tipo i o ictus (stroke), en sus 2 formas, accidente isquémico transitorio y el accidente vascular cerebral. Y la lesión neurológica tipo ii por encefalopatía no focal, tipo delirium, desorientación, agitación, confusión, temblores, estado estuporoso prolongado, coma, etc.
Este artículo revisa la información médico-quirúrgica actual de la lesión tipo i durante la CABG aislada, abordando aspectos como la etiología, el pronóstico, las técnicas de prevención, los modelos predictivos preoperatorios que identifiquen los pacientes de riesgo, las estrategias de prevención, etc.
Incidencia de la lesión neurológica en la cirugía coronaria aisladaLa incidencia del ictus durante la CABG aislada es variable en los diversos estudios, entre el 1,5% y el 5,2%2,3. En el registro americano database-Society Thoracic Surgery en el periodo 2002-2006, con 774.881 pacientes con CABG aislada realizada con circulación extracorpórea (CEC), la incidencia de ictus fue del 1,4%, desglosada por edad del 0,5% en menores de 55 años y del 2,3% en los mayores de 75 años4. En un estudio retrospectivo multicéntrico español, con 26.347 pacientes con CABG aislada, de los cuales el 40,3% se realizó sin CEC, la incidencia fue del 1,38% en menores de 55 años y el 1,6% en mayores de 75 años5.
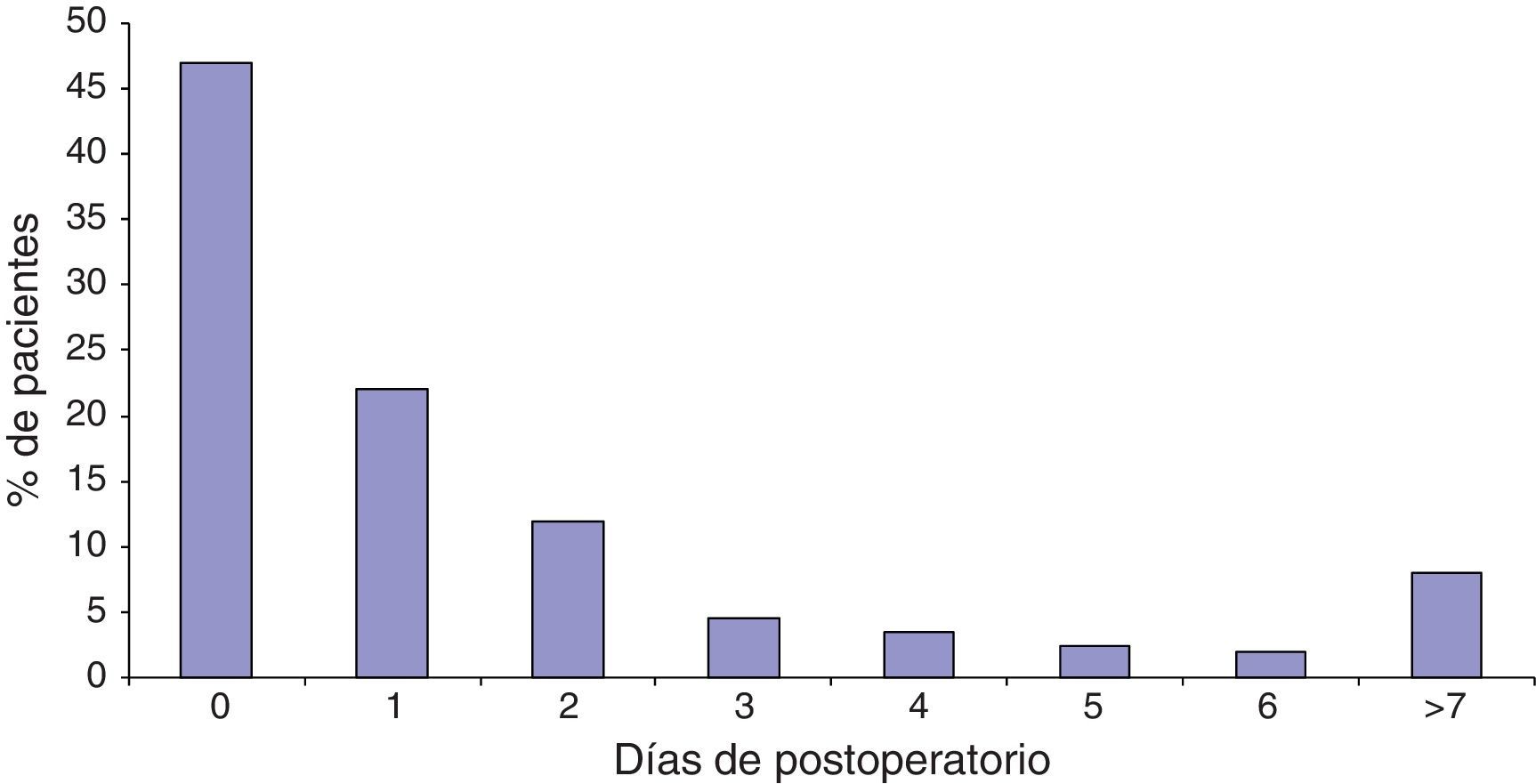
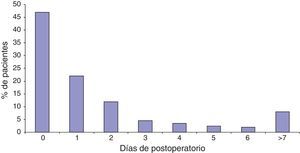
El 80% de los ictus son detectados en los primeros 2 días del postoperatorio, con una mayor incidencia tras el despertar anestésico del paciente, lo cual da a pensar en la importancia de las maniobras intraoperatorias como mecanismos desencadenantes. Likosky et al.6 describen que el 42% de los ictus son identificados en el 1.er día de postoperatorio y un 20% durante el 2.° día (fig. 1). Ictus diagnosticados después de los 7 días del postoperatorio es más probable que sucedan por otros mecanismos por ejemplo la fibrilación auricular, mala anticoagulación, etc., todos ellos difícil de precisar.
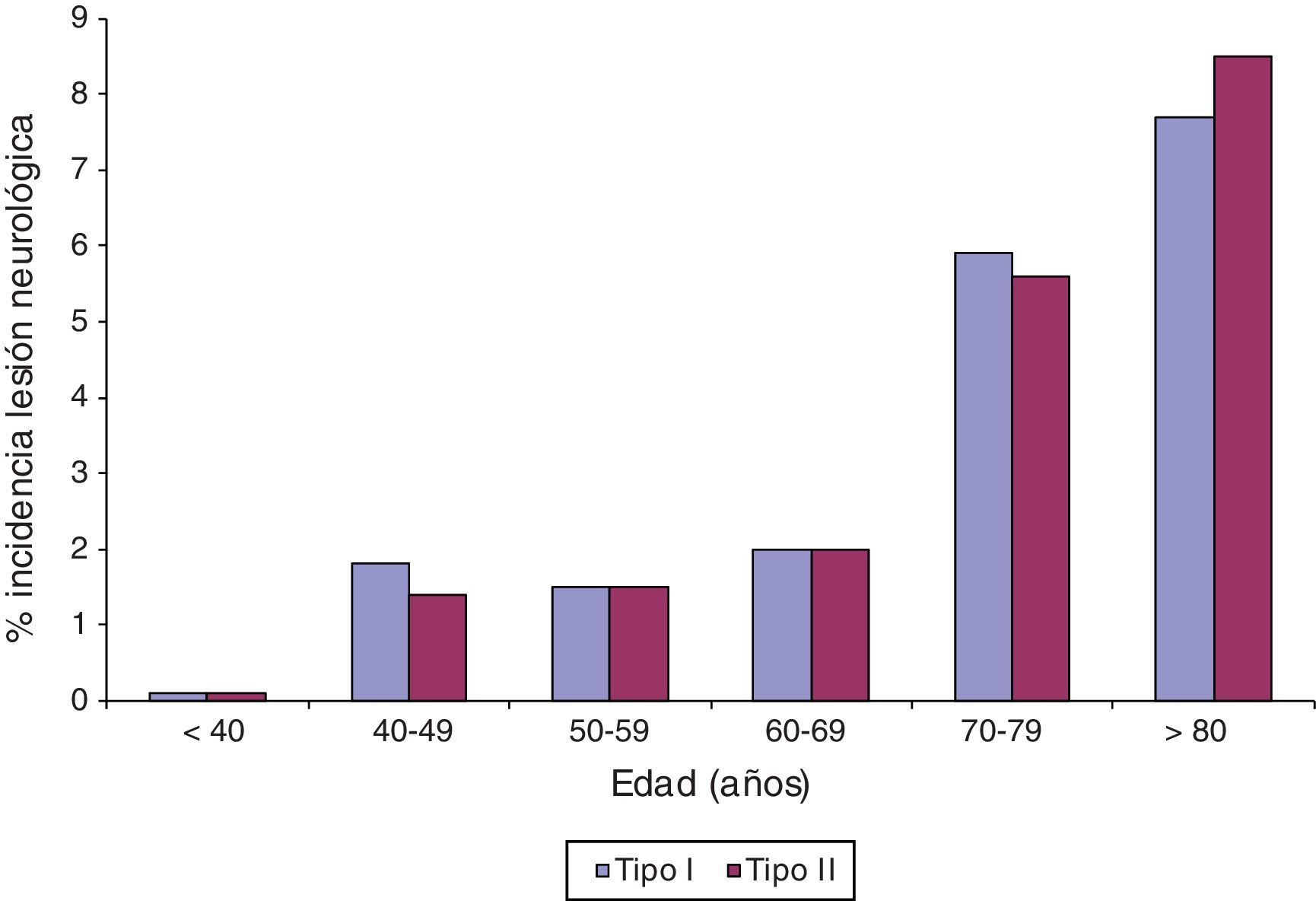
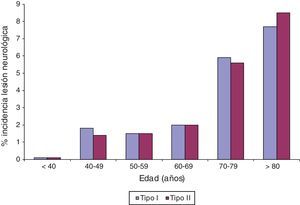
En la CABG asociada con cirugía valvular la incidencia de ictus es mayor, entre el 2 y el 6%. La incidencia de lesión tipo ii o delirio postoperatorio durante la CABG aislada es del 10%, similar a la reportada después de otras cirugías mayores no cardiacas. Los factores de riesgo para el delirio postoperatorio son similares para la cirugía cardiaca y la no cardiaca, e incluye la edad avanzada, la enfermedad vascular periférica y el deterioro neurológico previo (fig. 2).
Pronóstico vital tras lesión neurológica poscirugía coronariaLos pacientes con ictus postoperatorio tienen una mayor mortalidad, ponderada en 5 a 6 veces superior al del paciente sin complicación neurológica (22,2% vs. 3,75%; p < 0,001)7,8. En los pacientes con ictus postoperatorio la estancia media hospitalaria se triplica (25 días versus 9 días; p<0,001), la estancia en la unidad de cuidados intensivos es mayor (7,3 días vs. 3 días; p<0,001) y el coste económico del procedimiento el doble (60.750 vs. 30.705 dólares; p<0,001). Pero el problema no concluye tras la estancia hospitalaria, pues la comorbilidad que implica el ictus sigue impactando a largo plazo. El estudio del Northern New England Cardiovascular Disease Study Group9 comparó la supervivencia entre los pacientes con vs. sin ictus postoperatorio y observan diferencias al 1.er año del 83% vs. 94,1%, que fueron acentuándose con el paso de los años, a los 5 años 58,7% vs. 83,3% y a los 10 años del 26,9% vs. 61,9%, respectivamente. Es decir, a largo plazo el ictus postoperatorio sigue mermando la supervivencia dentro de un contexto de gran pérdida en calidad de vida.
Así pues, si analizamos la mortalidad global final a largo plazo tras el ictus, esta es muy superior, 6 a 10 veces mayor, en comparación con la de los pacientes sin ictus postoperatorio. En otras palabras, superior incluso a la de aquellos pacientes con enfermedad coronaria en los que no se practica su revascularización y tan solo se les ofrece tratamiento médico9.
Modelos predictivos preoperatorios de ictus en cirugía coronariaEl riesgo de ictus en la CABG aislada no es homogéneo, aunque se han identificado diferentes características clínicas y ecocardiográficas para ayudar a estratificarlo. La edad, por ejemplo, es un factor independiente relacionado con el riesgo de ictus y a mayor edad, mayor riesgo (fig. 2). Basado en los factores clínicos varios modelos predictivos permiten identificar preoperatoriamente a los pacientes de mayor riesgo para un ictus perioperatorio. Sin embargo, ninguno ha sido ampliamente aplicado en la práctica clínica de rutina. Destacaría 3 escalas de riesgo preoperatorio de ictus: el Northern New England Cardiovascular Disease Study Group (NNECDSG)10; el norteamericano del Multicenter Study of Perioperative Ischemia (McSPI) Research Group11 y el nuestro, del multicéntrico español PACK212.
El NNECDSG score10 es un algoritmo de riesgo de ictus específico, basado en 33.062 pacientes consecutivos sometidos a cirugía de CABG aislado con CEC y pinzamiento lateral de aorta, con precisión predictiva área bajo la curva de 0,70 (intervalo de confianza [IC] del 95%, 0,67-0,72). El índice de riesgo de ictus McSPI11, de datos de 2.017 pacientes de 24 centros de Estados Unidos, algunos sin pinzamiento lateral de aorta, con predicción 0,77 (IC del 95%, 0,73-0,81). Y el estudio multicéntrico español PACK212, de 26.347 pacientes con capacidad de predicción del 0,76 (IC del 95%, 0,72-0,80), con un 40% de casos realizados sin CEC.
Todos los modelos emplean similares variables o factores de riesgo predictivos del ictus postoperatorio, en gran parte factores que reflejan el estado arteriosclerótico del paciente. Destacan la edad, el sexo femenino, la diabetes mellitus, la enfermedad vascular sistémica (historia previa de ictus, TIA, cirugía carotídea, estenosis carotídea o soplo, la enfermedad de las extremidades inferiores tipo claudicación, amputación, cirugía vascular periférica por arteriosclerosis, ausencia pulsos de pedal o úlceras de extremidades inferiores), la insuficiencia renal (diálisis, creatinina sérica preoperatoria>2mg/dl, tasa de filtración glomerular < 30ml/min/1,73 m2), la fracción de eyección del ventrículo izquierdo preoperatoria menor del 40%, los antecedentes de enfermedad pulmonar crónica y la prioridad urgente y emergente de la CABG.
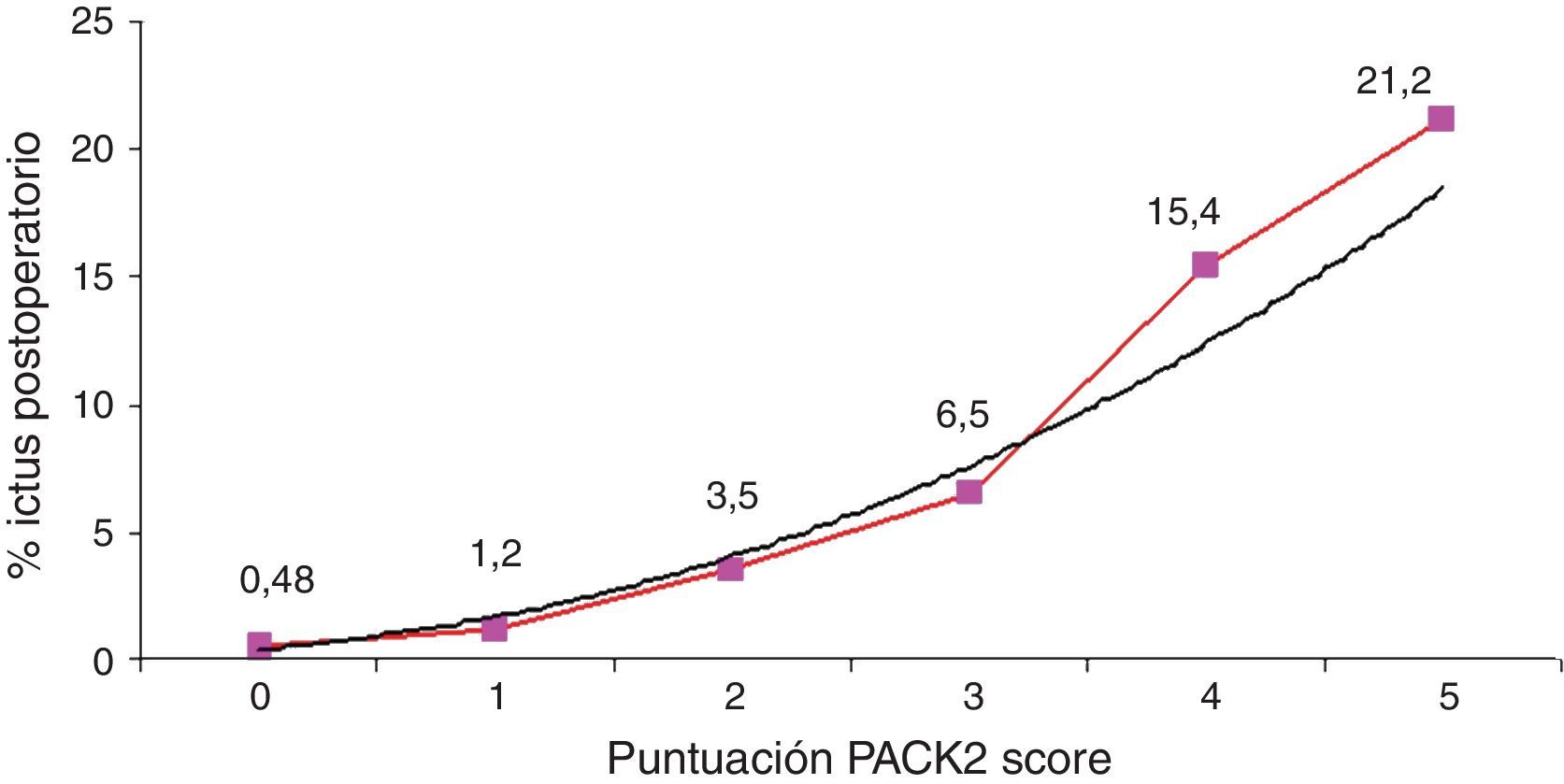
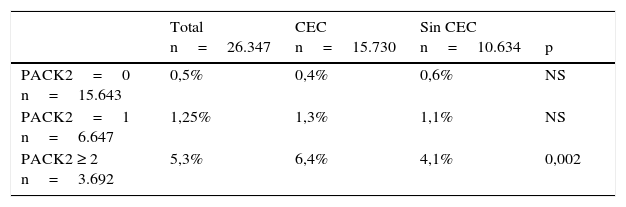
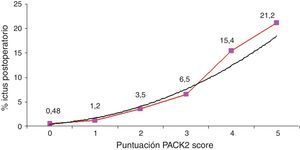
El estudio multicéntrico español12, en un intento de síntesis, concluyó que 4 son las variables más importantes para detectar riesgo preoperatorio elevado, reflejadas con el acrónimo PACK, Priority of the surgery (urgente y emergente), Arteriophaty vascular disease, Congestive heart failure y/o fracción eyección<40% y Kidney disease (diálisis, creatinina sérica preoperatoria>2mg/dl, tasa de filtración glomerular < 30ml/min/1,73 m2). Se estableció 1 punto por cada ítem, excepto para la insuficiencia renal crónica, con 2 puntos (rango score PACK2 entre 0 y 5 puntos). El riesgo de ictus postoperatorio en la CABG aislada es proporcional a la puntuación que ofrece el escore PACK2. Como puede apreciarse en la figura 3, un score 5 tiene un altísimo riesgo de ictus si no se plantea una estrategia terapéutica adecuada. Se debe destacar en este estudio el análisis que se realizó del efecto de la CEC en el ictus y concluyó que solo en el grupo de pacientes con puntuación PACK2 ≥ 2 puntos, la sin CEC logra disminuir significativamente la incidencia de ictus perioperatorio respecto a la CEC (tabla 1).
Porcentaje de ictus postoperatorio en la CABG aislada registrado en el estudio multicéntrico español PACK2, atendiendo a la puntuación del score y al uso de la circulación de extracorpórea
| Total n=26.347 | CEC n=15.730 | Sin CEC n=10.634 | p | |
|---|---|---|---|---|
| PACK2=0 n=15.643 | 0,5% | 0,4% | 0,6% | NS |
| PACK2=1 n=6.647 | 1,25% | 1,3% | 1,1% | NS |
| PACK2 ≥ 2 n=3.692 | 5,3% | 6,4% | 4,1% | 0,002 |
CEC: circulación extracorpórea.
El mecanismo neuropatológico de la enfermedad cerebrovascular postoperatoria es complejo e incluye principalmente lesiones isquémicas cerebrales, con múltiples infartos, afectación microvascular en especial en diabéticos mellitus, leucoaraiosis y otras formas infrecuentes como esclerosis del hipocampo. El paciente de CABG tiene enfermedad aterosclerótica en diferentes grados de severidad y extensión. La evidencia actual, con las técnicas de imagen disponibles, es que la prevalencia de la enfermedad cerebrovascular preoperatoria es mayor de la que siempre hemos considerado. En un estudio a 421 candidatos a CABG con resonancia magnética preoperatoria se encontró que el 50% mostró evidencia de anomalías cerebrales isquémicas antes de la cirugía, un 30% tenía pequeños infartos cerebrales y un 20% infartos múltiples13; y este grado de enfermedad cerebrovascular se correlacionó muy bien con nuevos eventos cerebrovasculares y en los cambios cognitivos del postoperatorio.
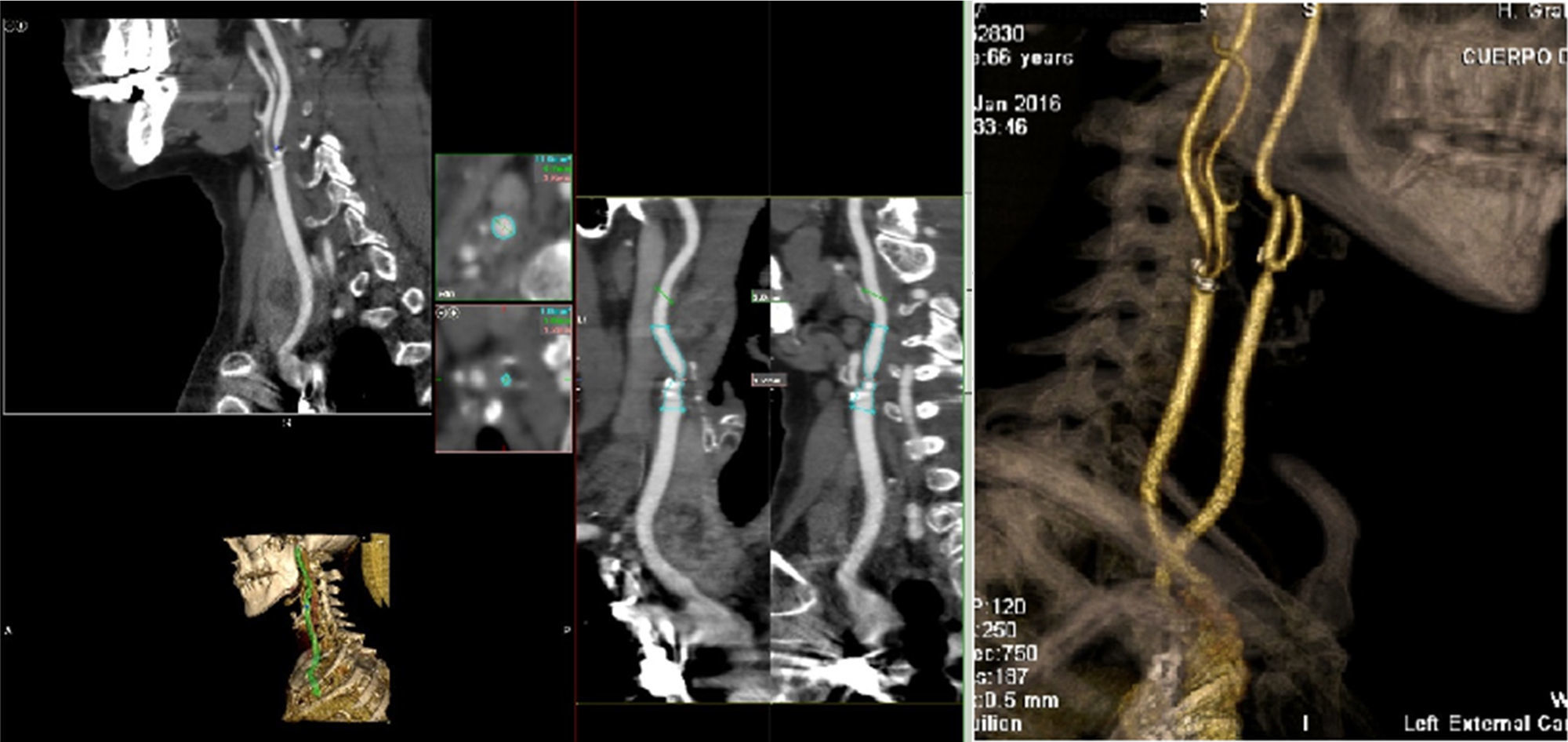
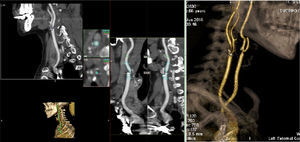
Muchos factores de riesgo coexisten en los pacientes de CABG y por ello la etiología del ictus es a menudo multifactorial. Probablemente, la afectación ateromatosa de la aorta ascendente, en sus diversas expresiones anatomopatológicas, como son las placas blandas y las de calcio, es el principal foco de embolización aterotrombótica en la CABG, de aquí la importancia de las técnicas quirúrgicas de «no-touch» de la aorta14. Estudios con Doppler transcraneal han mostrado que la siembra embólica sucede principalmente durante las maniobras de canulación y pinzamiento/despinzamiento de la aorta15. Otras etiologías del ictus a destacar son la enfermedad ateromatosa carotídea (fig. 4), las microembolias de aire o debris asociados a la CEC, los episodios transitorios de hipotensión e hipoperfusión, la fibrilación auricular, el estado de hipercoagulabilidad, los agentes anestésicos, etc.
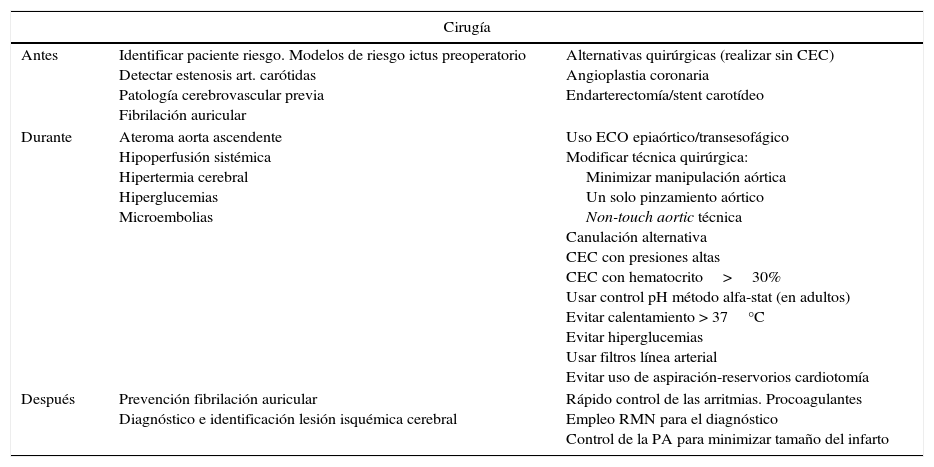
Las diversas estrategias para proteger el cerebro durante la CABG deben de considerarse en 2 etapas: 1) evitar lesiones al cerebro, y 2) prevenir el daño isquémico secundario/promover la recuperación. La tabla 2 resume estas estrategias y sugiere formas de manejarlas8.
Estrategias neuroprotectoras en la cirugía coronaria
| Cirugía | ||
|---|---|---|
| Antes | Identificar paciente riesgo. Modelos de riesgo ictus preoperatorio Detectar estenosis art. carótidas Patología cerebrovascular previa Fibrilación auricular | Alternativas quirúrgicas (realizar sin CEC) Angioplastia coronaria Endarterectomía/stent carotídeo |
| Durante | Ateroma aorta ascendente Hipoperfusión sistémica Hipertermia cerebral Hiperglucemias Microembolias | Uso ECO epiaórtico/transesofágico Modificar técnica quirúrgica: Minimizar manipulación aórtica Un solo pinzamiento aórtico Non-touch aortic técnica Canulación alternativa CEC con presiones altas CEC con hematocrito>30% Usar control pH método alfa-stat (en adultos) Evitar calentamiento > 37°C Evitar hiperglucemias Usar filtros línea arterial Evitar uso de aspiración-reservorios cardiotomía |
| Después | Prevención fibrilación auricular Diagnóstico e identificación lesión isquémica cerebral | Rápido control de las arritmias. Procoagulantes Empleo RMN para el diagnóstico Control de la PA para minimizar tamaño del infarto |
CEC: circulación de extracorpórea; ECO: ecografía; PA: presión arterial; RMN resonancia magnética.
Tomada de McKhann et al.8.
A continuación, son tratados con mayor profundidad los de mayor interés para el cirujano.
Screening carotídeo preoperatorio. RecomendacionesEn la actualidad, está cuestionado el screening carotídeo preoperatorio generalizado de todos los pacientes de CABG, por diversas razones, entre ellas destacan: que un 50% de los ictus post-CABG suceden en pacientes sin lesiones carotídeas significativas y por qué aún en los casos documentados de lesión carotídea preoperatoria significativa (una reducción del 50 o el 70%, según hombre o mujer respectivamente, en el diámetro interno de la arteria carótida interna) existen dudas sobre cuál es la mejor estrategia perioperatoria.
Las guías clínicas al respecto consideran realizar screening solo en pacientes con factores de riesgo predictores de lesión carotídea significativa y se han identificado como factores para este riesgo: edad>70 años, el tabaquismo, la diabetes mellitus, hipertensión arterial, evento cerebrovascular previo, enfermedad arterial periférica, enfermedad coronaria del tronco común y antecedentes de enfermedad carótida (soplo, cirugía). La probabilidad de detectar una enfermedad carotídea significativa aumenta casi 3 veces por cada criterio adicional presente.
En las últimas guías clínicas del 2014 de la ESC/EACTS para la CABG es recomendación de screening carotídeo en16:
- –
Pacientes con antecedentes de ictus (TIA, accidente cerebrovascular) o presencia de soplo carotideo. Clase I/nivel evidencia C.
- –
Pacientes con enfermedad coronaria multivaso, enfermedad vascular periférica, o edad>70 años. Clase IIa/nivel evidencia C.
Otra cuestión no aclarada es si realizar y cuándo la revascularización carotídea (endarterectomía, implantación stent) en los casos de lesiones significativas, simultáneamente o de forma escalonada y secuencial, como estrategia para reducir el riesgo de ictus postoperatorio en pacientes con CABG.
En los pacientes de CABG con estenosis carotídeas unilaterales>del 50% en los que no se realiza de forma concomitante, la endarterectomía carotídea la tasa de ictus durante el postoperatorio de la CABG es del 3%, aumentando al 5% en aquellos con estenosis carotídea bilateral y al 11% en aquellos con una arteria carótida ocluida. En pacientes sometidos a endarterectomía carotídea (aislada no asociada a CABG) la tasa de ictus para este procedimiento es del 2,5% en aquellos con estenosis carotidea asintomática y del 5% en aquellos con síntomas cerebrovasculares previos. A la luz de estos datos, es difícil la cuestión de la revascularización carotídea y coronaria combinada (realizada simultáneamente o de forma escalonada y secuencial) como una estrategia para reducir el riesgo de ictus postoperatorio en pacientes con CABG.
Las guías recomiendan abordar esta indicación terapéutica como una decisión conjunta por un equipo multidisciplinar entre cirujano cardiaco, cirujano vascular, cardiólogo y neurólogo (recomendación clase i/nivel evidencia C)16, y realizar la endarterectomía carotídea tan solo por cirujanos experimentados con índices de ictus<3% pacientes asintomáticos o<6% en sintomáticos (recomendación clase i/nivel evidencia A). E indica la endarterectomía carotídea en los casos siguientes:
- –
En el paciente con TIA o ictus previo reciente (< 6 meses):
- ∘
Estenosis significativa de la arteria carótida (70-99%): es razonable considerar la revascularización carotídea conjunta con la CABG. En tal individuo, la secuencia y la sincronización (simultánea o en etapas) de la intervención carotídea y la CABG deben determinarse por la severidad relativa del paciente de disfunción cerebral y miocárdica. Clase I/nivel evidencia C.
- ∘
Estenosis significativa de la arteria carótida (50-69%): es razonable considerar la revascularización carotídea conjunta con la CABG dependiendo factores clínicos asociados. Clase IIb/nivel evidencia C.
- ∘
- –
En el paciente con TIA o ictus previo no reciente (> 6 meses):
- ∘
En hombres, estenosis carotídea bilateral del 70-90%, o estenosis 70%-90% con oclusión contralateral. Clase IIb/nivel evidencia C.
- ∘
En hombres, estenosis carotídea del 70-90% e ipsolateral, infarto cerebral previo silente. Clase IIb/nivel evidencia C.
- ∘
No obstante, sigue habiendo gran controversia. En mujeres con enfermedad carotídea asintomática, o en pacientes con expectativa de vida<5 años el beneficio de la revascularización carotídea (endarterectomía o stent) es controvertida y está aún por dilucidar17.
Valoración de la aorta ascendente mediante eco-epiaórticoLos cirujanos tradicionalmente evaluamos la aorta antes de la canulación y el pinzamiento mediante palpación. Esto es cuestionable ya que detecta tan solo placas calcificadas (duras) accesible al dedo, principalmente en la cara anterior y derecha de la aorta. Lo que no se palpa con precisión son las placas blandas (no calcificadas), que sin embargo son más fáciles de romper y provocar así la embolización de su contenido. Diversos estudios han mostrado la poca sensibilidad de esta maniobra como técnica para la prevención del ictus perioperatorio14,18. Lamentablemente, por la interposición de la vía aérea, la ecocardiografía transesofágica (ECO-ETE) no es capaz de visualizar la aorta ascendente distal y el arco aórtico proximal, puntos habituales para la canulación y el pinzamiento aórtico; sin embargo, para el resto de las áreas visualizadas tiene una alta capacidad de evaluación. Es decir, la ECO-ETE tiene una alta especificidad del 99% (IC del 95%, 96-99%), pues detecta bien cuando las visualiza, pero una baja sensibilidad del 21% (IC del 95%, 12-32%) por no visualizar toda la aorta al completo19. Por lo tanto, la evaluación completa de todas las partes de la aorta torácica requiere una combinación de ECO-ETE y epiaórtico de superficie.
Pocos estudios han ponderado el impacto del uso del eco-epiaórtico en el ictus, pero parecen demostrar que cuando la estrategia quirúrgica es reconducida según las imágenes del eco-epiaórtico la incidencia de ictus se reduce y es menor, entre el 0 y el 1,4%. En estos estudios se ha podido observar que en un 20% de los pacientes podemos encontrar placas moderadas (placas planas homogéneas de ateroma>4mm grosor) y en un 5% placas severas (placas heterogéneas>4mm grosos y/o con ateroma móvil al flujo), aunque esta incidencia es variable según la severidad arteriosclerótica del subgrupo de paciente analizado20. Por ello, las guías recomiendan el eco-epiaórtico para evaluar la presencia, la localización y la severidad de placas en la aorta ascendente, y reducir la incidencia de complicaciones ateroembólicas (clase iia; nivel evidencia C).
Cirugía coronaria sin circulación extracorpórea (off-pump)La introducción de la técnica sin CEC nos hizo pensar que las complicaciones neurologías podrían finalmente desaparecer en la CABG. Por desgracia, no ha sido así en diversos estudios comparativos prospectivos aleatorizados21-24, documentando similar incidencia de ictus postoperatorios con ambas técnicas. Ello sugiere que existen otros mecanismos, además de la CEC, implicados en la etiología de la lesión neurológica, entre ellas la manipulación de la aorta realizada en la mayoría de las sin CEC, y otros mecanismos que, en ocasiones, se acentúan, como la hipotensión, la distermia corporal, la fibrilación auricular, etc. Es interesante destacar que el ictus en la sin CEC suele suceder predominantemente al 4.° día y en la CABG con CEC lo es al 2.° día del postoperatorio, lo que sugiere mecanismos diferentes para el ictus.
No obstante, que en estos estudios la técnica sin CEC no muestre un mayor efecto neuroprotector puede ser por varias razones, entre las que destacaría: en su mayoría se realizó con técnicas en que se manipuló la aorta (pinzamientos-despinzamientos) y, en segundo lugar, existe una mezcla de datos que no diferencia el impacto de la sin CEC en los grupos de pacientes con mayor riesgo de ictus. A este respecto, algunos estudios han mostrado menor incidencia de ictus, aunque sin desaparecer por completo, con la sin CEC en poblaciones de riesgo como, por ejemplo, insuficiencia renal, ancianos25, etc. El estudio PACK2 encuentra diferencias significativas en los pacientes con severa arteriosclerosis (PACK2 ≥ 2), presentando la técnica sin CEC un significativo menor riego de ictus postoperatorio5. De este estudio PACK2 se concluye, además, que en paciente con bajo perfil de riesgo para ictus postoperatorio la con CEC puede realizarse con la misma seguridad que la sin CEC, y que aún sin CEC en el subgrupo de pacientes de mayor riesgo (PACK2 ≥ 2) persiste un elevado porcentaje de ictus postoperatorio, probablemente porque en este estudio esta incluidos mayoritariamente pacientes sin CEC en los que se manipuló la aorta. Por el contrario, Bucerius et al., en 16.184 pacientes, describen una diferencia no significativa entre el 3,9 y el 2,5% con CEC vs. sin CEC7. Y Biancari et al. comparan 445 con CEC vs. 557 sin CEC estratificándolos por la escala NNECDSG en subgrupos de riesgo y encontró un mínimo efecto neuroprotector no significativo de la sin CEC en todos y cada uno de los subgrupos26.
Fibrilación auricularLa fibrilación auricular está asociada a un mayor riego tromboembólico, algo que sucede hasta un 30% de los pacientes durante el postoperatorio de la CABG, principalmente en torno al 4.° día del postoperatorio. Es importante determinar cronológicamente el momento del ictus para determinar qué papel desempeñan las arritmias. En un estudio retrospectivo, Lahtinen et al. atribuyen a la fibrilación auricular el 36% de los ictus postoperatorios de la CABG, al detectar una media de 2,5 episodios arrítmicos previos al evento ictus27.
Técnica «non touch» aortaLas maniobras de manipulación de la aorta durante la CABG incrementan el riesgo de ictus14. Kapetanakis et al. demostraron, en un análisis de 7.272 pacientes, que la manipulación de la aorta incrementa en 1,8 veces el riesgo de ictus postoperatorio28. Y parecidas conclusiones han publicado otros autores29-31. Moss et al.32, en un interesante estudio comparativo entre las diversas estrategias quirúrgicas de manipulación de la aorta, muestran comparativamente el impacto de cada una de ellas para el ictus postoperatorio; y así tiene 1,73 veces más riesgo (odds ratio) los sistemas automáticos para las anastomosis proximales vs. «non touch» de aorta; una odds ratio 2,52 pinzamiento vs. «non touch»; odds ratio 1,41 pinzamiento vs. sistemas automáticos-anastomosis proximales, y odds ratio 1,68 con CEC vs. sin CEC. Por lo tanto, y en especial en pacientes con enfermedad de la aorta ascendente, modificar la técnica quirúrgica en aras de «no tocar la aorta» disminuye el riesgo de ictus.
Existen diversas estrategias quirúrgicas orientadas a la prevención del ictus en la CABG:
- -
Técnicas de mínima manipulación de aorta: empleo de un único pinzamientos, evitar los pinzamientos laterales (de mayor riesgo); el uso de filtro intraaórticos; canulación en cayado distal (3.er tronco supraaórtico); sistemas automáticos para las anastomosis proximales de los bypasses.
- -
Técnicas de «non touch» de la aorta: empleo de las arterias mamarias internas (dobles mamarias), anastomosis secuenciales, anastomosis proximales desde la arteria mamaria o la arteria subclavia; canulación no central fuera de la aorta ascendente para realizar las anastomosis coronarias en CEC a corazón latiendo.
Desde un punto de vista neurológico, la CABG, tal como se practica actualmente, es un procedimiento seguro y eficaz para la gran mayoría de los pacientes. No obstante, un grupo de pacientes con factores de riesgo preexistentes de enfermedad cerebrovascular tiene un mayor riesgo de presentar un ictus postoperatorio. Entre los principales factores a considerar están la edad, las comorbilidades y la técnica quirúrgica, en especial la manipulación de la aorta. Antes de la cirugía, conocemos muy poco acerca del estado no solo de la vasculatura del cerebro, sino también de la existencia de una enfermedad cerebrovascular subyacente previa. Los modelos de riesgo preoperatorio de ictus y el empleo del eco-epiaórtico son herramientas útiles en la elección de la mejor estrategia quirúrgica. Un parámetro actual de calidad en la CABG es tener una incidencia postoperatoria de ictus<1,5%.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.