La estenosis aórtica es la valvulopatía más frecuente en nuestro medio. El envejecimiento de la población y la mayor esperanza de vida la convierten en un problema de salud pública relevante. Aunque los criterios diagnósticos de severidad están claramente establecidos, en ocasiones, la cuantificación de la estenosis no es tan sencilla, existiendo diferentes escenarios clínicos y ecocardiográficos llenos de matices en los que otras técnicas diagnósticas de imagen pueden desempeñar un papel fundamental. En este manuscrito de revisión se evalúan estos escenarios y, de acuerdo con trabajos previos, se propone un algoritmo diagnóstico que facilite la toma de decisiones.
Aortic stenosis is the most common valvulopathy in develop countries. The progressive aging of the population and its increased life expectancy make it a relevant public health problem. Although the diagnostic criteria for severity are clearly established by the Scientific Guidelines, sometimes the quantification of stenosis is not so easy. There are different clinical and echocardiographic scenarios in which other diagnostic imaging techniques can play a fundamental role. In this review manuscript, these scenarios are evaluated and, according to previous works, a diagnostic algorithm is proposed in order to facilitate the decision making process.
Caso clínico
Mujer de 74 años que es remitida a Cirugía Cardíaca por estenosis aórtica (EAo) severa sintomática para recambio valvular aórtico (RVAo). La paciente refiere disnea de esfuerzo con grado funcional ii/iv NYHA. Presenta obesidad (índice de masa corporal 34kg/m2) e hipertensión arterial (HTA) como factores de riesgo cardiovascular; la exploración objetiva una presión arterial de 160/95mmHg y un soplo sistólico eyectivo iii/vi con segundo ruido disminuido pero audible como hallazgos relevantes. El electrocardiograma está en ritmo sinusal y la ecocardiografía es informada como un ventrículo izquierdo (VI) hipertrófico, de tamaño normal, y una fracción de eyección (FE) 63%, diástole con mala relajación, insuficiencia mitral leve degenerativa y una válvula aórtica calcificada con área (AVA) de 0,9 cm2 (calculada por ecuación de continuidad), velocidad máxima 3,4m/s y gradiente medio 30mm Hg. ¿Es esto una EAo verdadera? ¿La paciente se beneficiará de un RVAo?
Este perfil de pacientes con datos ecocardiográficos discordantes pueden aparecer en las consultas de cirugía cardiaca y las preguntas que surgen son: ¿es esto una verdadera EAo severa sintomática?, y ¿hay diagnósticos alternativos? En relación con esta última, el diagnóstico diferencial puede incluir: 1) disnea en relación obesidad; 2) disnea en relación con HTA no controlada; 3) enfermedad coronaria no diagnosticada, y 4) EAo severa como causa de los síntomas. En estos casos, el uso de técnicas diagnósticas alternativas como la ecocardiografía de esfuerzo puede ser de ayuda, ya que evalúan el comportamiento de la presión arterial y la función diastólica con esfuerzo, y descartan posible enfermedad coronaria subyacente. Para responder a la primera pregunta acerca de la estratificación de la EAo dedicamos este manuscrito de revisión.
Algunos conceptos básicosEl ecocardiograma transtorácico es la técnica estándar para la evaluación de la EAo, siendo la cuantificación precisa de su severidad fundamental para la toma decisiones. Permite evaluar tanto la valvulopatía aórtica como su repercusión sobre el VI, la presencia de otras valvulopatías concomitantes y, en ocasiones, el estudio de la raíz de la aorta y la aorta ascendente.
Dado que la severidad de la EAo se define por criterios ecocardiográficos, hacemos, a continuación, una descripción somera de algunos conceptos básicos1-4.
Gradientes transvalvularesUno de los parámetros más frecuentemente empleados para estimar la severidad de una EAo es el gradiente transvalvular, tanto máximo como medio, derivados de la ecuación de Bernoulli. Se considera que una EAo es severa cuando el gradiente medio es≥40 mmHg y/o la velocidad máxima es≥4m/s. Si bien se trata de un parámetro rutinario y de fácil adquisición, requiere una correcta alineación del Doppler con la dirección del flujo para detectar la mayor velocidad del mismo y evitar infraestimaciones. Por otro lado, su obtención presenta algunas debilidades, como en el caso de pacientes con mala ventana ecocardiográfica (ya sea por obesidad, patología respiratoria o ventilación mecánica, entre otras causa posibles). Se trata, además, de un parámetro dependiente de flujo, o lo que es lo mismo, del gasto cardiaco. De ahí que en, nuestra opinión, el volumen latido indexado tenga que ser también analizado y muy especialmente en las situaciones de datos discordantes. Finalmente, los gradientes pueden estar sobreestimados en situaciones como insuficiencia aórtica significativa, anemia, sepsis o fístulas arteriovenosas y, en general, en circunstancias que condicionan estados hiperdinámicos. Por último, no es infrecuente encontrar a pacientes en fibrilación auricular, situación que complica aún más la estimación real de la severidad por la variabilidad de los gradientes. En este caso, es práctica habitual establecer un valor promediado de los mismos.
Flujo: medida del gasto cardiacoParámetro más novedoso y no incorporado como información en la práctica rutinaria en muchos laboratorios de ecocardiografía y, sin embargo, muy útil para definir las situaciones de bajo gradiente con FE preservada. Se define bajo flujo como un volumen latido indexado por la superficie corporal<35ml/m2, aunque debe reconocerse que esta es una definición por consenso y que es dicotómica a la hora de decidir si el flujo es normal o reducido.
Fracción de eyecciónParámetro muy instaurado; nos informa de manera indirecta de la capacidad contráctil del VI. En situaciones de FE baja se considera «lógica» la presencia de flujo y gradientes bajos, no así si está preservada. Una FE<50% se considera reducida y es indicación de clase i de cirugía, independientemente de la presencia o no de síntomas. Por otro lado, la evaluación de alteraciones segmentarias de la contractilidad, así como la presencia de viabilidad, será fundamental en aquellos casos con enfermedad coronaria asociada, disfunción ventricular y EAo aórtica concomitante.
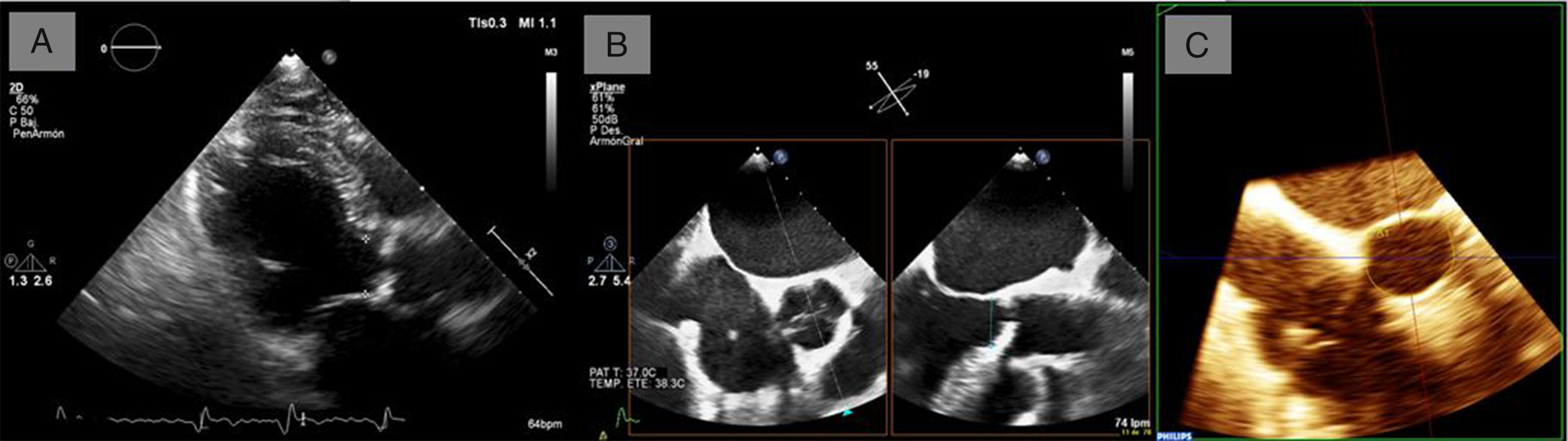
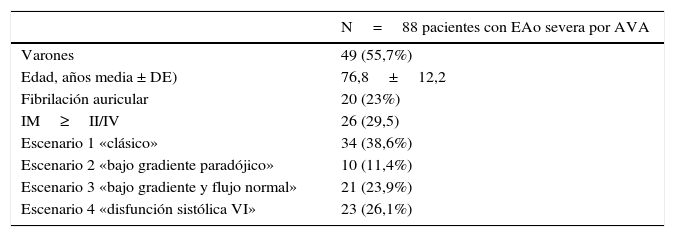
Área valvular aórtica calculada por ecuación de continuidad (Área valvular aórtica = (áreatracto salida de ventrículo izquierdo × integral velocidad tiempo tracto salida de ventrículo)/Integral velocidad tiempoválvula aórtica)El punto de corte de severidad establecido por las guías es menor de 1cm2 o bien indexada<0,6 cm2/m2. Se trata de un parámetro aparentemente sencillo de estimar pero potencialmente sujeto a errores. Por un lado, depende de una correcta estimación tanto de los gradientes como de la integral velocidad tiempo (ITV) del tracto de salida del VI (TSVI). Por otra parte, una de las principales fuentes de error en su cálculo es la medida del diámetro del TSVI, valor que para el cálculo del área está elevado al cuadrado, lo que incrementa el error de forma considerable (fig. 1). Otra opción para la estimación del AVA es la planimetría valvular directa, que puede ser muy difícil de realizar de forma fiable en un estudio transtorácico, siendo más útil el ecocardiograma transesofágico (ETE) 3D. En situaciones de bajo gradiente y FE deprimida, la planimetría resulta insuficiente para discernir entre verdadera estenosis o seudoestenosis, requiriendo estudios adicionales como la eco-dobutamina.
Medición de TSVI y variación según métodos. A) Medida en ETT, TSVI 2,3cm, área estimada TSVI 4,1 cm2. B) Medida en ETE, TSVI 2,5cm, área estimada TSVI 4,9 cm2. C) Medida en ETE 3D, planimetría directa de TSVI, área estimada 5,0 cm2. En este mismo paciente hay diferencias de hasta el 18% en la medición del área de TSVI según la técnica elegida.
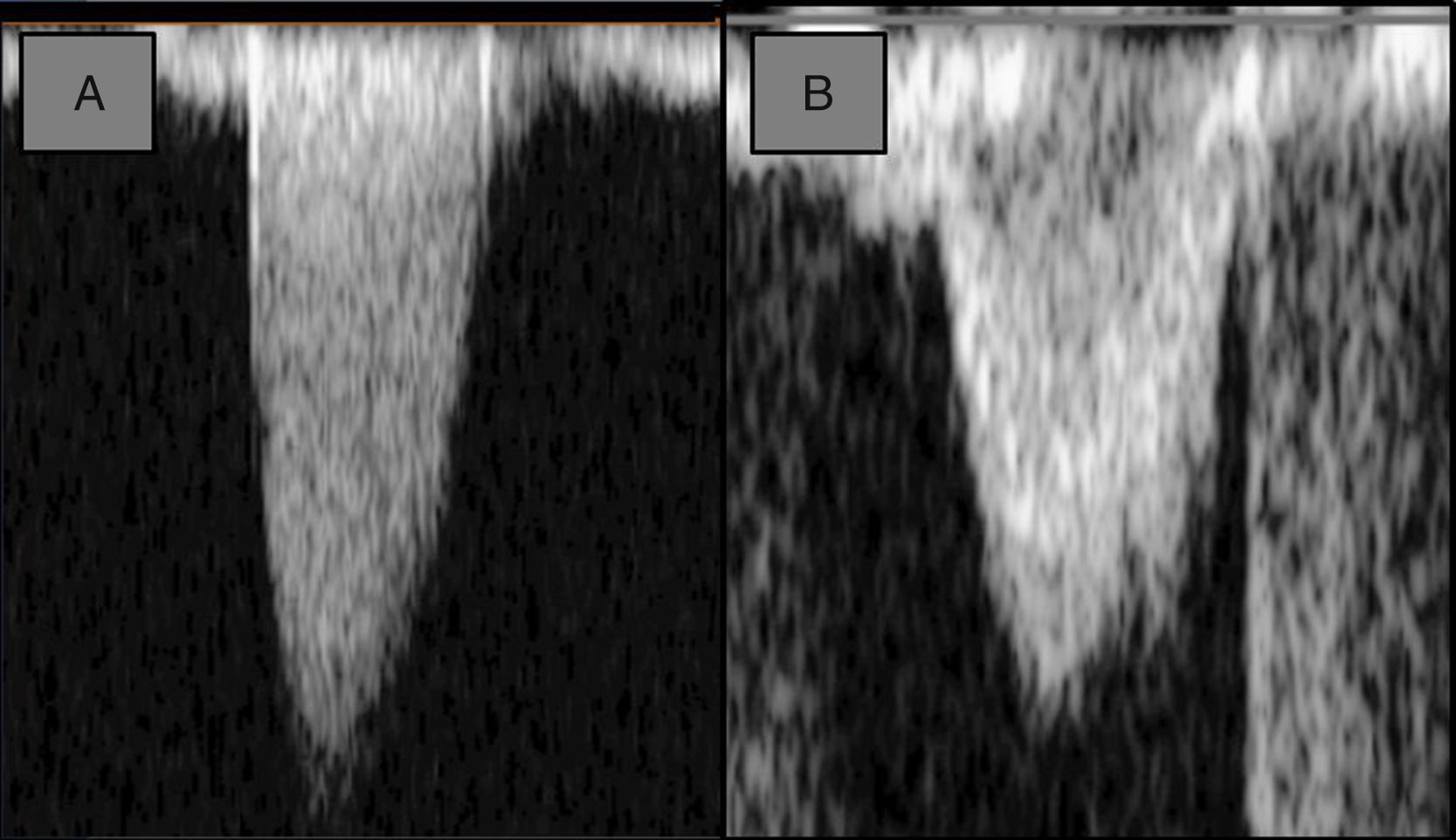
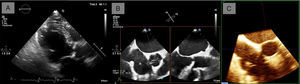
Parámetro este menos sometido a error que el cálculo del AVA por ecuación de continuidad (al ser independiente de la medida del diámetro del TSVI) pero sometido a adecuadas medidas Doppler, con las limitaciones que esto supone. Se considera criterio de severidad un valor ≤ 0,25 (fig. 2).
¿Cuál es el mejor parámetro para cuantificar estenosis aórtica, gradientes o área? ¿Es relevante el cálculo del flujo aórtico?De acuerdo con todo lo referido en los apartados anteriores, es difícil establecer qué parámetro es el de mayor consistencia a la hora de evaluar una EAo, debiendo tenerse en cuenta las fortalezas y las debilidades de cada uno de ellos. En nuestra opinión, el mejor parámetro será aquel que: a) esté bien medido (el diámetro del TSVI para el cálculo del AVA por ecuación de continuidad requiere una medición muy precisa y debe incluirse en el informe para posteriores estudios de seguimiento); b) no esté influenciado por otros factores (gradientes infra o supraestimados o variables como en fibrilación auricular, y c) sea consistente con el resto de los parámetros. Esto es, debe hacerse una integración razonada y juiciosa, tal y como reza el encabezado de este manuscrito, de todos los datos obtenidos, incluyendo la FE, el cálculo de flujo y, por supuesto, el contexto clínico, la superficie corporal del paciente y los hallazgos exploratorios. Se debe asumir también que, aunque el eco es la herramienta más útil y cercana, cabe la posibilidad de que sea insuficiente, siendo necesario recurrir a otras técnicas complementarias con las que afortunadamente ahora contamos.
A la pregunta de si el flujo debe tenerse en cuenta, nuestra respuesta es categórica: sí. Como observaremos en el apartado correspondiente, el flujo es determinante para el diagnóstico o no de una EAo severa de bajo gradiente paradójico.
Una vez definidos estos conceptos básicos, pasamos a analizar los diferentes escenarios que podemos encontrar en nuestra práctica diaria.
Escenarios posibles de estenosis aórtica severaLa EAo severa es la valvulopatía más frecuente en los países desarrollados4. Su tratamiento en los pacientes sintomáticos es el RVAo, ya sea quirúrgico o percutáneo; este último ha constituido una auténtica revolución y es una alternativa terapéutica consolidada en pacientes de alto riesgo que, de otra forma, no serían candidatos quirúrgicos. Paralelo a este progreso terapéutico se ha producido un creciente interés por sus diferentes formas de presentación, marcadores pronósticos y estratificación de riesgo en pacientes asintomáticos con criterios de severidad.
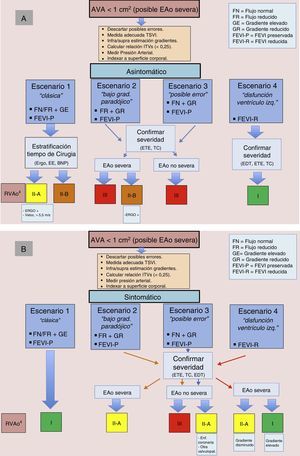
Si bien los criterios ecocardiográficos que clásicamente han definido una EAo como severa están claros: AVA<1cm2, o bien AVA indexada<0,6 cm2/m2, gradiente medio≥40mmHg y velocidad pico≥4m/s hasta en un 25-30% de los pacientes, se plantean dudas diagnósticas4,5. Los posibles escenarios a los que nos enfrentamos en la EAo severa son los siguientes:
- 1.
EAo severa «clásica»: flujo normal o bajo, gradientes elevados, AVA disminuida y FE conservada.
- 2.
EA osevera con bajo gradiente paradójico: flujo bajo, gradientes bajos, AVA disminuida y FE conservada.
- 3.
Probable EAo moderada: flujo normal, gradientes bajos, AVA disminuida y FE conservada.
- 4.
EAo severa con bajo gradiente y disfunción sistólica de VI vs. seudoestenosis: flujo bajo, gradientes bajos, AVA disminuida y FE deprimida.
En esta situación todos los parámetros antes descritos son concordantes en cuanto a severidad. El gradiente medio es≥40mmHg, velocidad máxima≥4m/s, el AVA calculada es menor de 1cm2 o el AVA indexada por la superficie corporal es<0,6 cm2/m2. Se trata de la forma de presentación más frecuente y en la que no se plantean dudas diagnósticas. La presencia de síntomas y/o de disfunción ventricular condiciona el pronóstico y la actitud terapéutica. Las guías de práctica clínica recomiendan el RVAo con indicación clase i en pacientes sintomáticos, en aquellos con FE<50% sin otra causa aparente y en aquellos asintomáticos con EAo severa y que desarrollan síntomas en un test de esfuerzo4.
Estenosis aórtica severa con bajo gradiente paradójicoSituación de flujo bajo, gradientes bajos, AVA disminuida y FE conservada. Se define esta entidad en presencia de un AVA menor de 1cm2 junto con un gradiente medio menor de 40 mmHg a pesar de una FE preservada. Tal y como hemos comentado antes, se considera bajo flujo a un volumen latido indexado por la superficie corporal menor de 35ml/m2. El diagnóstico de esta situación es difícil. Se presenta con ventrículos pequeños y marcadamente hipertróficos, con fisiología restrictiva y disminución intrínseca de la función ventricular. Suele asociarse a hipertensión y sexo femenino. Autores como Hachicha et al. teorizan que podría tratarse de un estadio más avanzado de la enfermedad y con un peor pronóstico, y otros como Tribouilloy et al. se inclinan a que esta entidad presenta un pronóstico más cercano a una EAo moderada6,7. Por otra parte, puede llevar a un falso diagnóstico de severidad en casos de estenosis realmente moderadas, debiendo descartarse errores de medida, especialmente en el cálculo del AVA o bien con superficies corporales bajas. La coexistencia de hipertensión dificulta aún más el diagnóstico, ya que esta puede condicionar también síntomas y elevación de biomarcadores humorales que con cierta frecuencia completan el estudio de la EAo3-9. Por lo tanto, en un escenario, en el que en ausencia de bajo flujo y de otras características asociadas con esta entidad tales como ventrículo pequeño e hipertrófico y fisiología restrictiva, el diagnóstico de EAo severa debe replantearse. Las guías de la Sociedad Europea de Cardiología (2012) establecen una indicación clase iia y nivel de evidencia C para el RVAo en pacientes sintomáticos con EAo severa de bajo gradiente y bajo flujo, siempre que se haya estudiado adecuadamente4.
Estenosis aórtica «severa» con flujo normal, bajo gradiente, área valvular aórtica disminuida y fracción de eyección conservada (probable estenosis aórtica moderada): diagnóstico diferencial obligado con la estenosis aórtica severa de bajo gradiente paradójicoDefinida como flujo normal (volumen latido indexado>35ml/m2), gradientes bajos (gradiente medio < 40 mmHg) con AVA disminuida (< 1cm2) y FE conservada. No es una entidad en sí misma, sino más bien un escenario presente de manera no infrecuente en la práctica diaria y que debe considerarse de forma obligada antes de hacer el diagnóstico de una EAo severa. Un flujo normal con gradientes bajos y FE preservada orienta hacia una EAo moderada con casi toda seguridad y debería reevaluarse todo el proceso diagnóstico (medidas de TSVI, etc.)10. Por otro lado, debe reconocerse que modelos teóricos han demostrado que para un AVA de 1cm2 el gradiente medio correspondiente sería de 30-35mmHg más que 40mmHg, que es valor tradicionalmente referido en la guías, y por ello algunos autores han propuesto un corte de 0,8cm2 cuando hablamos de severidad por AVA4,5,9-11.
Estenosis aórtica severa con bajo gradiente y disfunción sistólica del ventrículo izquierdoDefinida con gradientes bajos (gradiente medio<40 mmHg), flujo bajo (volumen latido indexado<0,35ml/m2) y FE deprimida (≤ 40%). En esta situación la dificultad diagnóstica se plantea en establecer si se trata de una EAo severa o de una seudoestenosis. En el primer caso, la severidad de la valvulopatía puede ser responsable de la disfunción ventricular y en la seudoestenosis la severidad se sobrestima por una incompleta apertura valvular secundaria a la situación de bajo flujo y baja FE. Se trata, una vez más, de un escenario complejo y no solo desde un punto de vista diagnóstico. Para una correcta evaluación tanto de la reserva contráctil, como de la severidad de la valvulopatía, se emplean bajas dosis de dobutamina (hasta 20 μg/kg/min), considerándose reserva contráctil un aumento del volumen latido superior al 20%. Si esta existe, la EAo severa mantendrá un área <1cm2, con aumento significativo de los gradientes, mientras que en la seudoestenosis se producirá un aumento del AVA con mínimo aumento de los gradientes12. Sin embargo, la valoración no resulta siempre tan sencilla. En el caso de enfermedad coronaria concomitante (con infarto previo y disfunción ventricular secundaria), la falta de reserva contráctil nos impide estimar adecuadamente por este método la severidad de la valvulopatía. En estos casos de resultados ambiguos, otras técnicas de imagen se hacen imprescindibles, especialmente en esta situación el grado de calcificación mediante TC cardiaca, como veremos más adelante, puede ser de gran utilidad13,14. Desde un punto de vista terapéutico, la mortalidad operatoria referida en algunas series oscila entre el 8 y el 18% cuando la FE está entre el 30 y el 35%. El eco de estrés con dobutamina es de ayuda en la valoración preoperatoria de estos pacientes ya que, de acuerdo con las guías de práctica clínica, se debe considerar el RVAo en pacientes sintomáticos con evidencia de reserva contráctil con nivel de indicación IIA. En el grupo de pacientes sin reserva contráctil, la indicación es IIB, siendo estos buenos candidatos para prótesis aórtica percutánea dado el alto riesgo quirúrgico4,15,16.
Prevalencia de los diferentes escenarios de estenosis aórtica severa¿Con qué frecuencia aparecen cada uno de estos posibles escenarios? La prevalencia y la evolución reportadas son dispares, dependiendo mucho de las características de las series. Es en el estudio de Hachicha et al., retrospectivo, donde por primera vez se distinguen estos escenarios y se encuentra una prevalencia del escenario 1 del 38%, del 2 del 24% y del 3 del 38%6. En estudios prospectivos se reportan prevalencias del escenario 2 (bajo gradiente paradójico) del 7%17. En nuestro hospital se recogieron prospectivamente todas las EAo moderadas y severas diagnosticadas en nuestro laboratorio de ecocardiografía desde abril a junio del 2016. Sobre 3.250 ecocardiografías, se encontraron 72 pacientes con EAo moderada y 88 con EAo severa, definida esta como AVA<1 cm2 o AVA indexada<0,6 cm2/m2. Sus características se detallan en la tabla 1.
Descripción de una población con estenosis aórtica severa
| N=88 pacientes con EAo severa por AVA | |
|---|---|
| Varones | 49 (55,7%) |
| Edad, años media ± DE) | 76,8±12,2 |
| Fibrilación auricular | 20 (23%) |
| IM≥II/IV | 26 (29,5) |
| Escenario 1 «clásico» | 34 (38,6%) |
| Escenario 2 «bajo gradiente paradójico» | 10 (11,4%) |
| Escenario 3 «bajo gradiente y flujo normal» | 21 (23,9%) |
| Escenario 4 «disfunción sistólica VI» | 23 (26,1%) |
Podemos observar como hay escenarios «fácilmente» catalogables, como el de la EAo «clásica» o el de la disfunción sistólica del VI (escenarios 1 y 4). Pero en un porcentaje alto puede haber inconsistencias (gradientes bajos a pesar de FEVI conservada) y de estos algunos pueden ser probables errores de medición (escenario 3) y otros deberían ser subsidiarios de RVAo (escenario 2). En nuestra serie, estos 2 escenarios se asociaron al sexo femenino y la presencia de fibrilación auricular.
Debemos concluir que las inconsistencias en el estudio ecocardiográfico pueden presentarse y que tampoco parecen resolverse con un estudio hemodinámico invasivo11. La mejor aproximación posible es una estimación adecuada de la sintomatología, buena exploración cardiovascular y un uso adecuado de la multimodalidad en imagen cardiaca.
¿Qué aporta la multimodalidad en imagen cardiaca?Hasta en un 25-30% de los pacientes el estudio ecocardiográfico transtorácico resulta insuficiente para establecer con claridad el grado de severidad de la EAo. En estos casos, para establecer un diagnóstico correcto, se hace necesario recurrir a otras técnicas de imagen18.
Ecocardiograma transesofágicoEl ETE, y especialmente el ETE 3D, puede ser de utilidad, permitiendo tanto obtener gradientes fiables en proyección transgástrica como realizar una medida más precisa del diámetro del TSVI y un cálculo del AVA mediante planimetría, siendo en este último caso el 3D especialmente útil. Finalmente, el ETE y, más en la modalidad 3D, será de utilidad para la medida del anillo en estudio preimplante de TAVI. Los resultados obtenidos mediante 3D son similares a la medida mediante TC cardiaco, siendo de especial beneficio en pacientes en los que deba evitarse el empleo de contraste18.
Ecocardiograma de estrésTanto el ecocardiograma de estrés con dobutamina como el eco de ejercicio son de utilidad en el estudio de la EAo severa. Por un lado, como ya hemos comentado previamente, el estudio con dobutamina nos va a permitir: a) conocer la existencia o no de reserva contráctil en pacientes con EAo de bajo gradiente y bajo flujo, y b) discernir, en caso de presentar reserva contráctil, si se trata de una EAo severa verdadera (con AVA<1cm2, e incremento en los gradientes o seudosevera). Sin embargo, en ausencia de reserva contráctil, la duda en cuanto a la severidad persistirá, siendo este el escenario para otras técnicas, como la TC cardiaca con el cálculo del score de calcio18,19.
Por otro lado, en el caso del eco de ejercicio, las guías de la Sociedad Europea de Cardiología establecen con indicación clase i el RVAo en pacientes asintomáticos con EAo severa que presentan síntomas con el ejercicio (ya sea ergometría convencional o eco de ejercicio) o bien caída de la presión arterial por debajo de la basal (indicación iia en esta circunstancia), permite, por lo tanto, estratificar a los pacientes aparentemente asintomáticos, distinguiendo a aquellos con mayor riesgo de eventos4,18. Al mismo tiempo, el eco de ejercicio evalúa el comportamiento del VI (presencia o no de alteraciones de la contractilidad asociadas o desenmascaradas con el esfuerzo) y el desarrollo de hipertensión pulmonar con el ejercicio (PSAP > 60mmHg), fenómeno predictor de eventos futuros20.
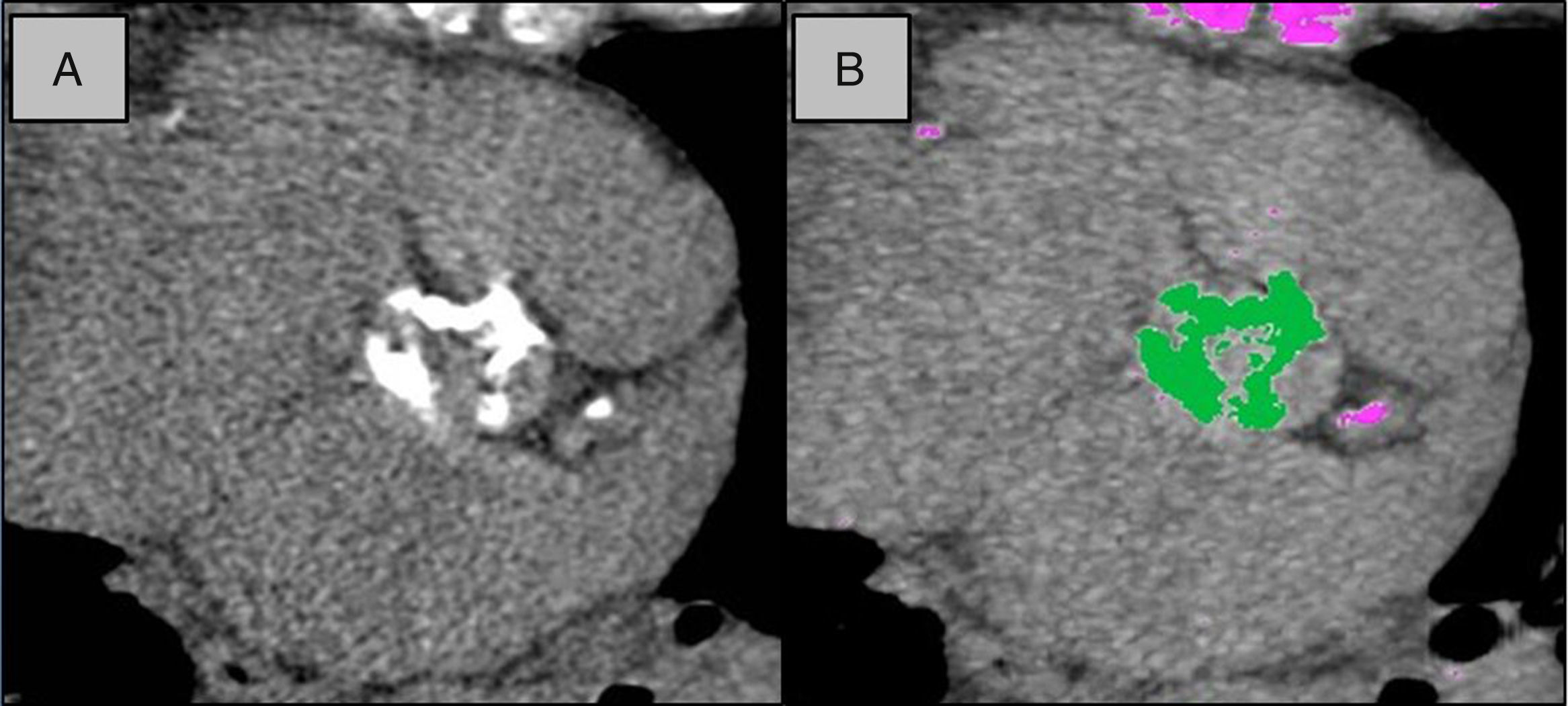
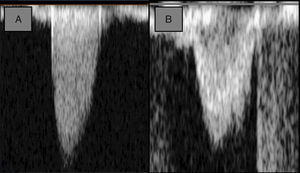
Tomografía computarizada cardiacaVarias son las utilidades de la TC cardiaca en el estudio de los pacientes con EAo. En aquellos casos en los que existan dudas en cuanto a su severidad con datos discordantes o no concluyentes, fundamentalmente en situaciones de bajo gradiente paradójico y de bajo gradiente con bajo flujo sin reserva contráctil, se ha propuesto el cálculo del score de calcio de la válvula aórtica. Los puntos de corte empleados son: en hombres ≥ 2.000 unidades Agatston (UA) o ≥ 480 UA/cm2 frente a mujeres (≥ 1.200 UA o ≥ 290 UA/cm2)21 (fig. 3). La TC cardiaca permite visualizar también el número de velos, medir el diámetro de la raíz de aorta y la aorta ascendente, y en el caso de los pacientes candidatos a TAVI permite medir con precisión el anillo valvular, así como su perímetro y área. En el mismo estudio es posible realizar el estudio de coronarias, que será especialmente rentable en los pacientes con baja probabilidad de enfermedad coronaria. Las únicas limitaciones son la disponibilidad de cada centro y la experiencia. Se debe tener también en cuenta que requiere el empleo de radiación ionizante y el uso de contrastes yodados18.
Cardiorresonancia magnéticaAunque posible, el papel de la cardio-RM en el estudio de la EAo está menos establecido. Si bien pueden realizarse tanto planimetría como cálculo de gradientes, no se trata de una técnica de uso rutinario y requiere experiencia, tanto en la adquisición de imágenes como en su interpretación. Es, sin embargo, especialmente útil para el estudio del miocardio, aspecto a tener en cuenta en los pacientes con bajo gradiente con disfunción ventricular en los que esta puede obedecer bien a sobrecarga de presión (fibrosis focal o difusa de predominio medio-ventricular), o bien a daño isquémico con patrón subendocárdico. La presencia de fibrosis en la EAo se ha propuesto como factor pronóstico y marcador de síntomas, insuficiencia cardiaca y eventos adversos22,23.
Estimación de sintomatología: papel del NT-proNBP y de la ergometríaVarios estudios han demostrado el papel pronóstico de la prohormona N-terminal del péptido natriurético cerebral (NT-proBNP) en la EAo severa, más allá de la evaluación clínica y ecocardiográfica. Los valores de NT-proBNP han demostrado predecir tanto la supervivencia libre de síntomas, como la supervivencia postoperatoria, pudiendo ser considerado como un biomarcador pronóstico con relevancia a la hora de decidir el momento quirúrgico. Las guías de práctica clínica, contemplan la cirugía como indicación iib C en la EAo severa asintomática con FEVI normal y elevación marcada y repetida del NT-proBNP que no pueda atribuirse a otra causa4,24,25. En un intento de buscar otros marcadores pronósticos, Lancellotti et al. correlacionaron los valores de NT-proBNP con diversos parámetros ecocardiográficos que pudieran predecir la aparición de eventos; así, en su estudio, una relación E/Ea>13,8 y un BNP≥61pg/ml identificaron a pacientes con mayor riesgo de eventos26. Si bien no se utiliza de rutina, el NT-proBNP debe ser tenido en cuenta en la toma de decisiones en casos dudosos en cuanto a la sintomatología, formando parte de la evaluación sistemática de nuestros pacientes. Por otro lado, de acuerdo con el estudio de Bergler-Klein et al., en el subgrupo de paciente con EAo severa de bajo gradiente y bajo flujo los valores de BNP han demostrado ser significativamente superiores en pacientes con EAo severa frente a seudosevera, siendo menor la supervivencia tras la cirugía en aquellos con BNP≥550pg/ml, independientemente de la presencia de reserva contráctil27.
En cuanto a la ergometría, ya nos hemos referido a su papel previamente. En las guías de práctica clínica de la Sociedad Europea se admite como indicación IC el RVAo en pacientes asintomáticos con EAo severa y test de ejercicio anormal con presencia de síntomas; el valor añadido del eco de ejercicio radica en la valoración simultánea del VI, el estudio del incremento de los gradientes (se considera indicación iib C el aumento del gradiente medio con el ejercicio>20mmHg) y el comportamiento de la PSAP4. Tanto el NT-proBNP en su papel de biomarcador pronóstico como la ergometría pueden ser especialmente útiles para seleccionar a aquellos pacientes, aparentemente asintomáticos, que se beneficiarían del RVAo. Su papel puede ser de especial interés en pacientes ancianos en los que debido a las comorbilidades la valoración de los síntomas se hace particularmente difícil28.
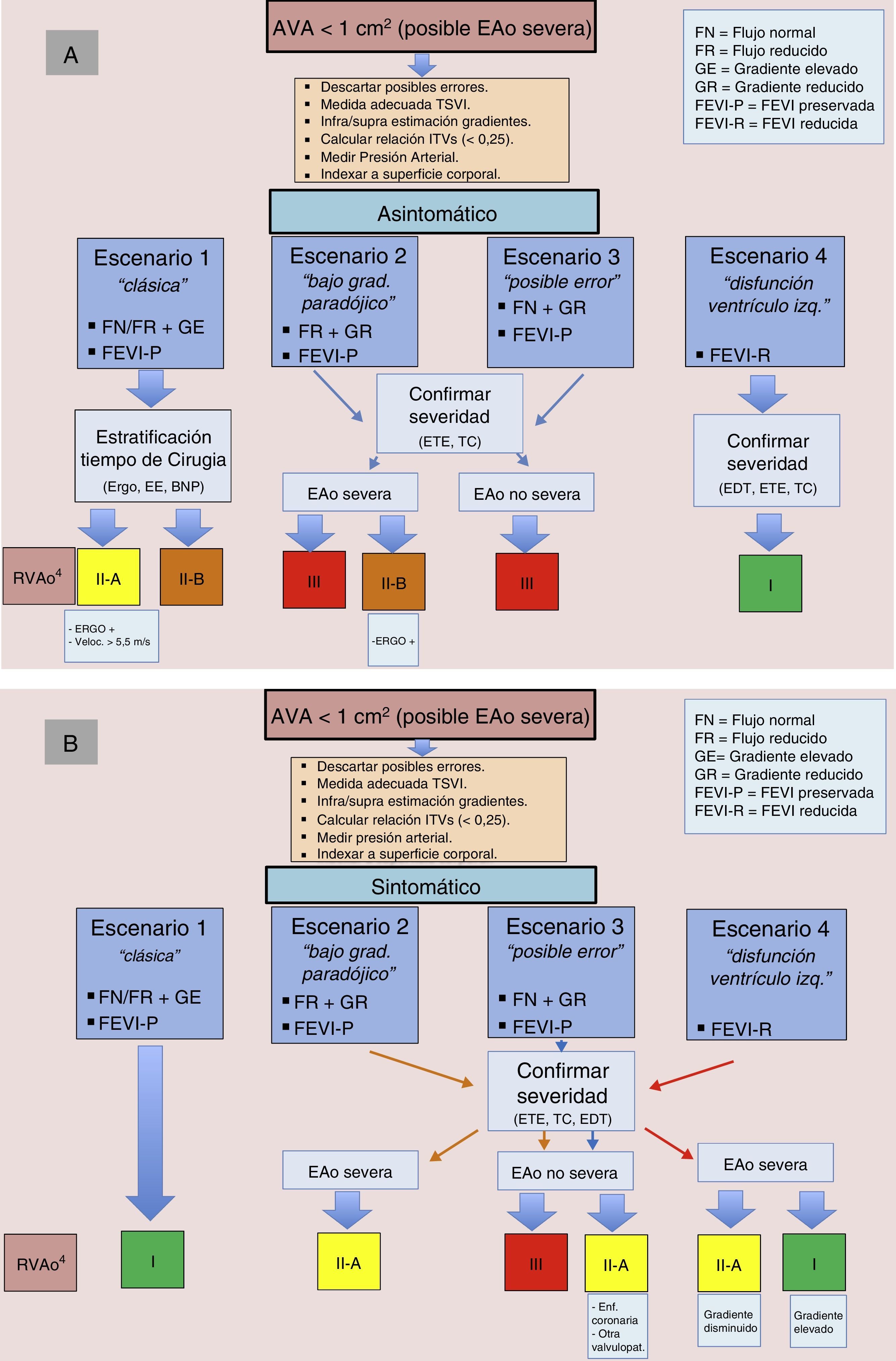
Conclusiones y propuesta de algoritmo integradorLos escenarios más habituales en EAo severa han sido 2 hasta hace pocos años, el «clásico» con FE preservada y todos los parámetros concordantes, y el de la disfunción sistólica del VI. En el primero, la presencia de síntomas (con búsqueda activa de los mismos) es la que guiará nuestra actuación, y en el segundo, la técnica a realizar es un eco-dobutamina para discernir entre EAo verdadera o seudoestenosis. Más complejas son las situaciones de bajos gradientes, FE preservada y AVA reducida29. Aquí la propuesta de pasos a realizar sería: 1) descartar errores de medida (ETE); 2) incorporar el cálculo del flujo aórtico; 3) valorar la presencia de síntomas y descartar o controlar HTA asociada, y 4) confirmar la severidad de EAo con técnicas alternativas (TC). Posteriormente, las claves que nos van a apoyar el RVAo en estas situaciones son la presencia de bajo flujo y la presencia de síntomas o, expresado de otra manera, pacientes con datos discordantes que se encuentran asintomáticos o que mantienen flujo normal no serían en principio candidatos a RVAo.
En la estratificación de EAo, tanto las guías europeas como las americanas abogan por una integración juiciosa de la clínica, la exploración y la ecocardiografía, y apoyarse en la multimodalidad de imagen cardiaca siempre que se precise para resolver situaciones complejas4,29. Proponemos un algoritmo integrador que puede servir de base para la estratificación y el manejo de los pacientes con EAo severa (fig. 4).
¿Qué podemos aportar a nuestra paciente referida al comienzo del manuscrito? La presencia de HTA y obesidad pueden justificar la clínica y el siguiente paso a realizar sería la medida del flujo cardiaco y una medida óptima de TSVI. Con los datos que se nos remite, esta paciente no debería ser aceptada para RVAo sin realizar una evaluación más completa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AgradecimeintosA los Dres Juan Calvo y Helena Cigarran, radiólogos, miembros activos del Grupo de Imagen Cardiaca de nuestro hospital.
Conflicto de interesesLos autores no presentan ningún conflicto de intereses con respecto a este manuscrito.