Se presenta el caso clínico de una paciente con un cáncer oculto de la mama. La situación clínica en la que se detectan ganglios axilares afectos por metástasis de adenocarcinoma pero sin evidenciarse tumor en la mama no es frecuente: entre el 0,3 y 0,8% de todos los tumores de la mama.
En esta revisión se subraya la importancia que está adquiriendo el PET como técnica de elección en la detección del tumor primario así como en la monitorización de la respuesta a la quimioterapia neoadyuvante.
Asimismo, se repasan los diferentes y controvertidos tratamientos propuestos. La tendencia actual es de máxima conservación, preconizando la disección axilar con radioterapia y tratamiento sistémico posteriores. En este último adquiere especial importancia el análisis inmunohistoquímico de la metástasis ganglionar para un diseño adecuado de la quimioterapia y los agentes anti-diana.
We report the case of a patient with occult cancer of the breast. A finding of metastatic adenocarcinoma to the axillary nodes with no apparent mass in the breast is rare, occurring in 0.3% to 0.8% of all breast tumors.
This review of the literature highlights the importance of positron emission tomography, which is becoming the gold standard in the detection of primary tumors and in monitoring response to neoadjuvant chemotherapy.
The various treatments proposed and their controversies are also discussed. The current trend is breast conservation. Axillary dissection, adjuvant radiotherapy and systemic treatment are recommended. In the latter, immunohistochemical analysis of lymph node metastases is particularly important for the appropriate design of chemotherapy and anti-target agents.
En 1907, Halsted1 describió por primera vez el carcinoma oculto de la mama. En 1909 Cameron2 recomendó para su tratamiento la mastectomía homolateral en los adenocarcinomas axilares con una mama sin hallazgos patológicos en el examen físico.
La introducción de la mamografía redefinió el término «tumor primario oculto», pero no modificó el tratamiento porque muchos de estos tumores no se identifican en la mamografía. El advenimiento de la RMN y el PET ha hecho que se pueden localizar en muchas ocasiones con éxito el tumor primario en el cáncer oculto de mama, por lo que se espera que disminuya en los próximos años la frecuencia de esta presentación.
Para estas pacientes en que el primario no es identificado, la radiación ha demostrado ser una opción terapéutica viable y parece conferir tasas de control local comparables a la mastectomía. El vaciamiento axilar ha sido una parte estándar del tratamiento quirúrgico de todas estas pacientes.
Caso clínicoMujer de 62 años sin antecedentes patológicos de interés, menopausia a los 56 años, paridad 3.0.0.3, con 1.er embarazo a los 21 años. Destaca el antecedente familiar de su abuela materna fallecida por cáncer de mama. Remitida de su ambulatorio por presentar adenopatía axilar derecha.
A la exploración destaca adenopatía axilar derecha, móvil, de aproximadamente 4cm. Ambas mamas son hipoplásicas y simétricas. No se palpan nódulos ni adenopatías en la axila izquierda.
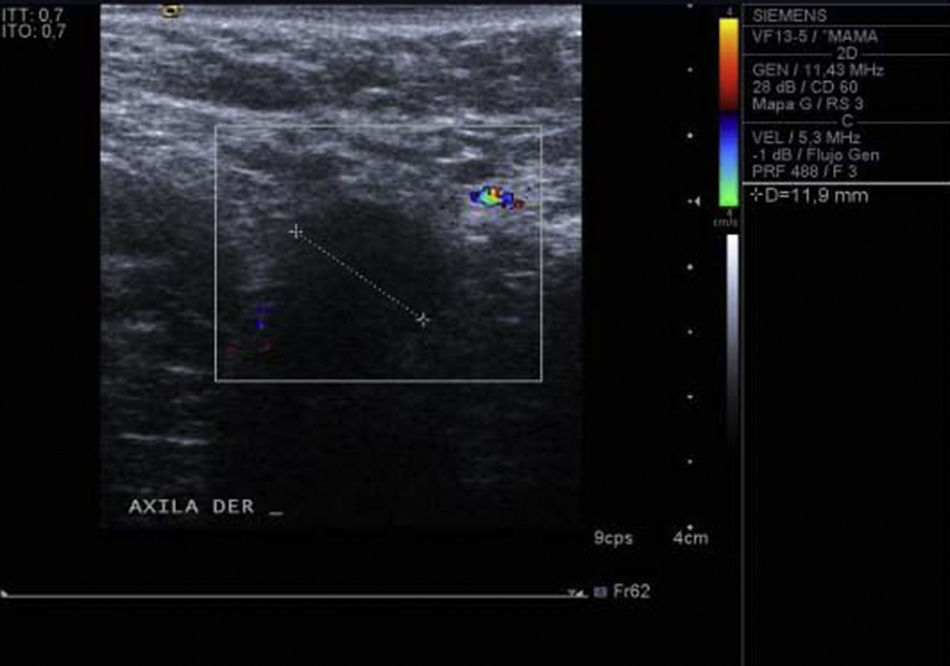
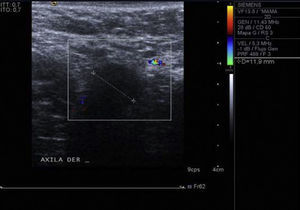
Se realiza mamografía en la que no se observan alteraciones focales sospechosas de carcinoma. En el examen ecográfico se visualizan múltiples adenopatías axilares derechas, la mayor casi de 4cm. Todas ellas de aspecto patológico. Se realiza core biopsia del ganglio más superficial (fig. 1).
El informe anatomopatológico informa de metástasis de carcinoma con inmunopositividad para CK 7,CK5, CK 6 y Her-2 Neu+(estudio por FISH: amplificado). Es negativo para CK 20, TTF-1 y también para receptores de estrógenos y progesterona. El perfil IHQ podría corresponder a un primario en mama o pulmón como orígenes más probables.
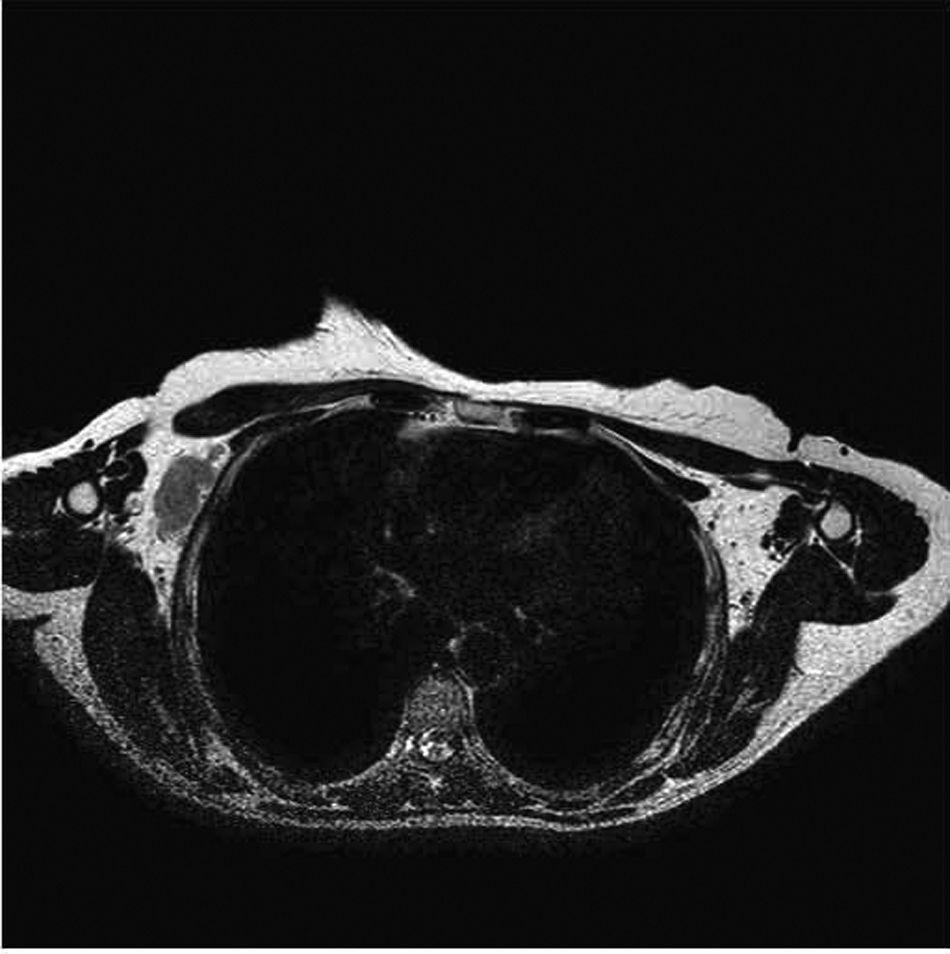
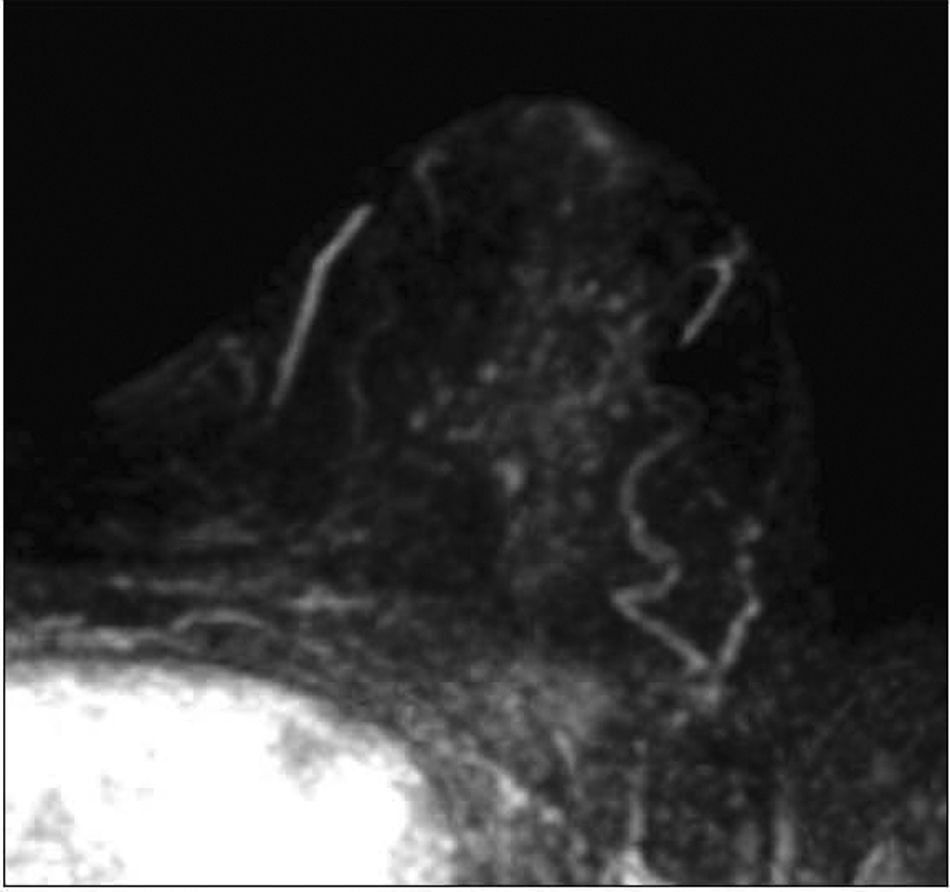
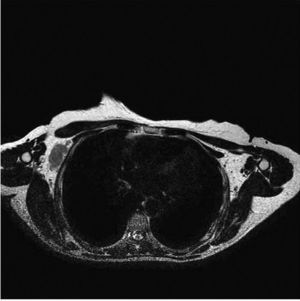
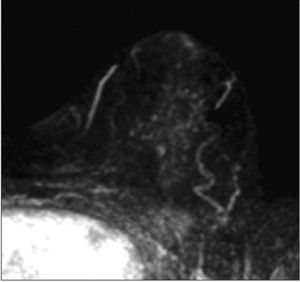
Se practica RMN mamaria donde se observan voluminosas adenopatías axilares derechas, la mayor de 4,3cm de diámetro. También llama la atención un foco de captación nodular de 6×5mm de diámetro a 2cm de la areola con captación intensa y precoz de contraste y moderada sospecha de malignidad. Se realiza PAAF de dicho nódulo, mostrando negatividad para células malignas (fig. 2 y fig. 3).
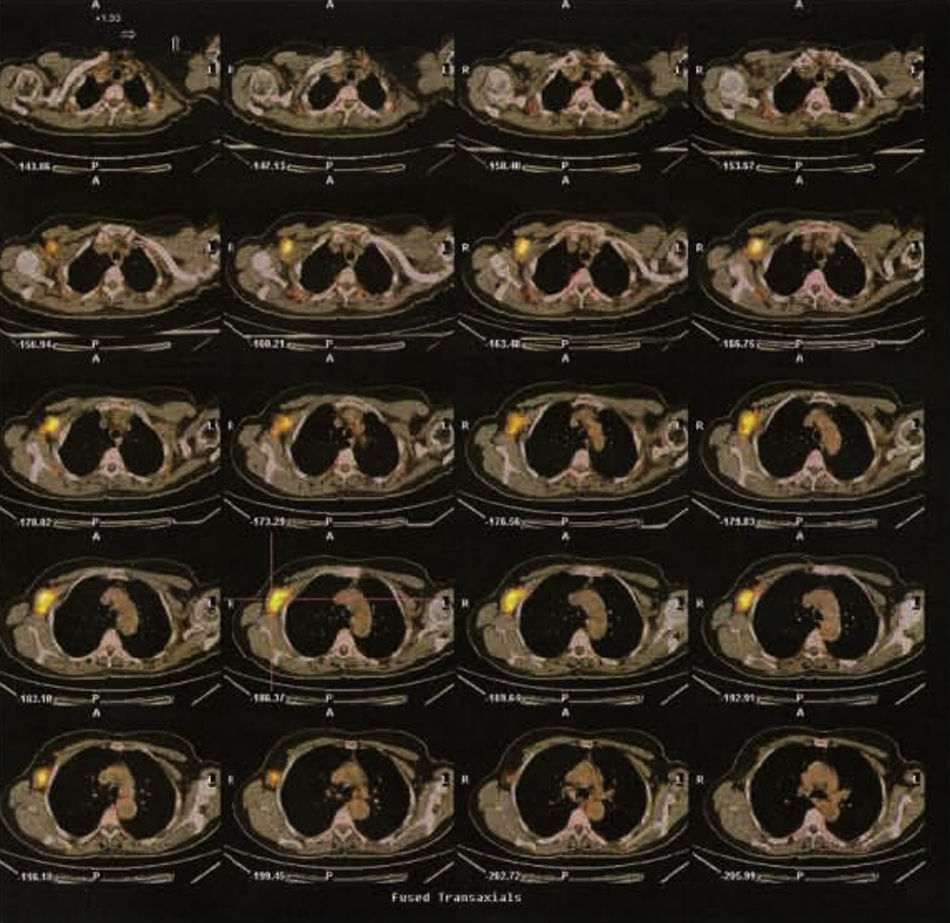
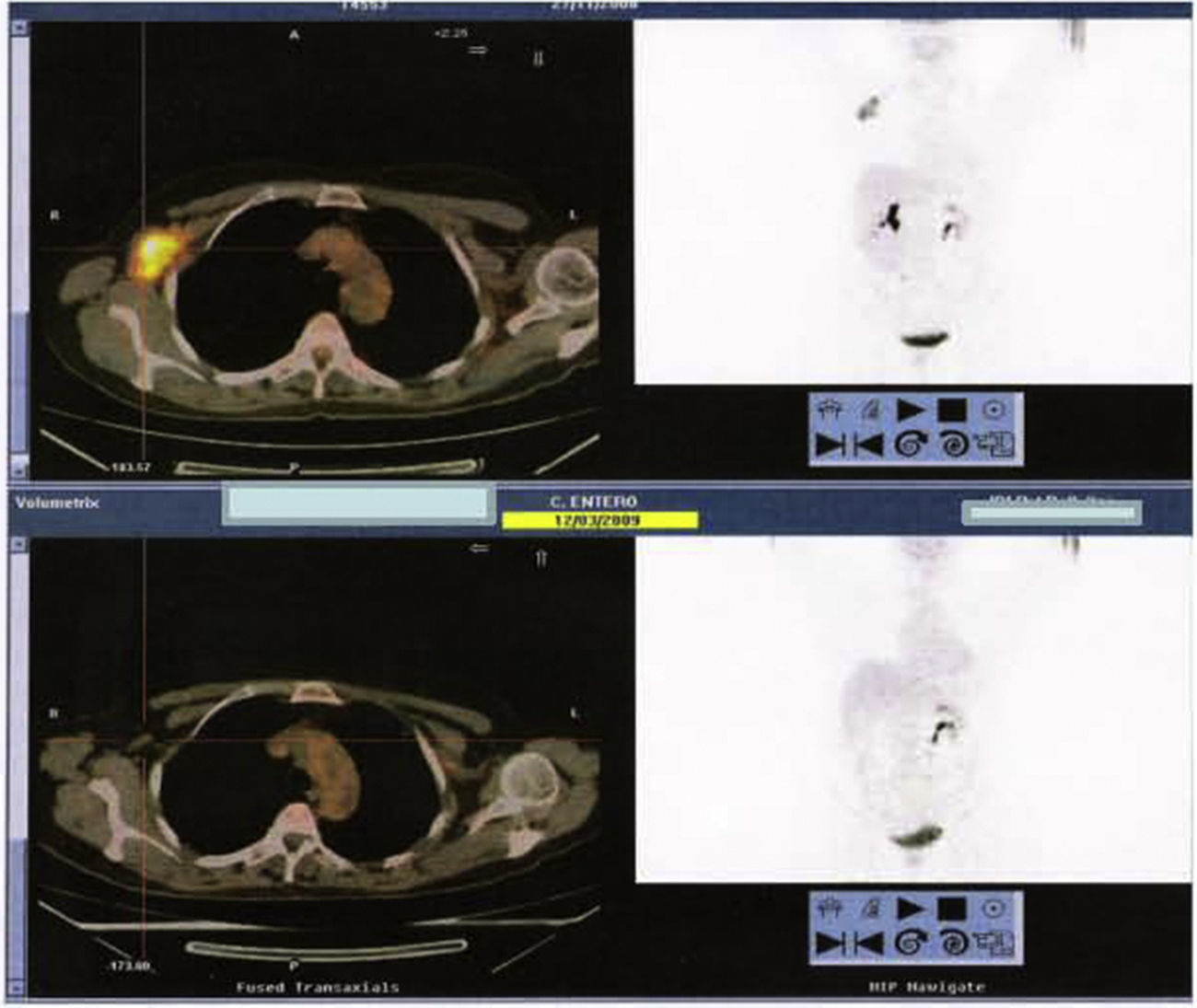
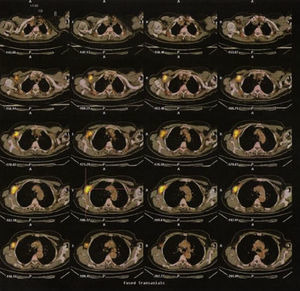
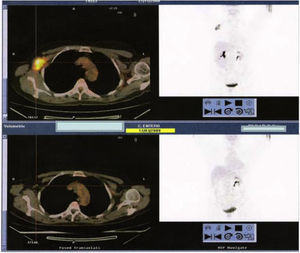
Posteriormente, se solicita PET. En éste no se observan lesiones hipermetabólicas sospechosas de tumor primario en el pulmón ni en la mama. En la axila derecha se observa una masa hipermetabólica (SUV máx.:15g/ml) de 37×20×45mm. Sospechosa de conglomerado adenopático metastásico (fig. 4).
La paciente inicia tratamiento quimioterápico neoadyuvante. Se decide realizar 12 semanas de taxol y herceptin.
Posteriormente al tratamiento quimioterápico, se practica de nuevo PET informando de buena respuesta precoz al tratamiento en la región axilar derecha, sin evidencia de otros focos hipermetabólicos sugestivos de malignidad (fig. 5 y fig. 6).
Seis meses tras el diagnóstico, una vez finalizado el tratamiento sistémico neoadyuvante, se practica linfadenectomía axilar derecha. Ésta transcurre sin incidencias y el diagnóstico anatomopatológico informa de ganglios reactivos sin evidencia de neoplasia, por lo que se cataloga de respuesta completa patológica.
Posteriormente a esto, se completa el tratamiento con quimioterapia adyuvante: 4 ciclos de AC y posteriormente trastuzumab hasta completar un año.
La paciente es derivada a Oncología Radioterápica para iniciar RT sobre la axila.
DiscusiónLa forma de presentación más frecuente del cáncer de mama oculto es la aparición de un linfonodo axilar metastásico palpable, en que clínica y radiológicamente no se encuentra un tumor primario en la mama3. Fue descrito por Halsted a principios del siglo pasado.
Con la mejora en la calidad de los estudios mamográficos se ha reducido su incidencia. Los tumores no visibles por mamografía hoy se visualizan en campañas de screeening como lesiones no palpables radiológicamente sospechosas y forman parte del diagnóstico precoz del cáncer de mama4. Son formas de presentación infrecuentes: representan como máximo el 0,5% de todos los tumores mamarios.
En la clasificación TNM y en el estadiaje puede variar desde un estadio IIA a un IIIA dependiendo del grado de afectación axilar. Se presenta como un T0 N1-N2 M0. Este estadio se mantiene si después del tratamiento quirúrgico no se descubre el tumor primario, ya que si se localiza se debería reestadiar variando la T5.
En los verdaderamente catalogables como carcinomas ocultos de mama no se pueden evaluar muchas de las características del tumor primario: tamaño, tumoral, grado histológico, etc. Pero sí que a veces podremos describir parámetros que tienen valor pronóstico como receptores hormonales, genes de proliferación o Her-2 neu6.
Dos situaciones nos deben hacer pensar que no estamos ante un verdadero carcinoma oculto de mama. La primera es el hallazgo de un tumor en la cola mamaria de Spencer, que será diferenciado en el análisis anatomopatológico. La segunda sería la aparición de metástasis axilares contralaterales en mujeres tratadas previamente de un cáncer primario de mama. En este caso, no se correspondería con el debut de un segundo cáncer de mama oculto, sino con la metástasis contralateral de aquel primer tumor de mama7.
En cuanto al diagnóstico, el hallazgo casual y generalmente asintomático de una adenopatía axilar no supone la necesidad de identificar un cáncer y menos aún que esté en la mama del mismo lado. Están descritas patologías infecciosas, inflamatorias y tumorales no mamarias que se pueden presentar en algún momento evolutivo como una adenopatía axilar aislada de un tamaño medio de entre 2-4cm.
La mayor parte de los carcinomas ocultos de mama tienen un diámetro máximo entre 1-2cm y aunque muchos de ellos suelen ser microscópicos, también están descritos casos de tumores con un tamaño de casi 5cm. Cualquier tipo histológico se puede manifestar como cáncer oculto y existen series en las que predomina el carcinoma medular sobre otros8.
Entre los tumores no mamarios destacan los linfomas como la causa más frecuente de enfermedad neoplásica maligna que debuta con una adenopatía axilar metastásica, pero también se incluyen otros tumores primarios localizados en órganos como el tiroides, pulmón, hígado, estómago, páncreas, colon, riñón, piel y las glándulas sudoríparas7.
En la literatura está descrito un 0,03% de metástasis axilar de cáncer de endometrio. En este caso el diagnóstico diferencial es entre la metástasis y el cáncer sincrónico de mama y endometrio9.
También se ha informado de algún caso en hombres. Gu et al informan de un caso en el sexo masculino al que le fue practicado mastectomía radical modificada. En el examen anatomopatológico no fue encontrado tumor primario en la mama y fueron positivos 2 de los 15 ganglios extraídos. La inmunohistoquímica mostró positividad para Her-2 neu, p53 y bcl-2. Los receptores hormonales fueron negativos10.
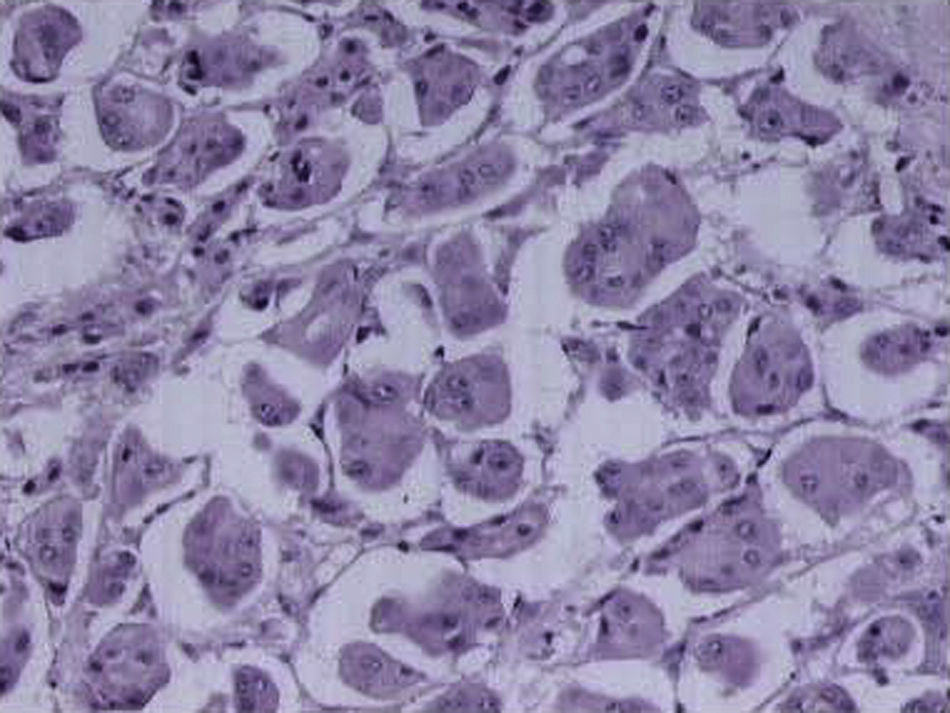
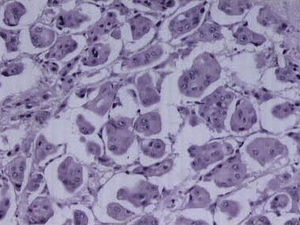
En cuanto a la anatomía patológica, por lo general se comunican patrones característicos de láminas tumorales sólidas sin formación de glándulas y células grandes con características citológicas apocrinas. Este patrón se observó en el 65% de los casos comunicados por Rosen y Kimmel11 (fig. 7).
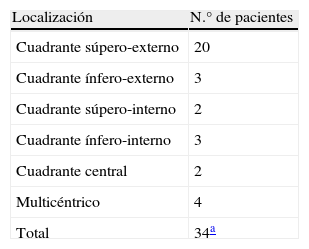
En la serie de Merson et al el lado predominante de las adenopatías fue el izquierdo (36 de 60). La distribución del tumor primario en aquellas que fue encontrado (37 de 60) fue la que se muestra en la siguiente tabla: tabla 1.
Revisión histológica: Distribución del cáncer en función de la ubicación en la mama (37 pacientes en las que el tumor fue encontrado)
| Localización | N.° de pacientes |
| Cuadrante súpero-externo | 20 |
| Cuadrante ínfero-externo | 3 |
| Cuadrante súpero-interno | 2 |
| Cuadrante ínfero-interno | 3 |
| Cuadrante central | 2 |
| Multicéntrico | 4 |
| Total | 34a |
Tomado de Merson et al. Breast carcinoma presenting as axillary metastases without evidence of a primary tumor. Cancer 1992 (24).
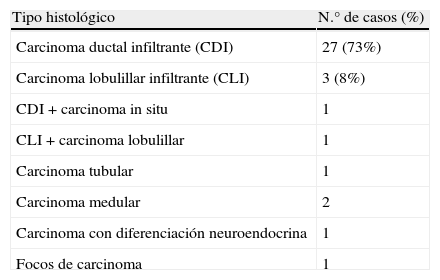
En el mismo estudio, el tipo histológico no fue muy diferente a lo esperado respecto del cáncer no oculto, pero sí mostró un inesperado predominio del grado III de Bloom y Richardson en los ganglios axilares y en el tumor primario (tabla 2 y tabla 3).
Tipo histológico del tumor primario (37 pacientes en las que el tumor fue encontrado)
| Tipo histológico | N.° de casos (%) |
| Carcinoma ductal infiltrante (CDI) | 27 (73%) |
| Carcinoma lobulillar infiltrante (CLI) | 3 (8%) |
| CDI+carcinoma in situ | 1 |
| CLI+carcinoma lobulillar | 1 |
| Carcinoma tubular | 1 |
| Carcinoma medular | 2 |
| Carcinoma con diferenciación neuroendocrina | 1 |
| Focos de carcinoma | 1 |
Tomado de Merson et al. Breast carcinoma presenting as axillary metastases without evidence of a primary tumor. Cancer 1992 (24).
Grado histológicoa, necrosis, invasión linfática peritumoral, e infiltración linfoplasmocitaria del tumor primario (37 pacientes en las que el tumor fue encontrado)
| Variable | N.° de casos (%) |
| Grado 1 | 1 (3,6%) |
| Grado 2 | 3 (10,7%) |
| Grado 3 | 24 (85,7%) |
| Total | 28b |
| Necrosis | 4/34 (11,8%)c |
| Invasión linfática peritumoral | 8/27 (29,6%)c |
| Infiltración linfoplasmocitaria (4 leve, 12 moderada, 7 marcada) | 23/35 (65,7%)c |
Tomado de Merson et al. Breast carcinoma presenting as axillary metyastases without evidence of a primary tumor. Cancer 1992 (24).
La tinción inmunohistoquímica positiva intensa para receptores de estrógeno o el hallazgo de positividad de 3+para Her-2 neu respaldan la presencia de un tumor primario de mama.
La mamografía no llega a identificar habitualmente el tumor primario. La sensibilidad del método cae desde un 90% en el cáncer de mama sintomático hasta un 25% en el caso de cáncer de mama oculto12.
Grandes series de pacientes como la del MD Anderson Cancer Center ponen de manifiesto la baja sensibilidad y especificidad de las mamografías en el intento de detección de estas tumoraciones. Las lesiones no palpables radiológicamente sospechosas derivadas de las mamografías no tienen un valor predictivo positivo realmente significativo13. Parece definido en la bibliografía que el valor de la mamografía en la detección del carcinoma oculto mamario es bajo: sensibilidad del 29% y especificidad del 73%14.
Los resultados de la ultrasonografía convencional son escasamente alentadores, con un elevado número de falsos positivos y falsos negativos15.
La poca rentabilidad diagnóstica de la mamografía ha llevado al empleo de la resonancia nuclear magnética. Ésta ha demostrado una alta sensibilidad entorno al 85-100%, pero con una baja especificidad, entorno del 35-90%. Morris et al16 realizan una RMN en 12 mujeres con cáncer oculto de mama, identificando la localización del tumor primario en 9 (75%). El tamaño de las lesiones oscilaba entre 9 y 20mm (media de 13mm).
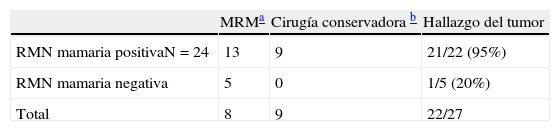
La RMN mamaria puede identificar el cáncer oculto de mama en algunos pacientes y puede facilitar la conservación de la mama en mujeres seleccionadas. Pero la RMN negativa tiene una baja predicción de detección del tumor, comprobado en piezas de mastectomía, como muestra el estudio de Olson et al17 (tabla 4).
Hallazgo del tumor tras la cirugía en cáncer oculto de mama (N=34)
| MRMa | Cirugía conservadora b | Hallazgo del tumor | |
| RMN mamaria positivaN=24 | 13 | 9 | 21/22 (95%) |
| RMN mamaria negativa | 5 | 0 | 1/5 (20%) |
| Total | 8 | 9 | 22/27 |
Tomado de Merson et al. Breast carcinoma presenting as axillary metyastases without evidence of a primary tumor. Cancer 1992 (24).
La RMN bilateral mamaria tiene que ser parte de la evaluación de las mujeres con cáncer oculto de mama.
La PET también se ha utilizado con éxito en la valoración de la posible afectación axilar en mujeres diagnosticadas de cáncer de mama. Sus datos son bastante fiables con una sensibilidad del 95% y con una especificidad del 65%. Podemos inferir, por tanto, que las pacientes con PET axilares negativos tienen un extremadamente bajo riesgo de tener invadidos los linfáticos axilares 18,19. Avril et al20 señalan que la sensibilidad de la PET para detectar el tumor primario depende del tamaño de la lesión y del tipo histológico. Así para los tumores T1 (0-2cm) la sensibilidad es de un 68,2%, para los T2 (2-5cm) de un 92% y para los T3 de un 100%. El porcentaje de falsos negativos para los carcinomas lobulillares es de un 65,2%.
Entre las ventajas de la PET destacan: la detección de lesiones a distancia que pueden provocar un cambio en la actitud terapéutica y su escaso número de falsos positivos21.
Como desventajas se pueden citar su alto coste y los resultados falsos negativos en tumores de pequeño tamaño pT1a(0,5cm) y pT1b(>0,5-1cm) y lesiones de bajo grado de malignidad.
También se ha reportado la utilidad del TAC. En un grupo japonés en el que se utilizó el TAC para estadiaje previo a la intervención quirúrgica, éste detectó 73 nódulos (tamaño medio 0,8cm) que no habían sido observados en la mamografía en una serie de 407 pacientes, aunque hay que comentar que las pacientes ya estaban diagnosticadas de un tumor principal y no eran por lo tanto cáncer de mama oculto. Tienen una tasa de detección de lesiones ocultas en la clínica y mamografía descubiertas por TAC de un 6%. Sin duda, son necesarios estudios ulteriores en comparación con la RMN y el PET22.
Existe consenso respecto al tratamiento quirúrgico y/o radioterápico de la axila y a los beneficios del tratamiento sistémico. Sin embargo, el manejo del cáncer oculto de mama es controvertido y han sido propuestas varias estrategias al respecto:
- -
Observación mamaria sin otro tratamiento
- -
Tratamiento con radioterapia
- -
Cuadrantectomía superoexterna, asociada o no a radioterapia
- -
Mastectomía
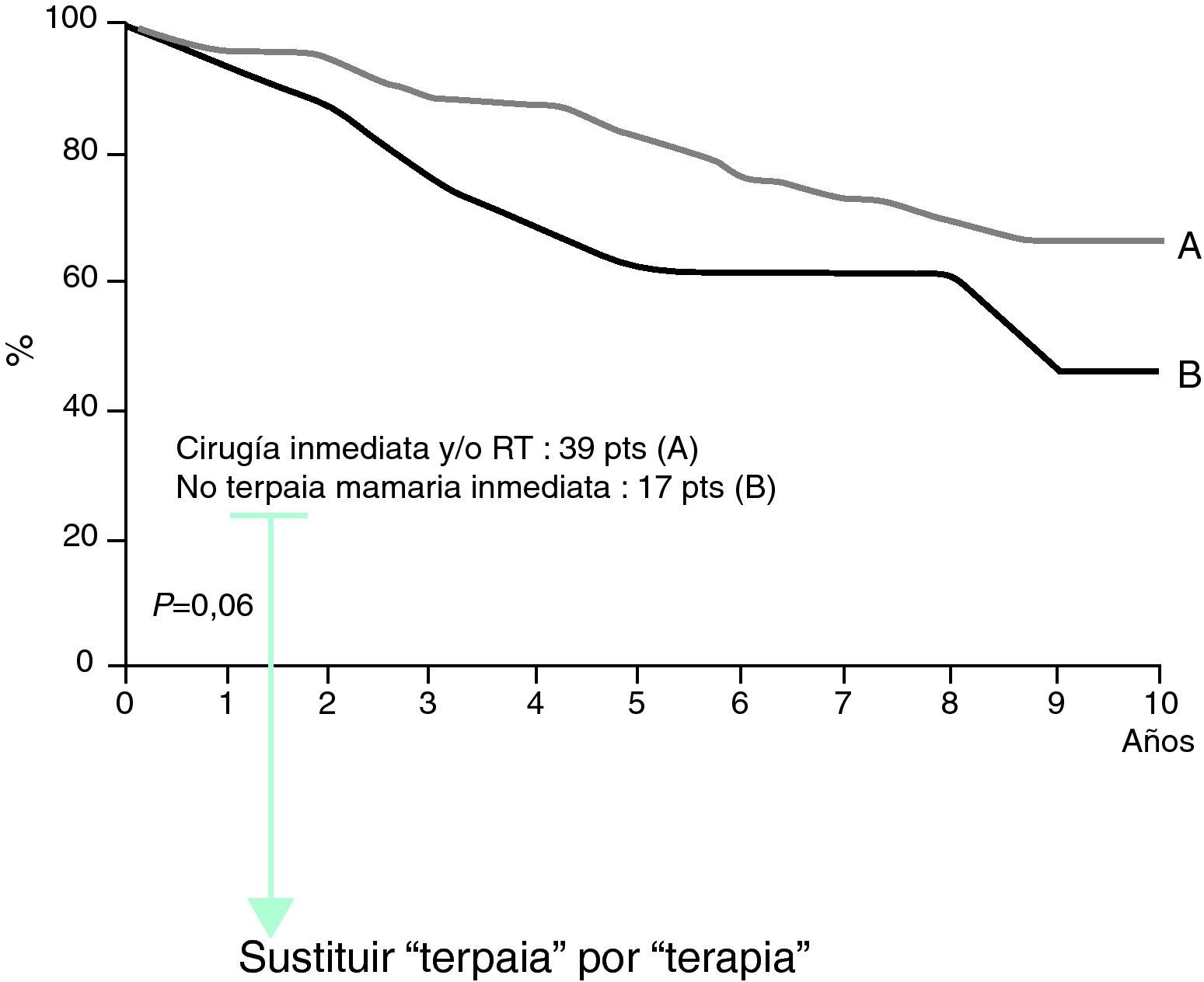
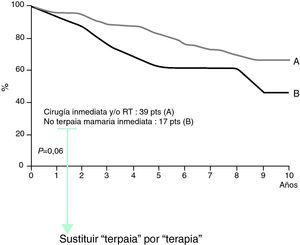
La actitud expectante fue promovida por Van Oijen et al23, aunque actualmente se desaconseja por la alta frecuencia con que los tumores primarios acaban apareciendo en la mama (más de un 50%). En una serie de 60 pacientes descrita por Merson et al24 que fueron aleatorizados a recibir tratamiento o simplemente a seguimiento, la supervivencia fue mayor en las que sí lo recibían pero sin significancia estadística (fig. 8).
La administración de radioterapia se ha propuesto como modalidad de tratamiento de la mama por algunos grupos que comunican resultados de control local de la enfermedad que oscilan entre el 7225 y el 100%26. Varadarajan et al27 en una serie de 10 pacientes trataron con radioterapia sin cirugía previa a 8 de ellas. Ninguna tuvo una recurrencia en la mama ni metástasis a distancia tras un seguimiento de 57 meses.
La tercera opción propuesta se basa en que la localización más frecuente de los tumores primarios es el cuadrante superoexterno. Es muy probable que la asociación de cuadrantectomía, radioterapia y quimioterapia incremente las tasas de control local, como sucede en las pacientes con tumores no ocultos28.
La mastectomía actualmente está desaconsejada. Cada vez hay mayor resistencia a realizar mastectomías ciegas, dado que aproximadamente en un 30% de las mamas resecadas no se encuentra el tumor29,30.
El estándar actual sugiere que frente a una adenopatía metastásica de origen mamario, sin otro tumor primario demostrable, se debería realizar vaciamiento axilar como una forma de proveer factores pronósticos (números de ganglios involucrados y estudios de receptores hormonales), además que éste representa una excelente forma de obtener control local de la enfermedad en la axila31.
En caso que recibiera cirugía conservadora se debe complementar con radioterapia en la axila. En la actualidad se emplea preferentemente acelerador de electrones y se realiza sobre la axila con una dosis de radioterapia que oscila entre 40-60Gy en 25 sesiones. Se administra en todas las cadenas linfáticas de drenaje locorregional mamario en aquellos casos en que solo se realizó la extirpación de la adenopatía debutante, existe afectación axilar masiva o presenta rebasamiento tumoral capsular.
En aquellos otros casos en donde se realizó la linfadenectomía axilar completa solo se irradió el vértice axilar, la fosa supraclavicular y la cadena mamaria interna32.
Adicionalmente, se sugiere agregar hormono, quimioterapia adyuvante o ambas según edad, número de ganglios comprometidos y condición de los receptores hormonales, así como terapia anti-diana en aquellas adenopatías con positividad para Her-2 neu.
Las pacientes con cáncer oculto de la mama y metástasis axilar deben ser consideradas según los estadios de la AJCC como estadios II y III (T0N1, T0N2). Por analogía en estos casos se debe ofrecer quimioterapia adyuvante como si se trataran de tumores primarios identificados. Como en el caso clínico presentado, debe considerarse en N2 quimioterapia neoadyuvante para reducir el volumen tumoral previo a la disección axilar33.
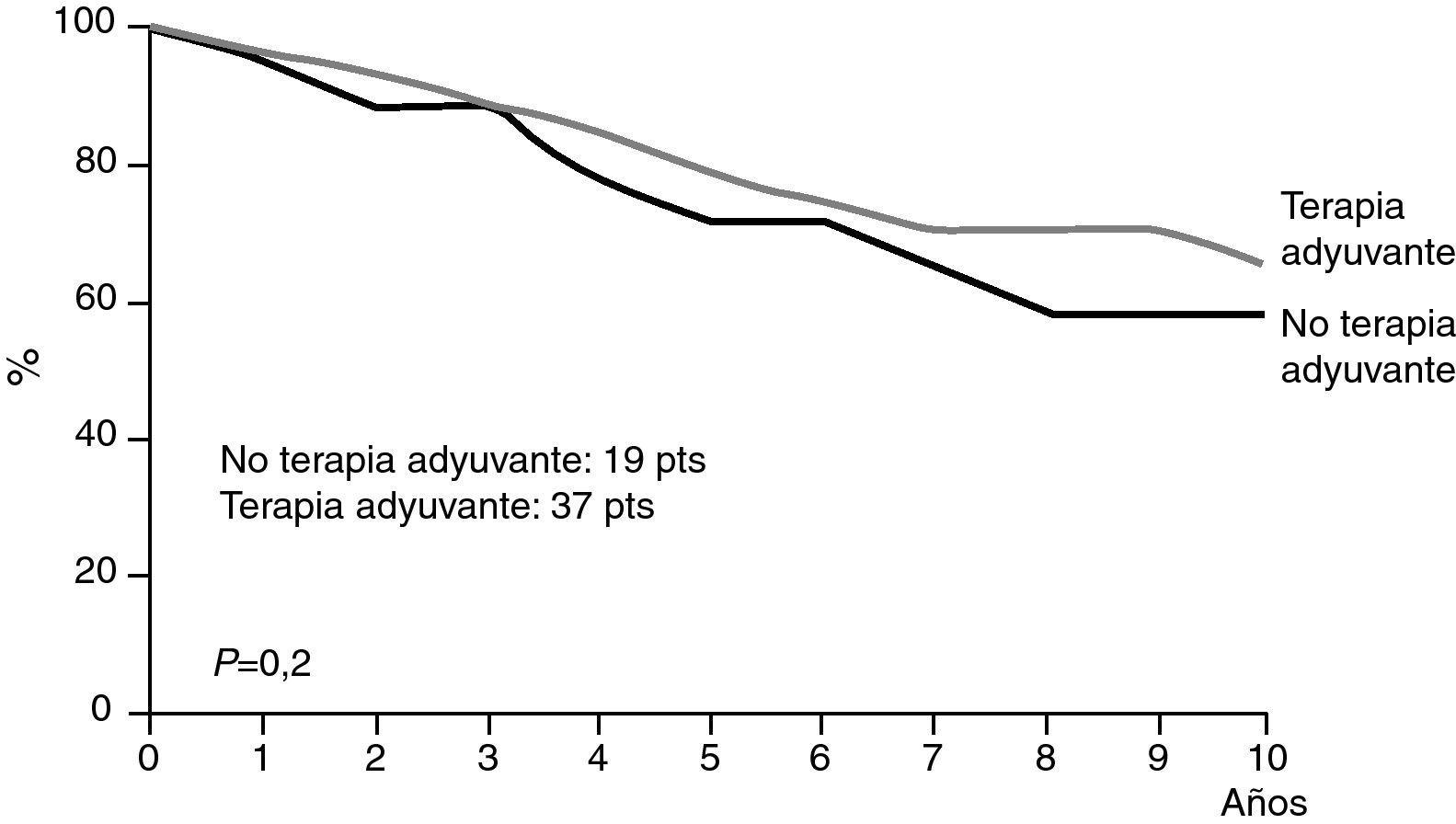
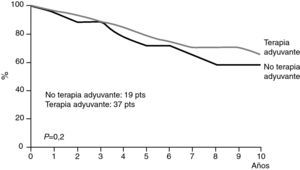
Sin embargo, en algunos estudios como el de Merson et al24 no se encuentran diferencias significativas en la supervivencia entre pacientes tratadas con o sin terapia adyuvante sistémica (fig. 9).
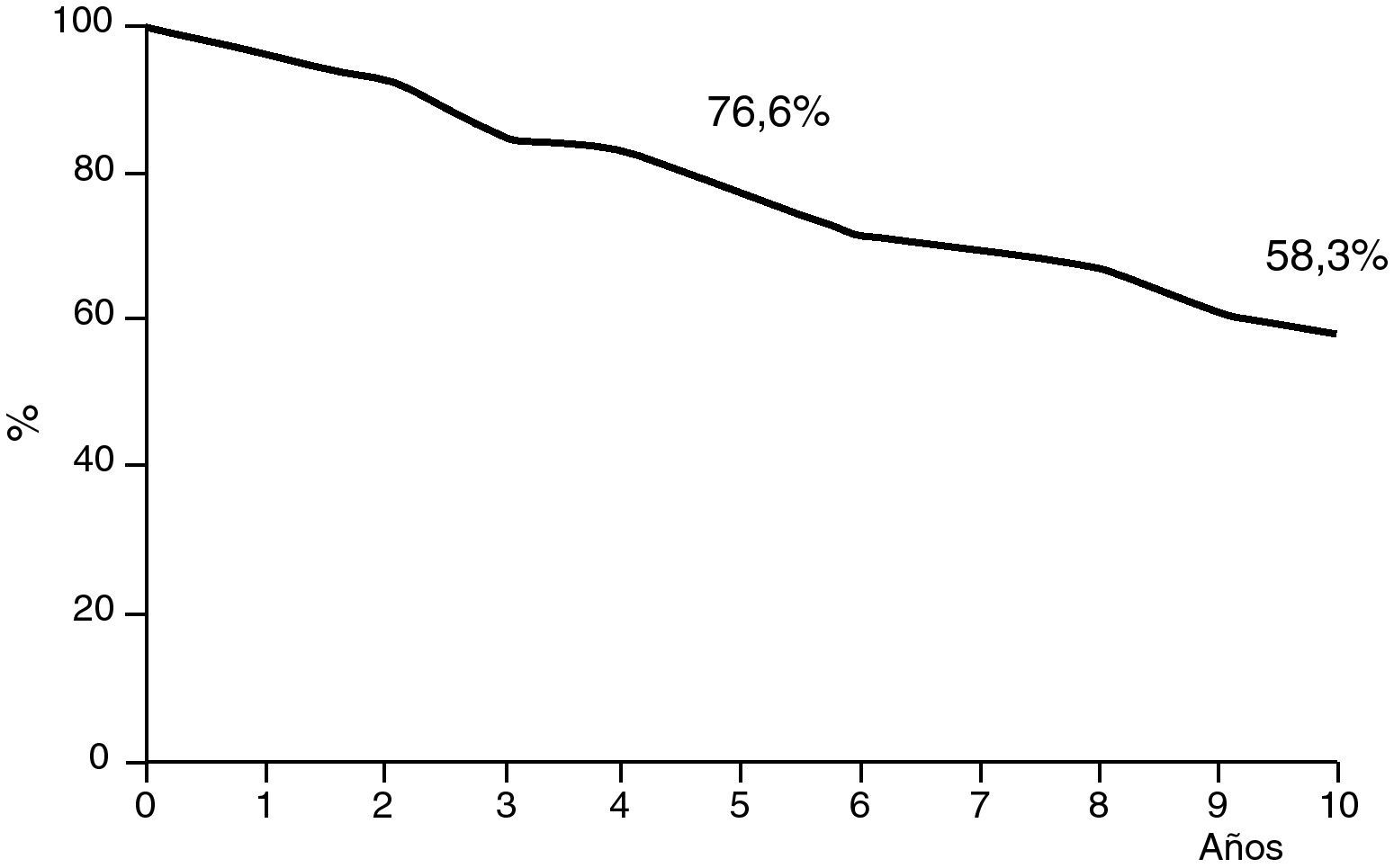
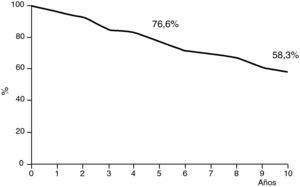
En cuanto al pronóstico, a pesar de que las series de cáncer de mama oculto son pequeñas, pareciera ser que el pronóstico es ligeramente superior al de los estadios II con tumores palpables, con cifras de sobrevida a los 10 años del 50 al 71%24,34–36 (fig. 10).
El número de ganglios afectados implicados ofrece una información pronóstica valiosa. Un estudio informa de una supervivencia a los 5 años del 91%, si el número de ganglios implicados es de 1 a 3 y desciende al 65% si están implicados más de 4 ganglios27.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.