La endometriosis es una enfermedad caracterizada por la presencia de células endometriales fuera de la cavidad uterina y que provoca efectos negativos sobre la fecundidad de la mujer. Sin embargo, el mecanismo por el cual los produce continúa sin conocerse correctamente.
ObjetivoEstudio retrospectivo de casos-controles para comparar los resultados de las técnicas de FIV/ICSI en mujeres con endometriosis y de parejas infértiles por factor masculino (FM), y para tratar de obtener evidencia sobre el impacto de la endometriosis en la gestación e investigar si afecta a los resultados de los tratamientos con FIV/ICSI actuales.
Material y métodosSe estudiaron entre 2009 y 2014, 156 pacientes con patología endometriósica y 665 pacientes con infertilidad por FM, consideradas como grupo control, sobre las que se realizaron 821 primeros ciclos. Se analizaron los parámetros de estimulación ovárica y los resultados de FIV/ICSI.
ResultadosLas pacientes endometriósicas precisaron mayor dosis de FSH en la estimulación, obteniéndose posteriormente menor número de ovocitos y de ovocitos maduros, aunque las tasas de fecundación fueron mayores en estas pacientes que en las del factor masculino. Todos los parámetros de criopreservación analizados fueron superiores en el factor masculino. No se obtuvieron resultados estadísticamente significativos en otros parámetros analizados, como la tasa de implantación, aunque las tasas de gestación y de nacido vivo analizadas, especialmente las acumuladas (transferencias en fresco +criotransferencias), fueron superiores en todos los casos en el factor masculino, sin alcanzarse significación.
DiscusiónEste estudio sugiere que la endometriosis afecta al éxito de la FIV/ICSI por reducir la respuesta ovárica a la estimulación de la ovulación, no estando afectadas ni la calidad ovocitaria ni la receptividad endometrial. Creemos necesario profundizar en los factores que causan dicha disminución en la reserva ovárica, como cirugía previa, extensión de la enfermedad o tratamientos farmacológicos previos.
Endometriosis is a disease characterised by the presence of endometrial cells outside the uterine cavity, leading to negative effects on the fertility of the woman. However, the mechanism whereby this occurs remains unclear.
ObjectiveA retrospective observational case-control study was conducted to compare the results of IVF/ICSI in women with endometriosis and male factor infertile couples, with the aim of finding evidence on the impact of endometriosis on the IVF/ICSI outcomes.
Material and methodsA study was carried out from 2009 to 2014, in which a total of 821 first cycles were performed on 156 patients with endometriosis, and 665 patients in whom the cause of infertility was due to pathology in their partner (male factor), and were considered as the control group. Ovarian stimulation parameters and IVF/ICSI outcomes were studied.
ResultsEndometriosis patients required higher doses of FSH stimulation, subsequently yielding fewer oocytes and mature oocytes, although fertilisation rates were higher in these patients than in those with male factor. All cryopreservation parameters analysed were higher in male factor. No statistically significant results were obtained in other parameters analysed, such as the implantation rate, although the pregnancy and live birth rates analysed, especially the accumulated rate (fresh transfers +cryotransfers) were higher in all cases in the male factor, but without significance.
DiscussionThis study suggests that endometriosis affects the success of IVF/ICSI by reducing the ovarian response to controlled stimulation, but neither oocyte quality nor endometrial receptivity are affected. It may be necessary to determine the factors that cause the decrease in ovarian follicle reserve, such as previous surgery, extent of disease, or previous drug treatments.
La endometriosis es una enfermedad caracterizada por la presencia de glándulas y estroma endometrial fuera de la cavidad uterina. Puede afectar a ovarios, órganos pélvicos, cavidad peritoneal en general y menos frecuentemente a órganos alejados, como los pulmones o la pleura. Las pacientes suelen consultar por infertilidad y/o dolor, aunque no todas tienen síntomas.
La prevalencia (3-10% en mujeres en edad fértil y 25-35% en mujeres no fértiles) resulta difícil de determinar, dado que el diagnóstico de certeza exige procedimientos invasivos. Aproximadamente el 25-50% de las mujeres infértiles pueden estar afectadas por la endometriosis, y el 30-50% de las pacientes con endometriosis pueden ser infértiles (Macer y Taylor, 2012).
Aunque no se conozcan con exactitud la aparición y propagación de la endometriosis, esta depende de la acción estrogénica, ya que se asocia a ciclos ovulatorios ininterrumpidos, aparece inmediatamente después de la menarquia y desaparece solo en el periodo menopáusico. Se cree que una excesiva acción de los esteroides ováricos estimula las células endometriales sensibles presentes de forma impropia en la cavidad peritoneal, lo que resulta en una intensa actividad inflamatoria, acompañada de la formación de adherencias, fibrosis y distorsión anatómica.
Es ampliamente aceptado que la endometriosis provoca efectos negativos sobre la fecundidad de la mujer. Sin embargo, el mecanismo por el cual se asocia a la infertilidad continúa sin conocerse correctamente (Dong et al., 2013). Son varios los mecanismos que han sido propuestos al respecto, incluyendo la distorsión de la anatomía pélvica, la alteración de la función ovárica, la disminución de la reserva folicular, la afectación de la receptividad endometrial y la reducción de la calidad tanto de los ovocitos como de los embriones. Los procedimientos de reproducción asistida representan una alternativa para vencer la infertilidad, pero los casos deben individualizarse para un correcto asesoramiento.
Las recomendaciones de la European Society of Human Reproduction and Embryology sobre el tratamiento con fecundación in vitro (FIV) en pacientes con endometriosis (Kennedy et al., 2005) se basan en un análisis de Barnhart et al. (2002). Ellos hallaron una reducción estadísticamente significativa en las tasas de éxito de mujeres con endometriosis comparadas con pacientes con infertilidad debida a factor tubárico, en términos de obtención de ovocitos, tasa de fecundación, tasa de implantación, así como una reducción de la tasa de gestación clínica del 20% en pacientes con enfermedad leve y de más del 50% en aquellas con afectación extensa. Sin embargo, estos resultados han sido objeto de discusión, dado que son varios los estudios que afirman que las pacientes con endometriosis sometidas a técnicas de FIV/ICSI obtienen resultados comparables a las pacientes infértiles por factor tubárico (Society for Assisted Reproductive Technology, 2008).
El presente estudio se realizó con el objetivo de comparar los resultados de las técnicas de FIV/ICSI en mujeres con endometriosis y de parejas infértiles por factor masculino, para tratar de obtener evidencia sobre el impacto de la endometriosis en la gestación e investigar si afecta a los resultados de los tratamientos con FIV/ICSI actuales.
Material y métodosEl estudio se diseñó como un estudio observacional analítico de casos y controles con carácter retrospectivo, analizándose pacientes sobre las que se había llevado a cabo un tratamiento de reproducción asistida en el período de enero de 2009 a marzo de 2014 en la Unidad de Reproducción del Hospital Universitario Virgen de las Nieves de Granada.
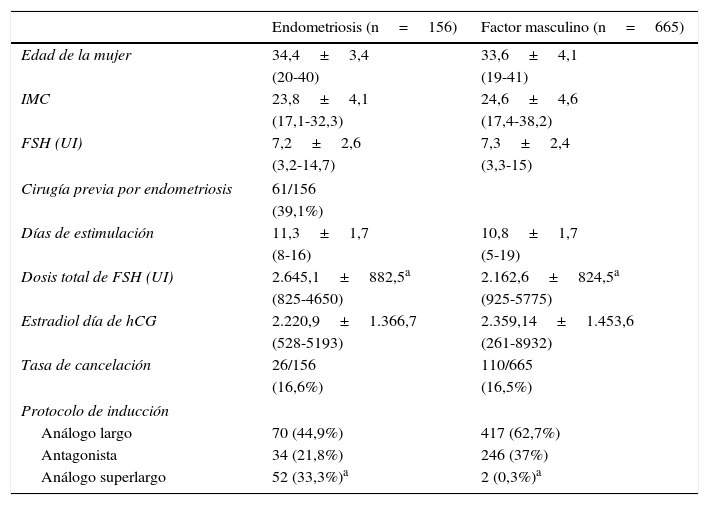
Los grupos de estudio incluyeron 156 primeros ciclos realizados en pacientes con patología endometriósica, y 724 primeros ciclos en pacientes en las que el motivo de la infertilidad era por patología en su pareja (factor masculino) y que fueron consideradas como el grupo control (tabla 1).
Características de las pacientes y de la estimulación ovárica en los grupos de estudio
| Endometriosis (n=156) | Factor masculino (n=665) | |
|---|---|---|
| Edad de la mujer | 34,4±3,4 | 33,6±4,1 |
| (20-40) | (19-41) | |
| IMC | 23,8±4,1 | 24,6±4,6 |
| (17,1-32,3) | (17,4-38,2) | |
| FSH (UI) | 7,2±2,6 | 7,3±2,4 |
| (3,2-14,7) | (3,3-15) | |
| Cirugía previa por endometriosis | 61/156 | |
| (39,1%) | ||
| Días de estimulación | 11,3±1,7 | 10,8±1,7 |
| (8-16) | (5-19) | |
| Dosis total de FSH (UI) | 2.645,1±882,5a | 2.162,6±824,5a |
| (825-4650) | (925-5775) | |
| Estradiol día de hCG | 2.220,9±1.366,7 | 2.359,14±1.453,6 |
| (528-5193) | (261-8932) | |
| Tasa de cancelación | 26/156 | 110/665 |
| (16,6%) | (16,5%) | |
| Protocolo de inducción | ||
| Análogo largo | 70 (44,9%) | 417 (62,7%) |
| Antagonista | 34 (21,8%) | 246 (37%) |
| Análogo superlargo | 52 (33,3%)a | 2 (0,3%)a |
FSH, hormona folículo estimulante; IMC, índice de masa corporal.
Las pacientes debían seguir un tratamiento de estimulación de la ovulación, con el propósito de conseguir un desarrollo folicular múltiple. Se utilizaron 3 protocolos de estimulación distintos: agonistas de la GnRH en la pauta de «análogo largo», en la pauta de «análogo superlargo», y por último el protocolo de «antagonista de la GnRH».
La recuperación ovocitaria se realizó por punción folicular ecoguiada vía transvaginal 36h después de la inyección de hCG-r, anticipándose así al proceso ovulatorio. Utilizando una aguja de punción ovárica (Labotect Labor-Technik-Göttingen, Göttingen, Alemania) se puncionaban uno a uno los folículos mayores de 17mm aspirando su contenido en tubos de recogida de líquido folicular (Becton Dickinson Labware, NJ, EE.UU.) con un sistema de vacío a 150mmHg de presión. El contenido del folículo aspirado se transportó rápidamente al laboratorio de reproducción en un contenedor previamente calentado a 37¿C para comprobar de inmediato la presencia del complejo cúmulo-corona-ovocito en el líquido folicular.
Una vez que los líquidos foliculares llegaban al laboratorio, se iniciaba la búsqueda e identificación del ovocito. Identificado este, mediante una pipeta Pasteur se depositaba en medio de cultivo de maduración IVF Vitrolife (IVF Science Scandinavia, Gotheburg, Suecia) hasta la realización de la ICSI.
Para llevar a cabo una adecuada selección del embrión o embriones con mejor potencial implantatorio se evaluaron según los criterios de la Asociación Española para el Estudio de la Biología de la Reproducción (ASEBIR) revisados en 2008. Las principales variables tenidas en cuenta para su evaluación incluían la tasa de división, la similitud de los blastómeros, el grado de fragmentación y la mononuclearidad en los blastómeros. En función de ello se clasificó a los embriones en clase A, B, C o D. Los embriones de claseA y claseB eran considerados como embriones de alta calidad. Esta clasificación comenzó a realizarse en la Unidad de Reproducción del Hospital Materno Infantil a partir de 2012, momento a partir del cual se tienen datos de ella.
La transferencia embrionaria en fresco se realizó el segundo o tercer día (D+2 o D+3) tras la punción folicular, para permitir una correcta evaluación y selección embrionaria. Se utilizaron los medios comerciales de vitrificación (Origio Vitrification, Dinamarca) con medios de equilibrado y vitrificación que contienen etilenglicol y 1,2-propandiol en HTF en concentraciones crecientes y el dispositivo de almacenamiento Cryoleaf (McGill Cryoleaf, Origio, Dinamarca). Todos los embriones criopreservados fueron almacenados en nitrógeno líquido a −196¿C en bombonas de almacenamiento (Air Liquide, Francia).
Para la criotransferencia embrionaria, el día anterior el embrión se desvitrificaba, utilizando el kit de desvitrificación (Origio Warming, Dinamarca) según las instrucciones de la casa comercial. Al finalizar se lavaba el embrión en medio G2 (Science Scandinavia, Gotheburg, Suecia), dejándolo en cultivo hasta el día siguiente, previa valoración de la calidad embrionaria y de la criosupervivencia (≤50% de células lisadas). El día de la criotransferencia (D+4) se valoraba de nuevo la calidad embrionaria, haciendo hincapié en la división embrionaria.
Las variables primarias de estudio fueron la tasa de recién nacido vivo o live birth ratio (LBR) y la tasa de recién nacido vivo acumulada (transferencias en fresco más las criotransferencias).
Entre las variables secundarias que se han analizado se encuentran el número de ovocitos obtenido, la tasa de implantación, la tasa de gestación clínica por ciclo, por punción y por transferencia, o tasa de gestación evolutiva por ciclo, punción y transferencia.
La gestación clínica se define como niveles de hCG en sangre >20UI/l y confirmación observacional de saco gestacional mediante ecografía transvaginal 5-7semanas después de la transferencia. La tasa de implantación se obtiene de dividir el número de sacos gestacionales presentes en dicha ecografía por el número de embriones transferidos. Se considera que una gestación es evolutiva cuando se confirma por ecografía transvaginal un embarazo intrauterino intacto en la semana 12de gestación. Por último, la LBR corresponde a la tasa de recién nacidos vivos por el total de transferencias realizadas.
Otras variables secundarias estudiadas fueron los parámetros embrionarios y los de la estimulación ovárica controlada, como la dosis y duración de gonadotropinas, los niveles de estradiol (E2) el día de la hCG, la tasa de cancelación, el número de embriones obtenidos y la tasa de embriones de buena calidad y qué porcentaje fue transferido en los días2 y 3. Por último, también se estudiaron varios parámetros relacionados con los embriones que fueron criopreservados, como la tasa de descongelaciones, la tasa de supervivencia embrionaria a la desvitrificación o el porcentaje de gestaciones tanto clínicas como evolutivas que se obtuvieron por criotransferencia.
Métodos estadísticosEl análisis estadístico de los datos obtenidos en este estudio se realizó mediante los paquetes estadísticos SSPS y MedCalc. Las variables cualitativas se describen mediante frecuencias absolutas y relativas (porcentajes). Las variables cuantitativas se describen mediante la media, desviación estándar, máximo y mínimo. La normalidad de las variables cuantitativas se determinó por el test de Shapiro Wilk, rechazándose la hipótesis de normalidad por debajo de un p<0,005. Todas las variables cuantitativas siguieron una distribución normal. Para la comparación de variables cualitativas entre los 2 grupos de pacientes se utilizó el test de χ2, y en caso de no cumplirse las condiciones de validez, el test de Fisher. En caso de encontrarse significación estadística se calculó la odds ratio y su intervalo de confianza al 95% como medida del efecto. Para la comparación de medias entre los grupos de pacientes establecidos se realizó en primer lugar el test de Levenne para comprobar la homogeneidad de las varianzas. Si dicho test resultaba significativo, se realizaba el test de Welch, y si el test de Levenne resultaba no significativo, se calculaba la t de Student clásica. En caso de encontrar significación, se calculó la diferencia entre medias y su intervalo de confianza al 95%. Se consideró un nivel de significación en los test de contraste de hipótesis de p<0,05.
ResultadosNo se han observado diferencias significativas en la media de edad de las pacientes incluidas en ambos grupos. Aunque no encontramos diferencias en los días de estimulación, sí fueron significativamente mayores las dosis de FSH necesarias para la estimulación ovárica en el grupo de endometriosis con respecto al de factor masculino (2.645,1±882,5 vs 2.162,6±824,5; p<0,001). También se hallaron diferencias estadísticamente significativas (p<0,001) en el tipo de protocolo de inducción empleado en los 2 grupos de estudio, siendo más frecuente el protocolo de análogo superlargo en las pacientes con endometriosis (32,1% vs 0,3%).
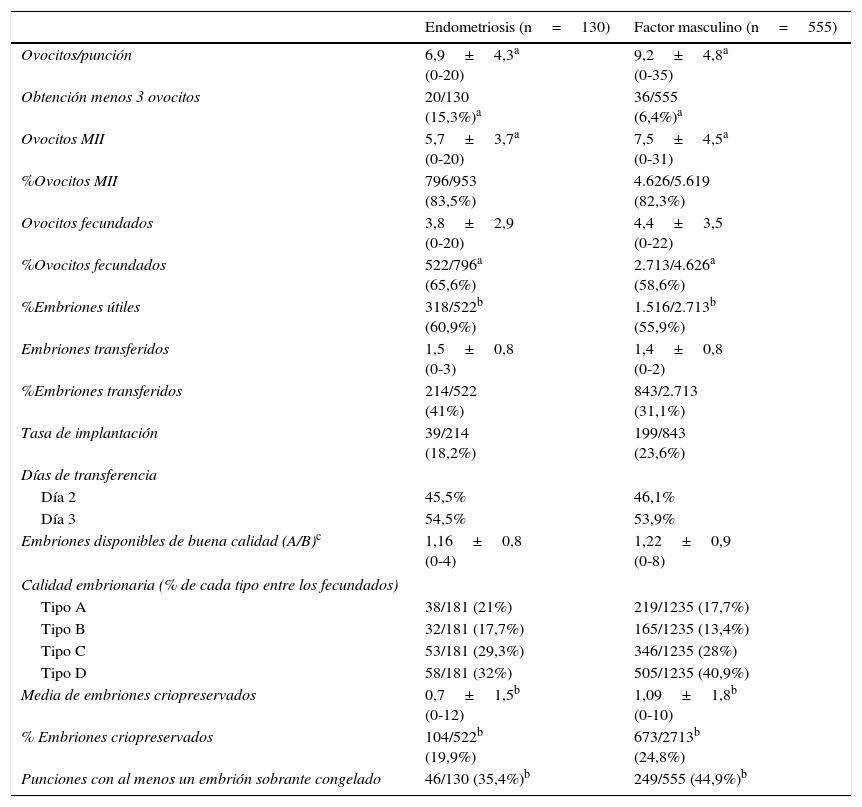
La tabla 2 analiza los resultados obtenidos por el laboratorio de embriología, obteniéndose diferencias estadísticamente significativas en varias variables. El número de ovocitos obtenidos fue superior en el grupo de factor masculino con respecto al de endometriosis (diferencia de 2,33 ovocitos; IC95%: 1,4-3,2), al igual que el número de ovocitos maduros o metafaseii (diferencia de 1,8 ovocitos metafaseii, IC95%: 0,97-2,63), con un valor p<0,001 en ambos casos. El porcentaje de punciones con obtención de 3 o menos ovocitos fue significativamente superior en pacientes con endometriosis (15,3% vs 6,4%, p<0,001).
Resultados de laboratorio de embriología de las punciones realizadas en los grupos de estudio
| Endometriosis (n=130) | Factor masculino (n=555) | |
|---|---|---|
| Ovocitos/punción | 6,9±4,3a (0-20) | 9,2±4,8a (0-35) |
| Obtención menos 3 ovocitos | 20/130 (15,3%)a | 36/555 (6,4%)a |
| Ovocitos MII | 5,7±3,7a (0-20) | 7,5±4,5a (0-31) |
| %Ovocitos MII | 796/953 (83,5%) | 4.626/5.619 (82,3%) |
| Ovocitos fecundados | 3,8±2,9 (0-20) | 4,4±3,5 (0-22) |
| %Ovocitos fecundados | 522/796a (65,6%) | 2.713/4.626a (58,6%) |
| %Embriones útiles | 318/522b (60,9%) | 1.516/2.713b (55,9%) |
| Embriones transferidos | 1,5±0,8 (0-3) | 1,4±0,8 (0-2) |
| %Embriones transferidos | 214/522 (41%) | 843/2.713 (31,1%) |
| Tasa de implantación | 39/214 (18,2%) | 199/843 (23,6%) |
| Días de transferencia | ||
| Día 2 | 45,5% | 46,1% |
| Día 3 | 54,5% | 53,9% |
| Embriones disponibles de buena calidad (A/B)c | 1,16±0,8 (0-4) | 1,22±0,9 (0-8) |
| Calidad embrionaria (% de cada tipo entre los fecundados) | ||
| Tipo A | 38/181 (21%) | 219/1235 (17,7%) |
| Tipo B | 32/181 (17,7%) | 165/1235 (13,4%) |
| Tipo C | 53/181 (29,3%) | 346/1235 (28%) |
| Tipo D | 58/181 (32%) | 505/1235 (40,9%) |
| Media de embriones criopreservados | 0,7±1,5b (0-12) | 1,09±1,8b (0-10) |
| % Embriones criopreservados | 104/522b (19,9%) | 673/2713b (24,8%) |
| Punciones con al menos un embrión sobrante congelado | 46/130 (35,4%)b | 249/555 (44,9%)b |
El porcentaje de ovocitos fecundados fue superior en el grupo de endometriosis (OR=1,34; IC95%: 1,15-1,57; p<0,001), así como el porcentaje de embriones útiles logrados (OR=1,23; IC95%: 1,02-1,49; p<0,05).
Por último, tanto la media de embriones criopreservados (diferencia 0,39 embriones criopreservados; IC95%: 0,06-0,72; p<0,05), como el porcentaje de embriones criopreservados por punción (OR=0,75; IC95%: 0,59-0,95; p<0,05), como el porcentaje de punciones realizadas con al menos un embrión sobrante congelado (OR=0,67; IC95%: 0,45-0,99; p<0,05), arrojaron datos significativamente superiores en el grupo de factor masculino frente al grupo de endometriosis.
No se obtuvieron diferencias estadísticamente significativas ni en la tasa de implantación (p=0,09) ni en la media de ovocitos fecundados (p=0,07).
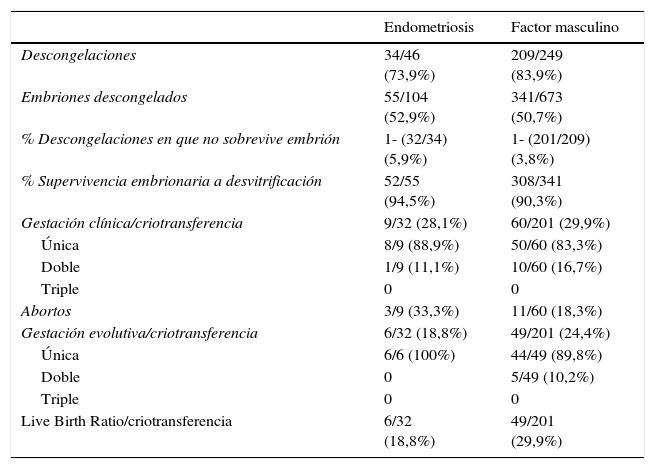
La tabla 3 desglosa los datos hallados en las criotransferencias. No se obtuvieron diferencias estadísticamente significativas en las variables de estudio, aunque sí una tendencia a mayores tasas de descongelación en el grupo de factor masculino, con una p=0,1.
Criotransferencias: resultados y gestaciones en los grupos de estudio
| Endometriosis | Factor masculino | |
|---|---|---|
| Descongelaciones | 34/46 (73,9%) | 209/249 (83,9%) |
| Embriones descongelados | 55/104 (52,9%) | 341/673 (50,7%) |
| % Descongelaciones en que no sobrevive embrión | 1- (32/34) (5,9%) | 1- (201/209) (3,8%) |
| % Supervivencia embrionaria a desvitrificación | 52/55 (94,5%) | 308/341 (90,3%) |
| Gestación clínica/criotransferencia | 9/32 (28,1%) | 60/201 (29,9%) |
| Única | 8/9 (88,9%) | 50/60 (83,3%) |
| Doble | 1/9 (11,1%) | 10/60 (16,7%) |
| Triple | 0 | 0 |
| Abortos | 3/9 (33,3%) | 11/60 (18,3%) |
| Gestación evolutiva/criotransferencia | 6/32 (18,8%) | 49/201 (24,4%) |
| Única | 6/6 (100%) | 44/49 (89,8%) |
| Doble | 0 | 5/49 (10,2%) |
| Triple | 0 | 0 |
| Live Birth Ratio/criotransferencia | 6/32 (18,8%) | 49/201 (29,9%) |
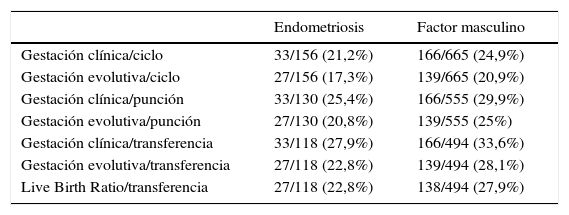
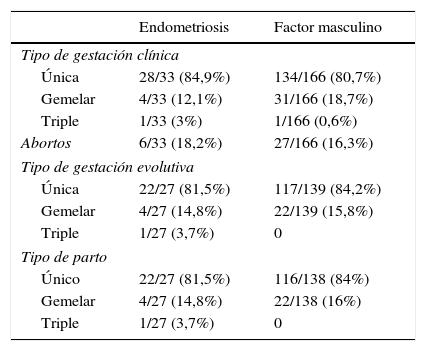
La tabla 4 se centra en las distintas tasas de gestación, profundizándose en la tabla 5 en la evolución de dichos embarazos y posteriores partos. A pesar de hallarse una tendencia a cifras superiores en las tasas de gestación tanto clínica como evolutiva en el grupo de factor masculino, estas diferencias no fueron estadísticamente significativas. Tampoco lo fueron las diferencias en el tipo de gestación.
Tasa de gestación y Live Birth Ratio en los grupos de estudio
| Endometriosis | Factor masculino | |
|---|---|---|
| Gestación clínica/ciclo | 33/156 (21,2%) | 166/665 (24,9%) |
| Gestación evolutiva/ciclo | 27/156 (17,3%) | 139/665 (20,9%) |
| Gestación clínica/punción | 33/130 (25,4%) | 166/555 (29,9%) |
| Gestación evolutiva/punción | 27/130 (20,8%) | 139/555 (25%) |
| Gestación clínica/transferencia | 33/118 (27,9%) | 166/494 (33,6%) |
| Gestación evolutiva/transferencia | 27/118 (22,8%) | 139/494 (28,1%) |
| Live Birth Ratio/transferencia | 27/118 (22,8%) | 138/494 (27,9%) |
Evolución y tipo de gestación en los grupos de estudio
| Endometriosis | Factor masculino | |
|---|---|---|
| Tipo de gestación clínica | ||
| Única | 28/33 (84,9%) | 134/166 (80,7%) |
| Gemelar | 4/33 (12,1%) | 31/166 (18,7%) |
| Triple | 1/33 (3%) | 1/166 (0,6%) |
| Abortos | 6/33 (18,2%) | 27/166 (16,3%) |
| Tipo de gestación evolutiva | ||
| Única | 22/27 (81,5%) | 117/139 (84,2%) |
| Gemelar | 4/27 (14,8%) | 22/139 (15,8%) |
| Triple | 1/27 (3,7%) | 0 |
| Tipo de parto | ||
| Único | 22/27 (81,5%) | 116/138 (84%) |
| Gemelar | 4/27 (14,8%) | 22/138 (16%) |
| Triple | 1/27 (3,7%) | 0 |
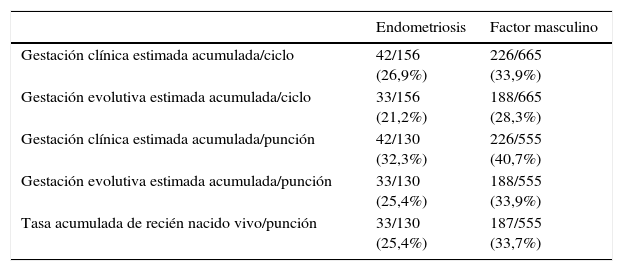
Por último, la tabla 6 profundiza en la variable primaria del estudio, la gestación estimada acumulada. Los resultados conseguidos no fueron estadísticamente significativos, aunque cabe mencionar una tendencia a tasas de gestación superiores en el grupo de factor masculino en todos los apartados, destacando tanto la gestación evolutiva estimada acumulada por ciclo como la clínica por punción, con diferencias a favor del factor masculino, con un valor p de 0,07 en ambos casos.
Tasa de gestación estimada acumulada en los grupos de estudio
| Endometriosis | Factor masculino | |
|---|---|---|
| Gestación clínica estimada acumulada/ciclo | 42/156 (26,9%) | 226/665 (33,9%) |
| Gestación evolutiva estimada acumulada/ciclo | 33/156 (21,2%) | 188/665 (28,3%) |
| Gestación clínica estimada acumulada/punción | 42/130 (32,3%) | 226/555 (40,7%) |
| Gestación evolutiva estimada acumulada/punción | 33/130 (25,4%) | 188/555 (33,9%) |
| Tasa acumulada de recién nacido vivo/punción | 33/130 (25,4%) | 187/555 (33,7%) |
Nuestro estudio demuestra que la endometriosis afecta la reserva ovárica y, por tanto, la capacidad de responder a los tratamientos de estimulación de la ovulación. Este hecho queda demostrado por nuestro hallazgo de que a pesar de usar dosis significativamente mayores de gonadotropinas en pacientes endometriósicas sometidas a estimulación de la ovulación, se obtuvo en este grupo un 30% menos de ovocitos, así como un porcentaje de punciones con obtención de 3 o menos ovocitos significativamente superior al grupo del factor masculino. Estos resultados concuerdan con lo observado por otros autores (Kennedy et al., 2005; Barnhart et al., 2002), que hallaron una reducción en el número de ovocitos obtenidos en estas pacientes tras estimulación de la ovulación en comparación con mujeres con esterilidad tubárica. Sin embargo, discrepan de lo observado por Opoien et al. (2012), que no hallaron diferencias significativas en el número de ovocitos obtenidos al comparar resultados en FIV/ICSI en endometriósicas y en mujeres infértiles debido a factor tubárico. Estas discrepancias podrían deberse al porcentaje de pacientes con cirugía ovárica incluido en los estudios, ya que en mujeres operadas la reserva ovárica puede ser menor y, por tanto, la cantidad de ovocitos obtenida puede verse reducida (Mostaejeran et al., 2015). Descartamos esta posibilidad, pues el porcentaje de mujeres intervenidas en nuestro trabajo fue menor que en el estudio de Opoien (39% vs 78%). Sin embargo, y en línea con nuestros resultados, existe otro metaanálisis, llevado a cabo por Tsoumpou et al. (2009), que asevera que la cirugía del endometrioma no provoca ningún efecto adverso en la posterior estimulación ovárica, más allá del provocado por la endometriosis en sí misma.
Ante resultados tan dispares, Yang et al. (2015) han elaborado un metaanálisis para comparar la respuesta ovárica y los resultados en técnicas de FIV/ICSI en pacientes con y sin endometrioma, excluyendo aquellos estudios en los que se hubieran incluido pacientes intervenidas previamente de endometriosis para evitar posibles sesgos. Los resultados demostraron que en pacientes con endometriomas se obtenía menor número de ovocitos y de embriones, sin que esto repercutiera en las posteriores tasas de gestación. Estos datos van en consonancia con los obtenidos en nuestro estudio, y sugieren que esta menor cantidad de ovocitos obtenidos pudiera deberse a factores como cambios en diversos factores autoinmunes, acumulación de interleucina-6, distorsión de la vascularización de la corteza ovárica en presencia de endometriomas, etc. Sin embargo, los autores recomiendan la necesidad de más estudios aleatorizados al respecto, con mayor tamaño muestral, así como llevarlos a cabo con endometriomas de tamaño similar en los distintos grupos, puesto que en muchos de los resultados obtenidos existía una gran heterogeneidad entre los estudios que reducen la calidad de la evidencia científica obtenida.
Las diferencias encontradas en nuestro estudio en el protocolo de inducción empleado en los 2 grupos se deben a que la literatura apoya claramente el empleo del análogo superlargo previo a la FIV/ICSI en pacientes con endometriosis (Sallam et al., 2006), puesto que mejora de forma estadísticamente significativa las tasas de gestación en estas pacientes. Este beneficio parece deberse al ambiente endocrino similar al hipogonadismo hipogonadotrófico que se consigue con este protocolo de 3-6meses. También a los efectos de los análogos de la GnRH sobre la expresión de la aromatasa (disminuye su expresión, reduciendo la transformación de androstendiona a estrona en el epitelio ectópico), o sobre las células NK del útero, cuya función citotóxica se haya afectada en pacientes con endometriosis (Kohls, 2011).
A pesar de la menor reserva ovárica comentada en las pacientes con endometriosis, los ovocitos obtenidos no parecen ser de peor calidad, pues, como era de esperar bajo esta hipótesis, la tasa de fecundación observada en parejas con endometriosis fue mayor que en parejas estériles por factor masculino, ya que ante un número determinado de ovocitos teóricamente de buena calidad, fecundan más aquellos a los que se ofrece un semen de mejor calidad, como es el caso de las parejas estériles por endometriosis. Otros autores han observado también la adecuada calidad ovocitaria en pacientes endometriósicas (Filippi et al., 2014; Reinblatt et al., 2011). En contra de estas hipótesis, un estudio llevado a cabo por Simón et al. (1994) demostró que los embriones procedentes de ovocitos de donantes con endometriosis tenía una menor tasa de implantación que embriones procedentes de ovocitos de donantes sin endometriosis. Este estudio fue uno de los incluidos en el metaanálisis ya citado llevado a cabo por Barnhart et al. (2002).
Al existir un menor número de ovocitos en pacientes con endometriosis y fecundarse un mayor porcentaje, el porcentaje de embriones transferidos resulta significativamente mayor a pesar de no haber diferencias en el número medio de embriones transferidos. Por el mismo motivo, el porcentaje de embriones útiles es significativamente mayor en el grupo de endometriosis. A pesar de este mayor rendimiento de la cohorte ovocitaria obtenida en pacientes endometriósicas, la menor dotación de ovocitos obtenida hace que el porcentaje de embriones que se criopreserva sea significativamente menor en estas pacientes, siendo en consecuencia menor la tasa de punciones en estas mujeres en las que al menos uno de los embriones que no se transfieren en fresco se congela.
No hallamos diferencias significativas en la tasa de implantación. Esto va en discordancia con lo que algunos estudios afirman, al atribuir gran parte del descenso de la fertilidad en pacientes con endometriosis a una alteración a nivel endometrial (Dong et al., 2013). Sin embargo, parece que el endometrio de mujeres endometriósicas no se encuentra afectado. Estos hallazgos quedan corroborados por estudios clínicos en programas de donación de ovocitos, donde mujeres con endometriosis incluidas en estos programas por baja respuesta a la estimulación de la ovulación presentan tasas de implantación y gestación similares a las de otras pacientes receptoras de ovocitos (Remohí et al., 1997; Navarro et al., 2003; Sung et al., 1997), lo cual va en la línea de los resultados obtenidos en nuestro estudio.
Las tasas de gestación y de nacido vivo en los grupos de estudio, así como las tasas de gestación y nacido vivo estimada acumulada, son mayores en el grupo factor masculino que en grupo de endometriosis, sin que los resultados lleguen a ser estadísticamente significativos. Sin embargo, la diferencia apreciada en la gestación y la tasa de recién nacido estimada acumulada entre ambos grupos es mayor que en las tasas de los ciclos en fresco, obteniéndose cifras muy cercanas a la significación estadística (p=0,07 y p=0,09, respectivamente). Esto se debe a que, como hemos dicho antes, en el factor masculino se ha criopreservado más, posteriormente se han descongelado más embriones, y esto trae como consecuencia un aumento en las tasas de gestación y de nacido vivo acumuladas mayor que en el grupo de endometriosis. Estos datos nos llevan a concluir que probablemente, si obtuviéramos con posterioridad los datos de gestación real acumulada (al añadir la evolución del resto de criopreservaciones no descongeladas aún), las diferencias en las tasas de gestación acumulada entre ambos grupos serían estadísticamente significativas.
Entre las fortalezas de nuestro estudio se encuentra que la variable primaria es nacido vivo acumulado, ya que actualmente, y ante la difusión de políticas «freeze all», las variable habituales para valorar la eficacia de los tratamientos de FIV, como tasa de embarazo por ciclo, pierden validez. Nuestro trabajo es uno de los escasos estudios que utilizan esta variable, aunque ello haya supuesto una demora en la obtención de resultados válidos. Entre las limitaciones de nuestro estudio se encuentra el ser retrospectivo; el no disponer de los valores de hormona antimulleriana (AMH), lo que nos ha impedido determinar según los criterios de Bolonia (Ferraretti et al., 2011) el porcentaje de pacientes con baja respuesta ovárica; y por último, el no poder contar con el resultado de todos los embriones crioconservados para calcular la verdadera tasa acumulada de gestación por ciclo.
En resumen, la endometriosis afecta al éxito de la FIV/ICSI por reducir la respuesta ovárica a la estimulación de la ovulación, no estando afectada ni la calidad ovocitaria ni la receptividad endometrial. Creemos necesario profundizar en los factores que causan dicha disminución en la reserva ovárica, como cirugía previa, extensión de la enfermedad o tratamientos farmacológicos previos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses