El término displasia cortical focal (DCF) expresa una patología muy particular de trastorno de la migración que conlleva una sintomatología caracterizada principalmente por crisis epilépticas fármaco-resistentes, unas imágenes neurorradiológicas y unas características histológicas peculiares, así como una respuesta al tratamiento quirúrgico muy positiva en la mayoría de los casos.
Material y métodosSe estudia a 7 pacientes, 6 niños con edad promedio de 34,3 meses y un varón de 25 años con crisis focales muy rebeldes e imágenes de RM que mostraban DCF.
ResultadosTres de los pacientes (todas niñas) fueron operadas en edades muy tempranas, con extirpación de la DCF y la zona circundante, demostrando el estudio anatómico la concordancia de las imágenes de RM con las macroscópicas de los cortes anatómicos. El estudio histológico mostró los típicos hallazgos de la DCF tipo Taylor (mala delimitación entre sustancia gris cortical y la sustancia blanca subcortical, y «células balonadas»). Tres años después de la resección de la DCF los 3 pacientes estaban curados de las crisis y sin medicación antiepiléptica. Dos de los pacientes están controlados de las crisis con medicación, otro (el adulto) está en espera de decisión quirúrgica y el restante desechó la operación.
ConclusiónLa DCF tipo Taylor es una patología asociada a una buena parte de las crisis focales fármaco-resistentes, que debe tratarse de identificar y de extirpar lo antes posible ya que la cirugía, bien proyectada y realizada, sin dejar residuos displásicos, puede curarla en un alto porcentaje de casos.
The term focal cortical dysplasia (FCD) describes a particular migration disorder with a symptomatology mainly characterised by drug-resistant epileptic seizures, typical neuroradiological images, and histological characteristics, as well as a very positive response to surgical treatment in the majority of cases.
Material and methodsA total of 7 patients were studied, comprising 6 children with a mean age of 34.3 months and one 25-year-old male with very persistent focal seizures and MRI images that showed FCD.
ResultsThree of the patients (all girls) were operated on while very young, with extirpation of the FCD and the surrounding area; with the histopathology study showed agreement between the MRI images and the macroscopic study of the slices. The histology study showed findings typical of a Taylor-type FCD (poor differentiation between the cortical grey matter and the subcortical white matter, and balloon cells). Three years after the FCD extirpation, the same 3 patients remained seizure-free with no anti-epilepsy medication. Two others have seizure control with medication, another (the adult) is on the surgical waiting list, and the remaining patient refused the operation.
ConclusionTaylor-type FCD is associated with a high percentage of all drug-resistant focal seizures, and it needs to be identified and extirpated as soon as possible. Well planned and well-performed surgery that leaves no remains of dysplasia can cure the disease it in many cases.
El término displasia cortical focal (DCF) fue aplicado primeramente a las anormalidades histológicas corticales encontradas en las piezas cerebrales extirpadas a sujetos con epilepsias resistentes a las medicaciones antiepilépticas1-3. Las lesiones son descritas histológicamente como un conjunto de neuronas grandes y bizarras, y células grotescas en algunos casos, localizadas en las zonas profundas del córtex y en la sustancia blanca subyacente. La severidad de la DCF está relacionada con su localización, su morfología grosera y sus características histológicas. El tipo menos severo de DCF es conocido como «microdisgenesia», que algunas veces es indetectable en las imágenes neurorradiológicas. Las lesiones son más comúnmente encontradas en autopsias de pacientes con epilepsia y últimamente, en que ya se dispone de medios diagnósticos por imagen de gran sensibilidad, también en piezas epileptógenas operatorias. La extensión de la DCF puede ser variable, comprendiendo desde áreas que se extienden por parte de una circunvolución hasta afectar a todo un lóbulo. Cuando abarcan a un hemisferio o partes de ambos hemisferios, suelen constituir lo que se conoce como DC gigante (DCG). En los últimos años se está imponiendo el término de displasias corticales focales4,5, disgenesias corticales6 o el término genérico de alteraciones de la migración neuronal7,8. El término DCF puede incluir mejor que cualquier otro los cambios histopatológicos de este trastorno en opinión de algunos autores9. En los buscadores de trabajos científicos tipo Pubmed se está observando la inclusión de los tubers (tuberosidades), típicas lesiones de los hemisferios cerebrales —incluso también cerebelosos— concomitantes con el complejo esclerosis tuberosa (CET)10 entre las «displasias corticales-subcorticales» ya que, aunque clínicamente se diferencian por las manifestaciones cutáneas y de otros órganos, mostradas por las personas con CET, el tipo de imagen en la RM y de las características histológicas pueden ser muy similares en muchos casos de DCF y de CET.
Los principales síntomas clínicos causados por las DCF son epilepsia, déficits neurológicos focales, problemas intelectuales, retraso en el desarrollo de las facetas cognitivas o bien deterioro de las mismas. Las crisis, en la mayoría de los casos de tipo focal, al menos primariamente, pueden comenzar a cualquier edad desde la época intrauterina y presentarse a lo largo de la vida, aunque más comúnmente durante la niñez. Pueden ser parciales simples, parciales complejas y generalizadas, dependiendo de la localización de la DCF y de la edad del paciente. La DCF ha sido reconocida de forma cada vez más frecuente como causa de la epilepsia. La lesión concomitante de la DCF es rara vez visible por tomografía computarizada (TC), al menos con aparatos antiguos, pero la resonancia magnética (RM) de alta resolución y con algunas de sus secuencias específicas11-20 muestra comúnmente las lesiones córtico-subcorticales que muy frecuentemente. y especialmente cuando tienen cierto tamaño, van asociadas a la hipoplasia del hemisferio cerebral en el que se localiza la lesión. El diagnóstico temprano de estas malformaciones corticales hace que se tome la decisión de extirparlas quirúrgicamente lo antes posible para evitar las consecuencias presentes y futuras que la repetición cronificada de las crisis tiene para los pacientes.
A lo largo de los últimos años parece que se han alcanzado altas cotas de perfección en el diagnóstico por imagen lo que permite la identificación intraoperatoria del tejido cortical disgenésico o displásico epileptógeno y su resección con precisión al objeto de conseguir un mejor control de las crisis20,21 sin añadir tamaño a la lesión anatómica.
Material y métodosDesde que se realizan sistemáticamente estudios por RM con aparatos de 1,5 y 3T en pacientes con crisis epilépticas focales, hecho que ha coincidido con la puesta en marcha de programas de tratamiento quirúrgico de las epilepsias, especialmente en pacientes con DCF, hemos estudiado a 7 pacientes con DCF que mostraban resistencia al tratamiento con medicación antiepiléptica en el Servicio de Neurología Pediátrica del Hospital Universitario La Paz de Madrid. Desde aproximadamente 1990, se han podido identificar más de 150 casos con algún tipo de alteración de la migración neuronal y de la organización cortical, cuyas entidades han sido encuadradas en los tipos expresados principalmente en las diferentes clasificaciones de imagen2,7,9,10,13,15-17. Se ha intentado identificar las diferentes entidades mediante los estudios de RM con todas las secuencias que hemos tenido a nuestro alcance, tales como T1, T2, aplicación de contrastes, inversión recuperación (FLAIR), densidad protónica, tridimensional (RM3D), difusión (especialmente en vista axial) reconstrucción cortical y ocasionalmente RM espectroscópica (esta técnica solo cuando quería obtenerse algún dato que pudiera diferenciar una malformación de un tumor). También se han realizado estudios funcionales (SPECT y PET, principalmente) en algunos casos. La selección de los pacientes se ha hecho en base a la existencia de crisis focales resistentes a las medicaciones antiepilépticas específicas administradas en sus formas de medicación única y bimedicación, e incluso de trimedicación en algún caso durante un periodo lo suficientemente largo y en dosis lo suficientemente elevadas como para considerar su eficacia o no en el control de las crisis, la presencia de actividad focal epileptógena, que no cambiaba de lugar en el cerebro en los varios estudios de EEG practicados a lo largo del tiempo en que se intentó el control de las crisis epilépticas y la presencia de imagen de displasia cortical mostrada en los diferentes estudios de neuroimagen. También se tuvo en cuenta la edad y, por ello, 6 de los 7 pacientes son niños y sólo uno es adulto joven, pero con comienzo de la epilepsia en la niñez. No se han incluido casos con CET.
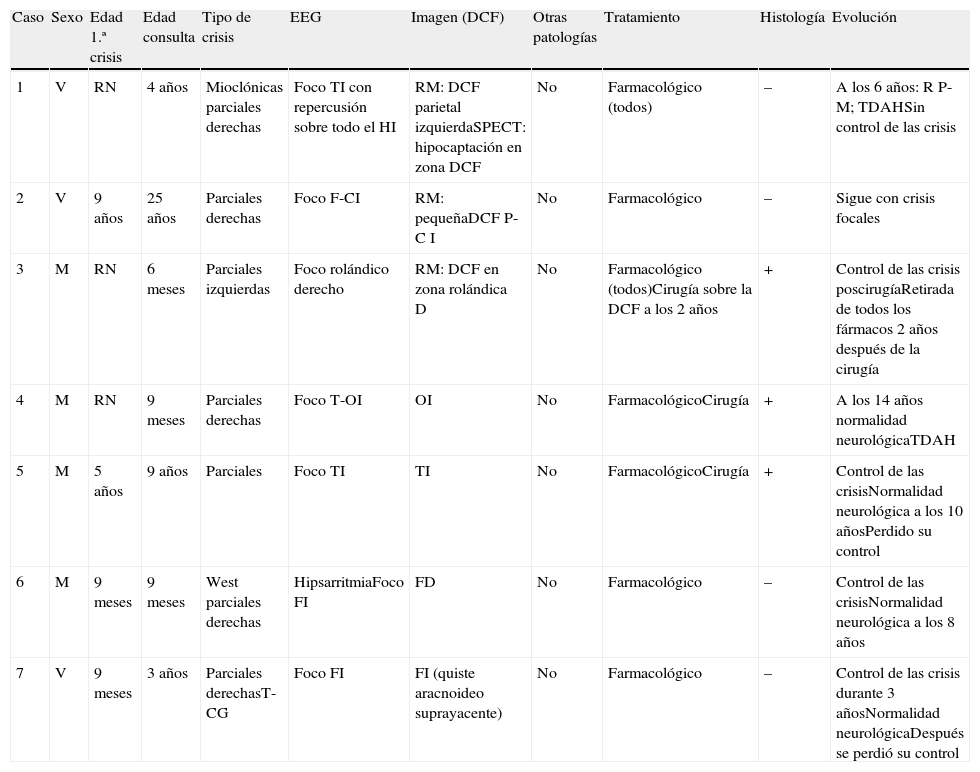
ResultadosEl presente trabajo está centrado exclusivamente en 7 pacientes, 6 niños (2V y 4M) de edades comprendidas entre 6 meses y 9 años (promedio 34,3 meses) y un adulto de 25 años (tabla 1) en los que los estudios de imagen pusieron en evidencia la existencia de DCF. El comienzo de las crisis tuvo lugar durante el primer año de la vida en 5 pacientes, mientras que en el adulto comenzaron a los 9 años y en uno de los niños a los 5 años.
Displasias corticales focales (DCF)
| Caso | Sexo | Edad 1.ª crisis | Edad consulta | Tipo de crisis | EEG | Imagen (DCF) | Otras patologías | Tratamiento | Histología | Evolución |
| 1 | V | RN | 4 años | Mioclónicas parciales derechas | Foco TI con repercusión sobre todo el HI | RM: DCF parietal izquierdaSPECT: hipocaptación en zona DCF | No | Farmacológico (todos) | – | A los 6 años: R P-M; TDAHSin control de las crisis |
| 2 | V | 9 años | 25 años | Parciales derechas | Foco F-CI | RM: pequeñaDCF P-C I | No | Farmacológico | – | Sigue con crisis focales |
| 3 | M | RN | 6 meses | Parciales izquierdas | Foco rolándico derecho | RM: DCF en zona rolándica D | No | Farmacológico (todos)Cirugía sobre la DCF a los 2 años | + | Control de las crisis poscirugíaRetirada de todos los fármacos 2 años después de la cirugía |
| 4 | M | RN | 9 meses | Parciales derechas | Foco T-OI | OI | No | FarmacológicoCirugía | + | A los 14 años normalidad neurológicaTDAH |
| 5 | M | 5 años | 9 años | Parciales | Foco TI | TI | No | FarmacológicoCirugía | + | Control de las crisisNormalidad neurológica a los 10 añosPerdido su control |
| 6 | M | 9 meses | 9 meses | West parciales derechas | HipsarritmiaFoco FI | FD | No | Farmacológico | – | Control de las crisisNormalidad neurológica a los 8 años |
| 7 | V | 9 meses | 3 años | Parciales derechasT-CG | Foco FI | FI (quiste aracnoideo suprayacente) | No | Farmacológico | – | Control de las crisis durante 3 añosNormalidad neurológicaDespués se perdió su control |
D: derecho; DCF: distrofia cortical focal; F: frontal; I: izquierdo; M: mujer; O: occipital; P: parietal; P-C: parieto-central; RN: recién nacido; RP-M: retraso psicomotor; T: temporal; T-CG: tónico-clónicas generalizadas; TDAH: trastorno por déficit de atención/hiperactividad; V: varón.
El signo clínico común a todos los casos era la presencia de crisis focales en diferente expresión clínica, predominando los movimientos mioclónicos en una zona restringida del cuerpo (labios, una extremidad superior o inferior), que en algunos casos duraban poco y solo ocasionalmente se propagaban a todo el hemicuerpo sin generalizarse, sin perder conciencia y durando solo unos segundos, para cesar sin medicación antiepilépica, como ocurría en el único paciente adulto (caso 2). Otras veces evolucionaba hacia espasmos en flexión con inicio por crisis focales, como ocurrió en el caso 6 al que la administración simplemente de medicación antiepiléptica (Keppra) hizo que cedieran los espasmos en flexión, se corrigiera el tipo de trazado de hipsarritmia en el EEG y se controlaran las crisis focales, sin haberse vuelto a repetir tras 8 años de tratamiento, aunque persista foco originado en la zona displásica, si bien con evolución neurológica normal. El caso 7 presentaba displasia focal frontal subyacente a un quiste aracnoideo, con crisis focales que se controlaron bien con medicación antiepiléptica, habiéndose perdido su control en los últimos años.
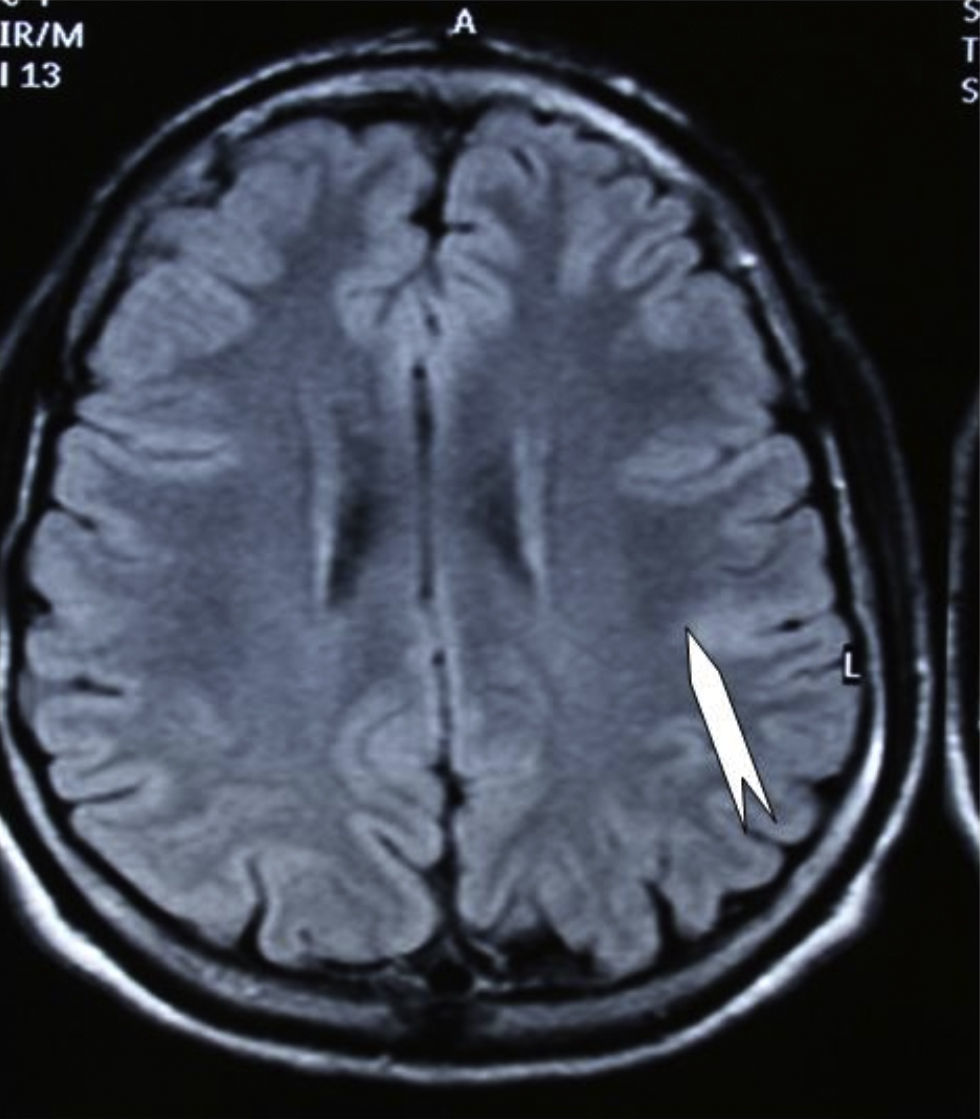
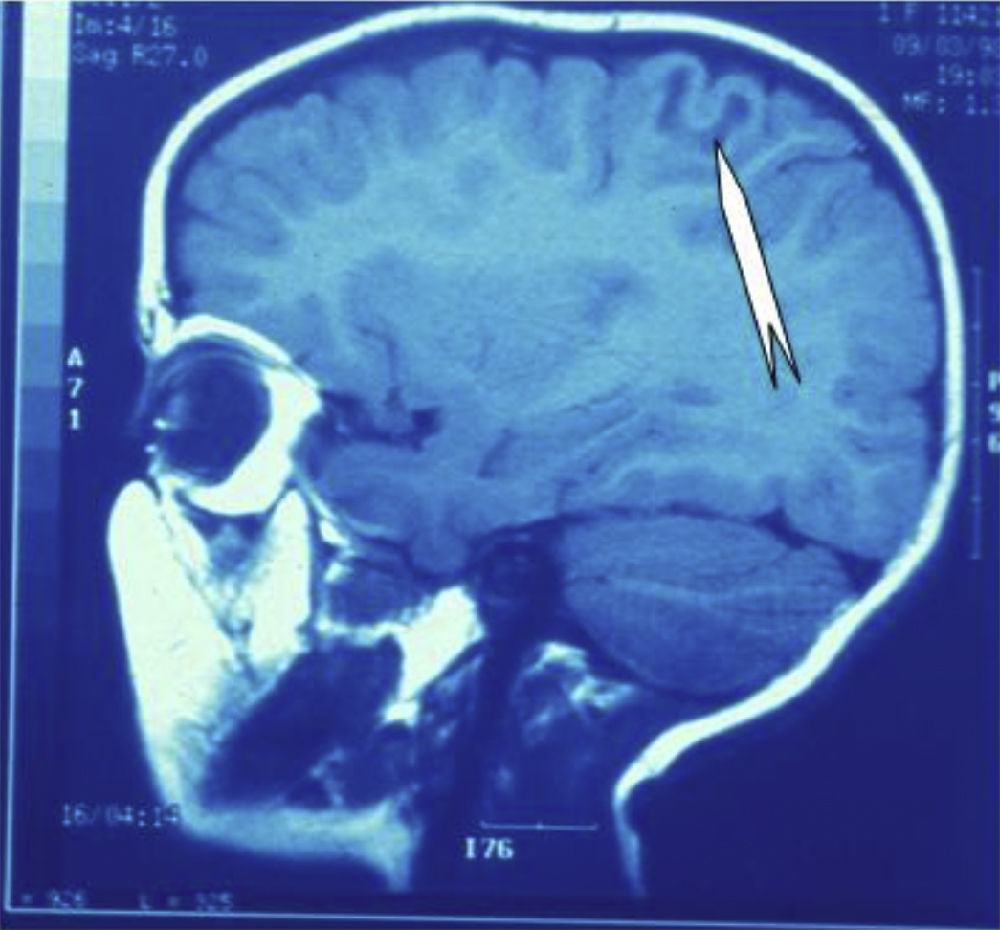
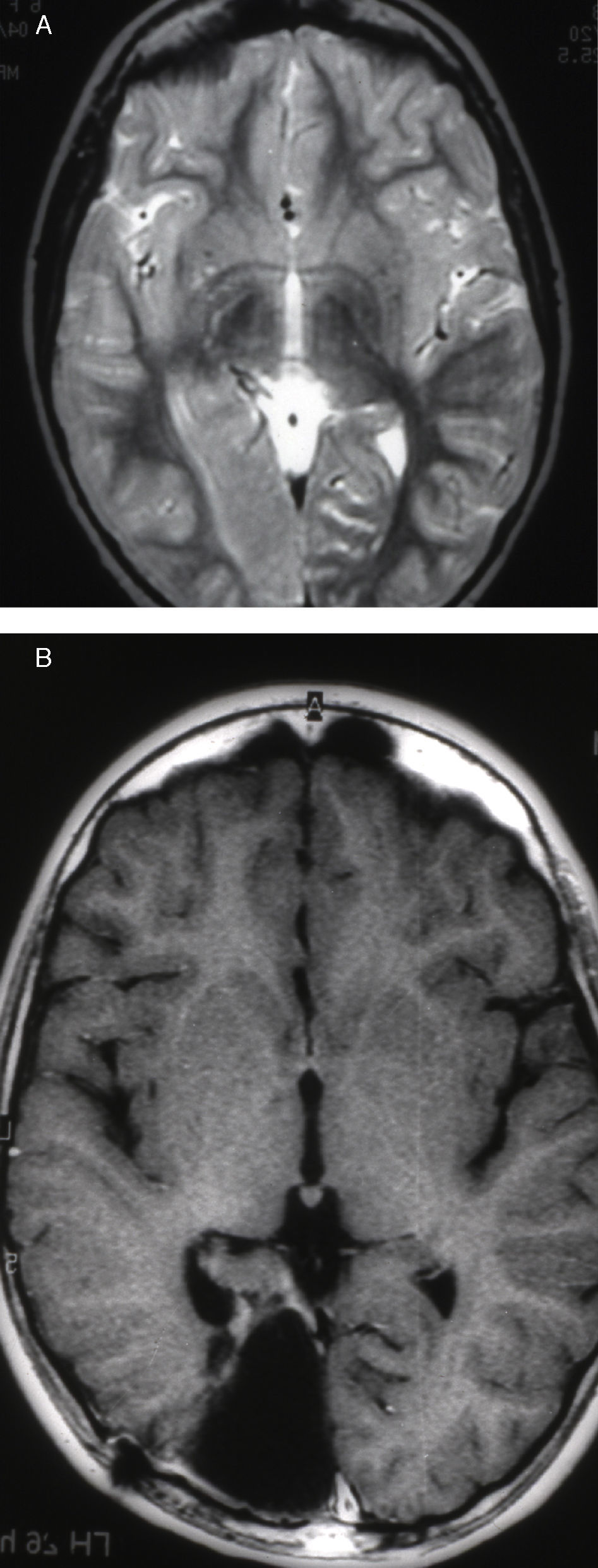
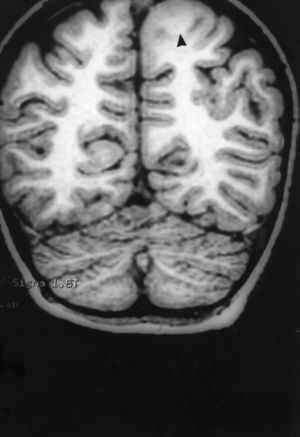
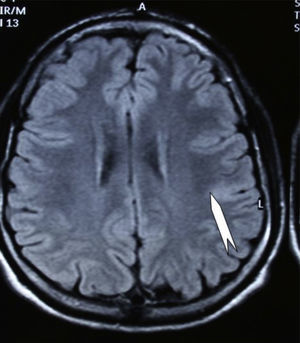
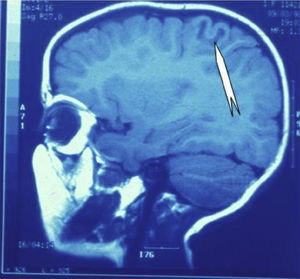
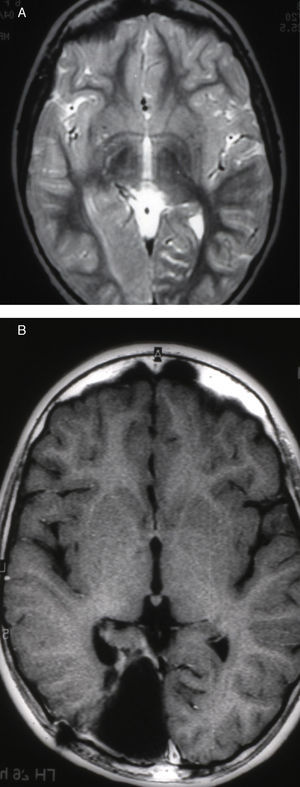
Las crisis se presentaban preferentemente durante el sueño en dos pacientes, durante la vigilia en 3 y tanto en vigilia como en sueño en 2. En los casos 3, 4 y 5 existían DCF bien delimitadas y propicias para la cirugía, que fueron totalmente resecadas. En los casos 3 y 4 las crisis parciales con generalización secundaria que presentaban desaparecieron totalmente, manteniéndose durante dos años la medicación antiepiléptica que previamente tomaban. Al cabo de este tiempo se comenzó a retirar la medicación hasta tenerla suspendida totalmente a los 3 años de aplicar la cirugía, no habiéndose repetido las crisis en los más de 10 años transcurridos desde entonces. En el caso 5, las crisis se controlaban tras la resección de la DCF y así continuó mientras estuvo bajo nuestro control, que se perdió a los 3 años del tratamiento quirúrgico. En el caso 1, que presentaba una DCF de mediano tamaño (fig. 1), pero muy activa y con mala respuesta a todos los tipos de medicación antiepiléptica y a las diversas combinaciones de fármacos, la familia no aceptó el tratamiento quirúrgico y, a los 6 años, cuando se perdió su control, el niño presentaba moderado retraso psicomotor, personalidad inquieta y las crisis sin controlar. El caso 2, un varón de 25 años, con carrera universitaria, presenta 1-2 cortas crisis rolándicas diarias durante el sueño, en las que no pierde la consciencia ni se despierta, con control parcial con topiramato, pero sin lograr el control total con ninguna de las pautas de tratamiento farmacológico aplicadas. Presenta una DCF de pequeño tamaño en zona rolándica (fig. 2) y está en periodo de espera de tratamiento quirúrgico. El caso 6, también con una DCF frontal de pequeño tamaño, lleva 8 años con las crisis controladas con medicación antiepiléptica, focalidad en el EEG y con normalidad neurológica. La DCF muestra unas imágenes delimitadas en la RM con buena captación del contraste paramagnético que delimitan bien el tamaño de la DCF (figs. 3 y 4).
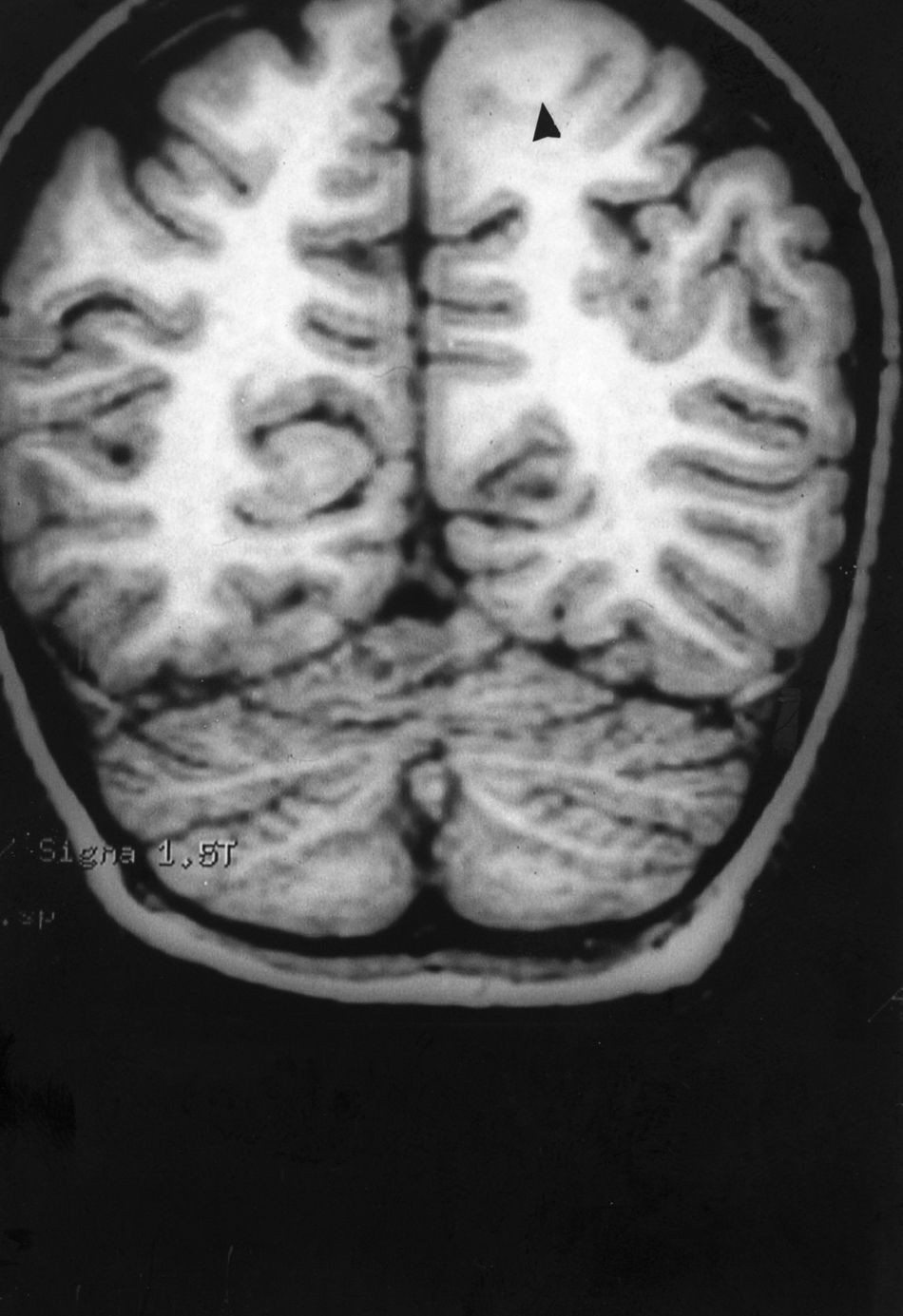
Caso 1. Corte coronal de la RM3D. Se observa una DCF de mediano tamaño en la zona parasagital de la región parietal posterior izquierda (punta de flecha). Se evidencia el abultamiento de la DCF, la pérdida de la imagen de sustancia gris cortical, la falta de delimitación entre corteza y sustancia blanca subcortical y los cambios de señal en el interior de la DCF.
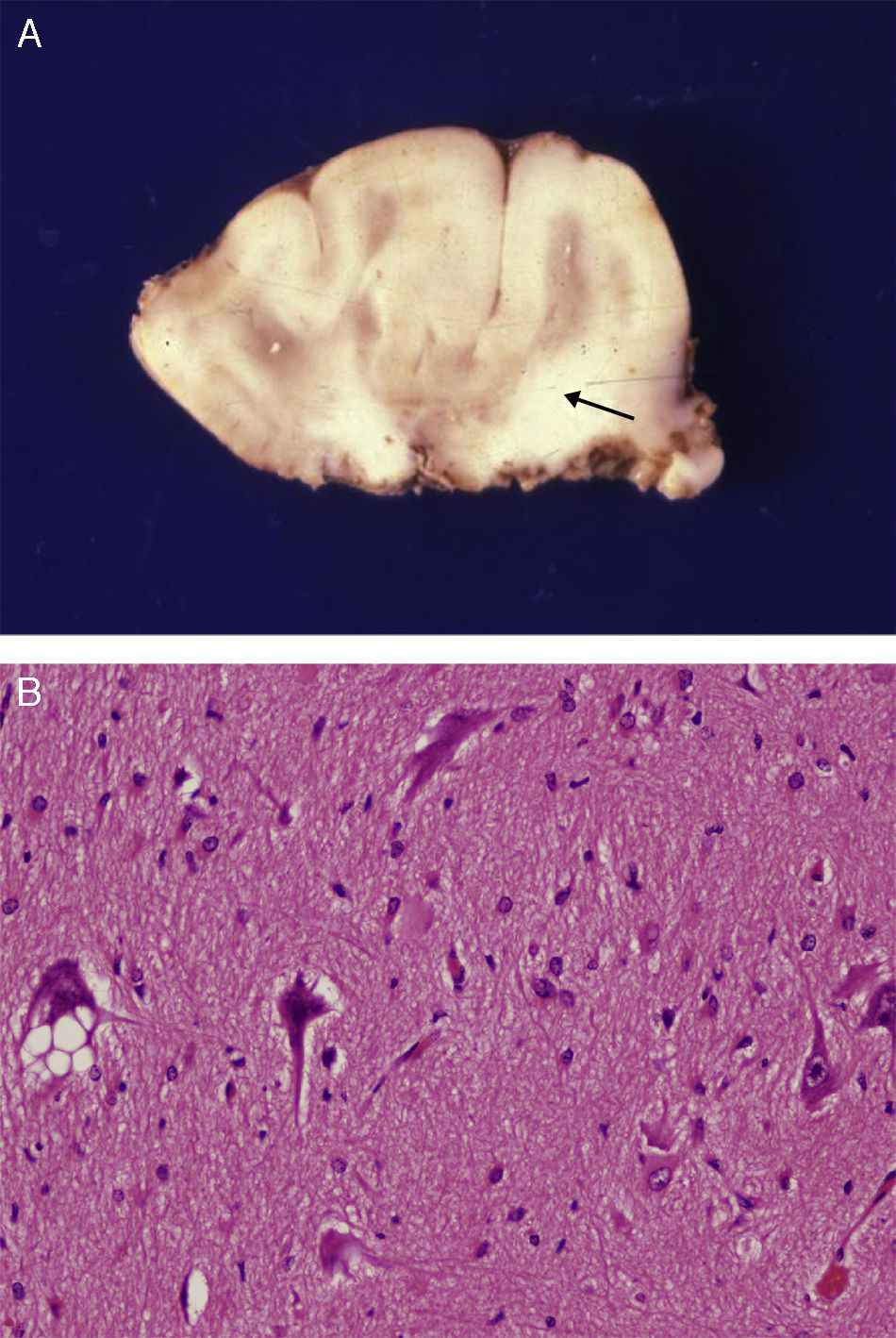
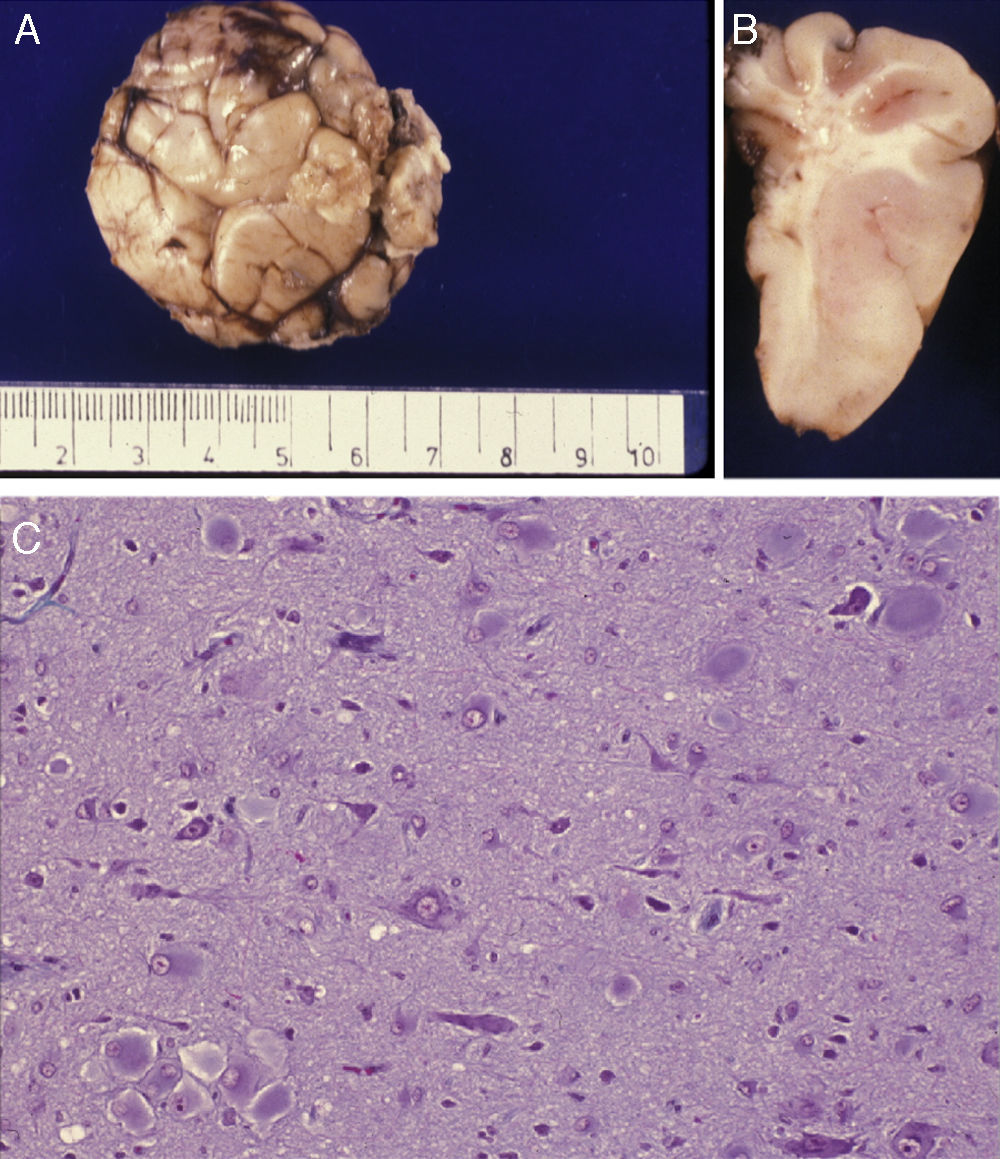
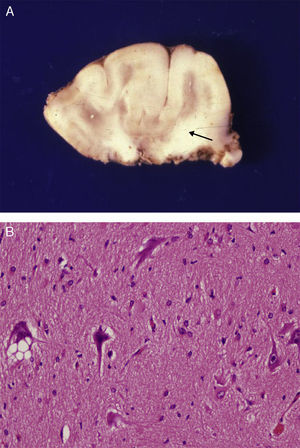
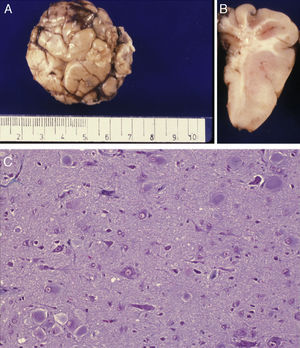
Estudio anatómico-histológico de la pieza operatoria del mismo paciente. A) Pieza de resección neuroquirúrgica. En la corteza se observan variaciones de su espesor y en la sustancia blanca existen áreas de desmielinización subcortical que dibujan la imagen en U que aparecía en la RM (flecha). B) Estudio histológico de la corteza cerebral, que muestra alteraciones de su estructura con presencia de neuronas dismórficas y mal orientadas y gliosis reactiva. HE 200x.
La correlación entre las imágenes neurorradiológicas, que correspondían a DCF y la apariencia anatómica de la pieza extirpada en la resección operatoria era alta (figs. 5 y 6). La RM mostraba localmente cambios de la señal cortical-subcortical, generalmente de pequeño o mediano tamaño, con mala delimitación de las zonas correspondientes a la sustancia gris cortical y a la sustancia blanca subcortical. Las piezas operatorias de los 3 casos tratados quirúrgicamente presentaban respectivamente unas dimensiones de 5×3×2,8cm y peso de 20 g (caso 3), 5,5×5×2,5cm y peso de 33 g (caso 4) y 6×3×2 nn (caso 5). En alguna de estas piezas operatorias puede reconocerse al menos una circunvolución de mayor tamaño que las otras y con aumento de la consistencia a la palpación. En los cortes seriados se reconoce en esta circunvolución abultada la pérdida de diferenciación entre corteza y sustancia blanca condicionada por el engrosamiento de la corteza cerebral que llega a ofrecer un espesor máximo de 1cm. Solo en algún punto el límite con sustancia blanca es impreciso. Las descripciones histológicas de estas piezas anatómicas de los 3 pacientes son muy similares y podemos describirlas en las características que resumiremos seguidamente. El hecho más destacable es la presencia de elementos neuronales de gran tamaño, que aparecen agrupados con carácter multifocal, determinando una pérdida del patrón en la estructura laminar cortical normal. Estas neuronas muestran variaciones morfológicas de su citoplasma, mostrando con frecuencia signos de cromatolisis. También se observan irregularidades en su disposición. Además se observan otros elementos celulares de gran tamaño con núcleos globoides de histogénesis astroglial. Unos y otros se observan heterotópicamente de forma aislada o formando nidos en la sustancia blanca. También resulta llamativa su presencia en la capa molecular de la corteza, donde se observa una nítida gliosis marginal. La sustancia blanca contigua a la alteración cortical descrita, justifica el engrosamiento de las circunvoluciones anómalas que se observan macroscópicamente.
Estudio anatómico-histológico de la pieza operatoria del mismo paciente de la figura 5. A) Aspecto externo de la pieza extirpada que muestra gran deformidad de las circunvoluciones y surcos. B) Corte lateral de la pieza extirpada en el que se ve engrosamiento irregular de la corteza con sustancia blanca bien mielinizada. C) Preparación histológica en la que se aprecia la presencia de células balonizadas aisladas o agrupadas en la corteza cerebral. Tricrómico de Masson 200x.
La cirugía sirvió para el control definitivo de las crisis en los tres casos operados (2 años, con la ayuda de medicación antiepiléptica y después sin tratamiento farmacológico).
DiscusiónLas malformaciones corticales, causantes frecuentemente de epilepsias fármaco-resistentes, han sido descritas bajo varios nombres, especialmente con el genérico de «displasias corticales», que se utiliza generalmente cuando se describen casos de malformaciones del desarrollo cortical que incluyen heterotopias y polimicrogiria, y el de DCF. El tipo de DCF más conocido es el descrito por Taylor1, que se caracteriza por la presencia de células globoides (balloon cells). Por ello, este tipo de anormalidad cortical es conocido como DCF tipo Taylor o DCF tipo balloon cell. Siempre en relación con las alteraciones histológicas corticales encontradas en cerebros de casos con epilepsia rebelde que han sido tratados quirúrgicamente, se han descrito diversos tipos y subtipos de DCF, cada una de las cuales están diferenciadas de las otras por algunas peculiaridades histológicas, correspondiendo la DCF tipo II a la DCF tipo Taylor21. Los niños con DCF tipo Taylor tienen en común un comienzo muy temprano, epilepsia rebelde con comorbilidad neurológica leve, que responde bien a la medicación antiepiléptica mientras que los pacientes con el tipo de DCF no asociado a la presencia de «células globoides» tienen un fenotipo más severo22. Las clasificaciones por imagen, descritas por varios autores hace pocos años con el término menos correcto de «malformaciones del desarrollo cortical»2,23-25 son mas generalizadas e incluyen todo tipo de anormalidades formativas de la corteza cerebral, quedando la DCF agrupada en otro tipo de malformaciones con mayores similaridades entre ellas26.
Los dos tipos de DCF —el tipo Taylor y el tipo no-Taylor— pueden ser distinguidos usualmente por las imágenes de RM. Las características más sugestivas del tipo Taylor son ensanchamiento cortical focal, mala definición del límite entre sustancia gris cortical y sustancia blanca subcortical, frecuentemente acuñada hacia el ventrículo17. La localización de la lesión es generalmente extratemporal en la DCF tipo Taylor y temporal en la displasia arquitectural tipo no-Taylor, en la que es frecuente la asociación de esclerosis del hipocampo17. La identificación de algunos tipos de DCF con MR de baja resolución no era fácil y casos de pequeño tamaño podían pasar sin diagnosticar hace algunos años. Ello es difícil que ocurra en la actualidad ya que la secuencia fluido-atenuado inversión recuperación (FLAIR) detecta la mayoría de estas lesiones. No obstante, cabe la posibilidad de que pequeñas lesiones pasen inadvertidas y las lesiones muy amplias sean pobremente delimitadas y, por ello, cuando se tenga la sospecha de DCF, es recomendable utilizar cuantas secuencias se tengan a mano, especialmente la tridimensional 3D- FLAIR, la densidad protónica (DF) y la T2 de alta resolución en los planos transversos15. Con estas técnicas y, si se puede, con un aparato de RM de 3T13 se consigue un mejor conocimiento y seguridad de la existencia de DCF, de su tipo y de su tamaño, y se podrá planificar mejor su resección quirúrgica. A medida que avanzan las técnicas de imagen disminuye el número de casos de epilepsia focal de etiología desconocida y aumentan los éxitos terapéuticos (por vía quirúrgica) sobre los pacientes con crisis fármaco-resistentes. Desde el advenimiento de las nuevas técnicas de imagen se ha visto que entre el 20 y el 25% de los pacientes con epilepsia focal presentan DCF27-29 y el 76% de ellos sufren crisis fármaco-resistentes30. Las diferencias entre los dos tipos de DCF se han podido comprobar no solo por las características histológicas (por presentar o no balloon cells), sino por las características inmunitarias innatas y adaptadas31. Estos hallazgos, sin embargo, no son esenciales para hacer el diagnóstico de DCF, pero permiten posterior caracterización de los tipos de células21. Aunque no todos los pacientes con crisis focales causadas por DCF deben ser operados, ya que hay casos que pueden ser controlados farmacológicamente, al menos durante algunos años, o bien las manifestaciones críticas externas son leves, como algún paciente de nuestra serie, la cirugía es la terapia que ofrece más garantía de futuro para un mayor número de pacientes, especialmente para los que presentan crisis que no responden a tratamiento alguno.
Hasta la llegada de los métodos diagnósticos de alta definición, entre los que se incluyen no solo las varias secuencias de RM, sino también diferentes técnicas funcionales de imagen aportadas por la medicina nuclear y la combinación de diversos métodos, las displasias corticales figuraban en las grandes series entre los trastornos del desarrollo cortical menos frecuentes32. Pero el estudio por imagen e histopatología con mejores medios técnicos, llevados a cabo en pacientes con epilepsia fármaco-resistente en los últimos años20-39 ha hecho que vayan aumentando las posibilidades de detección de lesiones muy pequeñas o bien muy grandes, pero conteniendo zonas no fácilmente identificables, y de poder distinguir asociaciones de anormalidades tipo DCF y de esclerosis mesiales o tumores benignos e incluso la posible asociación de estas lesiones en un mismo paciente. Las imágenes funcionales son fundamentales prequirúrgicamente para elaborar un mapa cortical con vistas a evitar déficits neurológicos postquirúrgicos39, cosa que suele conseguirse casi siempre de acuerdo con los resultados obtenidos en nuestra serie. La potencial capacidad para desencadenar crisis por parte de la DCF está relacionada con anormalidades excitatorias e inhibitorias de la neurotransmisión, de acuerdo a los hallazgos inmunohistoquímicos realizados sobre piezas histológicas provenientes de pacientes con diferentes tipos de crisis40,41.
La incidencia de DCF en las series de cirugía de la epilepsia oscila entre el 12 y el 40%28,42-44, consiguiendo el control de las crisis entre el 63 y el 80%33,34,45,46, estando el 59% de casos libres posquirúrgicamente de crisis en la subvariedad de DCF tipo rolándico en el que se requiere mayor precaución quirúrgica para no causar lesión orgánica que podría dejar secuelas motrices o sensitivas47.
Un factor que predice un pronóstico favorable es la resección completa de la DCF de acuerdo con la definición de la lesión obtenida por las técnicas de neuroimagen y electrocartográficas, siendo el factor más desfavorable y que augura la continuidad de las crisis la resección incompleta de la lesión. El empeoramiento posquirúrgico inmediato de las crisis se puede observar en todas las variedades de DCF y en todas las localizaciones, predominantemente en la de la zona rolándica debido a las mayores dificultades en resecar completamente las lesiones de esta localización. La presentación de estatus epiléptico en periodo inmediato a la resección de la lesión se ha observado entre el 20 y el 37% de los casos2,47,48 con DCF tipo balloon cells de cualquier localización. Se ha sugerido que este hecho puede deberse a un papel inhibitorio de las células globoides contenidas en la DCF que, al ser extirpadas, podrían conducir a una liberación de factores excitatorios contenidos en el tejido circundante de los restos del córtex epileptógeno y el empeoramiento del autocontrol de las crisis47. El desencadenamiento de estatus de mal epiléptico lo hemos observado también inmediatamente después de la extirpación de tuberosidades epileptógenas en dos casos de complejo esclerosis tuberosa (CET) (no incluidos en este trabajo). Ello es lógico si se tiene en cuenta que la estructura histopatológica de los tubers corticales puede ser indistinguible de la que se observa en algunas formas de DCF, mostrando ambas patologías grandes neuronas bizarras, astrocitos atípicos y gliosis fibrilar subpial49.
Queda todavía sin identificarse la etiología de la DCF tipo 1. Hay varios autores que creen que se debe a lesiones exógenas, tales como hipoxia o infecciones durante la gestación o a trauma perinatal50-52, pero su objetivación está por demostrar.
Algunos tipos de secuelas neurológicas son habituales posquirúrgicamente. Entre ellas, disartria, hemi o monoparesia, ciertas deficiencias intelectuales y comportamiento propios del síndrome de déficit de atención/hiperactividad (TDAH), como hemos podido ver en algunos pacientes de nuestra serie.
ConclusiónSe ha seleccionado un grupo de 7 pacientes, que comenzaron a presentar crisis focales durante la infancia, con foco muy activo en el EEG, que no cambiaba con el tiempo, y una imagen de displasia cortical en los estudios de imagen por diversas técnicas de RM. La resección quirúrgica amplia de la displasia condujo al control de las crisis y a la retirada de la medicación antiepiléptica en los tres casos operados. El estudio histológico de las piezas operatorias mostró hallazgos compatibles con DCF tipo Taylor. En dos casos, se consiguió el control de las crisis tras diversos ensayos con tratamiento farmacológico. Un paciente con crisis muy rebeldes se resiste a aceptar el tratamiento quirúrgico y uno, actualmente en edad adulta, sin control de las crisis, pero en buena situación neurológica, espera a ser intervenido. Resistencia de las crisis al tratamiento farmacológico y evidencia de DCF en la neuroimagen son parámetro fundamentales para el tratamiento quirúrgico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.