Determinar la asociación entre los niveles de proteína C reactiva (PCR) con la puntuación de Rankin al alta y días de estancia hospitalaria.
MétodosMediante un estudio cohorte se evaluaron 48 pacientes con ictus isquémico del Servicio de Neurología del Hospital del Seguro Social de Guayaquil (Ecuador). Los pacientes fueron divididos según sus niveles de PCR (elevada o normal). Se midieron las variables demográficas, antecedentes, hábitos y características de la isquemia. Se buscó diferencia del puntuación en la escala de Rankin y estancia hospitalaria utilizando la prueba de la T de Student, la prueba de Mann Whitney, el Log Rank test, la correlación de Spearman y la regresión lineal múltiple.
ResultadosSe estudiaron 29 pacientes con niveles elevados de PCR y 19 con niveles normales de PCR. No se hallaron diferencias al comparar las características basales. Se encontró correlación entre los niveles de PCR y la puntuación de Rankin r=0,35 (p=0,014). Aunque la media de la puntuación de Rankin al alta fue mayor en el grupo con PCR elevada, no se encontró diferencia significativa (p=0,15). La media de días de estancia hospitalaria fue mayor en el grupo de PCR elevada, sin ser significativa (p=0,21); tampoco se encontró diferencia en el Log Rank test (p=0,06). La regresión lineal múltiple encontró mayor asociación con la muestra tomada en las primeras 48 h del inicio de síntomas (p=0,02).
ConclusionesEncontramos correlación entre los niveles de PCR y Rankin al alta. El resto de análisis mostró una tendencia al peor pronóstico en el grupo de PCR elevada, sin ser ésta significativa.
Determine the association between C-Reactive Protein (CRP), the Rankin scale score at discharge and the hospital stay days.
MethodsCohort study of 48 patients with diagnosis of ischemic stroke admitted to the Neurology Service of the Social Security Hospital, Guayaquil-Ecuador. Patients were divided into two groups depending of their CRP levels (normal or elevated). Demographic variables, medical history, social history and stroke characteristics were accounted. The difference between the Rankin scale score and the hospital stay days was determined by the T test, Mann Whitney test, Log Rank test, Spearman correlation and multiple linear regression.
ResultsTwenty nine patients with elevated CRP levels and 19 with normal CRP levels were studied. Both groups had similar baseline characteristics. We found a correlation between the CRP levels and the Rankin scale score r=0.35 (p=0.014). Even though the mean of the Rankin scale score was higher in the elevated CRP group there was no significant difference (p=0.15). The mean of the hospital stay days was higher in the elevated CRP group with no difference (p=0.21) and no difference was found with the Log Rank test (0.06) either. The multiple lineal regression found a stronger association with the samples taken in the first 48 h of the beginning of symptoms (p=0.02).
ConclusionWe found a correlation between the levels of CRP and Rankin scale score at discharge. The remaining analysis showed a tendency for worse prognosis in the elevated CRP group not statistically significant.
La proteína C reactiva (PCR) es un marcador de inflamación y daño tisular ampliamente utilizado1. Su síntesis hepática aumenta rápidamente horas después de la destrucción o infección de los tejidos2. Esta elevación de la PCR luego de la injuria tisular ha llevado a que se realicen varios estudios con el objetivo de encontrar la relación entre sus niveles y el riesgo o pronóstico en lesiones isquémicas, como en el infarto de miocardio, el ictus cerebral y la enfermedad arterial periférica3,4. La relación entre niveles altos de PCR y la mortalidad por infarto agudo de miocardio ha sido demostrada, así como también la relación con el riesgo de sufrir un primer infarto agudo de miocardio5,6. Esta proteína es considerada también un marcador de aterosclerosis, y su medición es útil al evaluar el riesgo cardiovascular3,7–10.
Varios estudios han encontrado que existe una relación entre los niveles de PCR elevada y el riesgo de desarrollar un ictus isquémico futuro11–17. Sin embargo, la relación entre los niveles de PCR y el pronóstico en pacientes con ictus isquémico aún no ha sido claramente demostrada18–20. Dos de los principales obstáculos que se han encontrado son: el tiempo en el que se debe tomar la muestra luego del evento vascular y la existencia de múltiples condiciones que pueden elevar la PCR; estas condiciones dificultan la interpretación de resultados.
Con el propósito de determinar si los niveles elevados de PCR se asocian con un mal pronóstico a corto plazo, se realizó un estudio en pacientes con infarto cerebral agudo en quienes se obtuvieron niveles de PCR, los cuales fueron ajustados al tiempo transcurrido entre el inicio de los síntomas y la toma de muestra; además, se excluyó a los pacientes con patologías que pudieran elevar, de forma independiente, la PCR. De demostrar la utilidad de la PCR para determinar el pronóstico a corto plazo se podría contar con un marcador precoz de pronóstico, de fácil medición y bajo costo, que permitiría identificar a pacientes que podrían beneficiarse de un tratamiento más intensivo.
ObjetivosEl objetivo primario fue determinar la asociación entre los niveles normales o elevados de la PCR y la puntuación de discapacidad al alta determinada por la escala de Rankin modificada21. El objetivo secundario fue determinar la diferencia en la estancia hospitalaria dependiendo del valor normal o elevado de la PCR.
Materiales y métodosDiseñoSe realizó un estudio cohorte prospectivo en pacientes con infarto cerebral agudo del Servicio de Neurología del Hospital Regional Dr. Teodoro Maldonado Carbo. El estudio fue aprobado por el comité de ética de dicho hospital y por la Comisión Científica de la Universidad Católica de Santiago de Guayaquil.
PoblaciónSe incluyó a pacientes que ingresaron al Servicio de Neurología del Hospital Regional Dr. Teodoro Maldonado Carbo entre el 1 de junio de 2008 y el 31 de mayo de 2009, con diagnóstico de evento cerebrovascular isquémico agudo. Se definió evento isquémico agudo como un síndrome neurológico súbito y focal22, con persistencia de los síntomas por más de 24h, en donde se confirmó la etiología isquémica del evento con un estudio de neuroimagen (tomografía simple de cerebro o resonancia magnética). Los criterios de exclusión fueron: antecedente de evento cerebrovascular, ictus isquémico de más de 72h de evolución, historia de infección reciente (en las 2 semanas previas al ingreso mediante entrevista y revisión de historial clínico), signos y síntomas de infección al momento de la evaluación, enfermedad renal avanzada, enfermedad hepática, cirugía o trauma mayor en el mes previo.
Recolección de datos y medicionesTodos los pacientes, como parte del protocolo de manejo por parte del área de Neurología, fueron sometidos a su ingreso a un perfil de evaluación cerebrovascular que incluyó una historia clínica completa, examen neurológico completo, determinación de la severidad al ingreso mediante la escala de ictus del Instituto Nacional de Salud (NIHSS por sus siglas en inglés: National Institutes of Health Stroke Scale)21, biometría hemática completa, bioquímica sanguínea, por lo menos una tomografía simple de cerebro y/o resonancia magnética, electrocardiograma estándar de doce derivaciones, eco-doppler de vasos de cuello y/o ecocardiograma.
Se midieron las siguientes características: edad, sexo, antecedente de hipertensión arterial o diabetes mellitus (mediante interrogatorio y revisión del historial clínico), historia de tabaquismo (medida como: nunca, previa o actual), historia de consumo de alcohol (medida como: nunca, previa o actual). Se registró la presencia de fibrilación auricular (mediante el electrocardiograma). Se hizo una subdivisión de acuerdo a la extensión del territorio cerebral afectado en: territorio carotídeo de grandes vasos, territorio carotídeo de pequeños vasos y territorio vertebrobasilar. La extensión se determinó mediante un estudio de neuroimagen donde la afección de grandes vasos correspondió al territorio cortical, la afección de los pequeños vasos correspondió al territorio subcortical y la afección vertebrobasilar, al territorio del cerebelo y tallo encefálico.
A los pacientes se les hizo una medición de PCR al ingreso. La medición se realizó mediante turbidimetría de Roche en el autoanalizador modular P, el cual mide los niveles de PCR de manera altamente sensible23 usando rangos normales de 0–5mg/l, por lo que se tomó el valor de 5mg/l como punto de corte entre nivel normal y elevado. El tiempo de la toma de muestra se determinó dependiendo del inicio de los síntomas y se cuantificó en: dentro de las primeras 24h, entre las 24 y 48h y entre las 48 y 72h.
SeguimientoSe siguió a los pacientes durante su estancia hospitalaria y al momento del alta se determinó el grado de discapacidad mediante la escala de Rankin modificada21. Se cuantificaron los días de estancia hospitalaria.
Los criterios para el alta hospitalaria fueron la estabilización de los síntomas que aseguren que no exista empeoramiento del déficit neurológico, parámetros hemodinámicos dentro de los rangos normales (presión arterial controlada, no evidencia de arritmias, función respiratoria normal, función renal normal), control de eventos vasculares nuevos (ataque isquémico transitorio, ictus recurrente, angina inestable, infarto agudo de miocardio) y de eventos no vasculares nuevos. Los médicos tratantes encargados del manejo de los pacientes no tuvieron conocimiento de los resultados de la PCR con el fin de evitar el sesgo de conocimiento sobre los resultados. El ataque isquémico transitorio se definió como un episodio focal neurológico breve de hasta 1h de duración y reversible sin dejar signos permanentes22. El ictus recurrente se definió como un evento focal neurológico nuevo, isquémico o hemorrágico, con un nuevo déficit neurológico o con empeoramiento del déficit previo y con una duración de más de 24h22. La angina inestable se definió como dolor retroesternal de características isquémicas de reciente inicio, empeoramiento de síntomas previos o desarrollo de angina 24h o más, luego de un infarto agudo de miocardio24,25. El infarto agudo de miocardio se definió como un cuadro de características clínicas de angina inestable acompañado de alteraciones en los marcadores bioquímicos de daño miocárdico y cambios característicos en el ECG24,25.
Tamaño de la muestraLa muestra fue definida mediante revisión de los ingresos por infarto cerebral del año 2007 en el Servicio de Neurología del Hospital Regional Teodoro Maldonado Carbo. Durante este año el mínimo de pacientes ingresados al mes fue de 7, y el máximo, de 20. El promedio de pacientes ingresados al mes fue de 12 pacientes. Mediante la fórmula N=[(1/q1 + 1/q2) S2 (Zα + Zβ)2] ÷ ∂2, donde q1= 25%, q2= 75%, S2 = 0,13, Zα = 1,96 y Zβ = 0,84, se pudo determinar que con 84 pacientes se podía encontrar una diferencia entre los dos grupos. El número 84 se obtuvo como valor mínimo de pacientes de acuerdo al mes del 2007 que menos pacientes tuvo. La distribución de los datos del año 2007 se encontraba sesgada, por lo que fueron transformados a logaritmos para poder hacer los cálculos.
Análisis estadísticoSe describen las características de la población mediante media, mediana, desviación estándar, primer cuartil (1C) y tercer cuartil (3C) para las variables cuantitativas, y porcentaje para las variables cualitativas. Se analizan las características basales, el territorio vascular y la puntuación del NIHSS de los pacientes con isquemia cerebral aguda, dependiendo de si sus niveles de PCR son normales o elevados; para estos análisis se utilizaron la prueba T de Student a dos colas con variancias iguales o desiguales, la prueba de la U de Mann-Whitney o la prueba χ2, según fuese apropiado.
Se utilizó la correlación de Spearman para ver si existe una relación y cuál es la fuerza y dirección de ésta entre los niveles de PCR y la puntuación de Rankin al alta. Se realizó la prueba de T de Student para determinar la diferencia en la puntuación de Rankin modificado al alta dependiendo de los niveles normales o elevados de PCR. Mediante análisis post hoc se realizó la prueba de ANOVA para determinar la diferencia de la puntuación de Rankin al alta, dependiendo de los niveles de PCR estratificados en cuartiles.
Se realizó la prueba de Mann–Whitney para determinar la diferencia en los días de hospitalización entre los niveles normales y elevados de la PCR, y mediante análisis post hoc se realizó Kaplan Meier y Log Rank test para determinar la diferencia en los tiempos de hospitalización.
Se realizó regresión lineal múltiple para determinar la influencia en la puntuación de Rankin modificado al alta, del tiempo entre el inicio de los síntomas y la toma de la muestra de la PCR, dependiendo de si esta muestra fue tomada dentro de las primeras 24h, entre las 24 y 48h o entre las 48 y 72h.
Todos los análisis fueron realizados en el Statistical Package for the Social Sciences (SPSS) versión 15.
ResultadosEntre el 1 de junio de 2008 y el 31 de mayo de 2009 fueron ingresados 148 pacientes con diagnóstico de evento cerebrovascular, de los cuales 94 fueron descartados por no cumplir con los criterios del estudio. Para el análisis final se incluyeron 48 pacientes: 29 con niveles elevados de PCR y 19 con niveles normales de PCR (fig. 1).
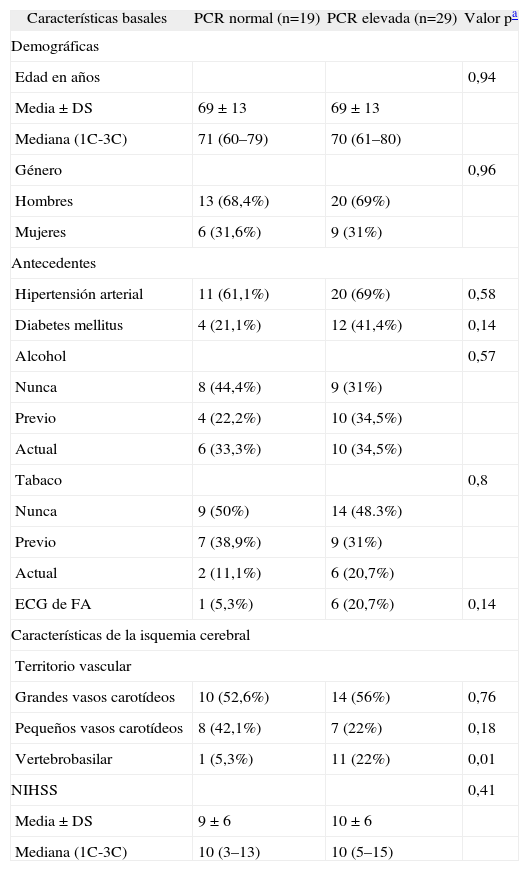
Las características basales de los pacientes con evento cerebrovascular isquémico agudo, divididos según su nivel normal o elevado de PCR, se describen en la tabla 1. No se observaron diferencias entre estos grupos en las variables demográficas ni en los antecedentes.
Características basales de los 48 pacientes con isquemia cerebral aguda
| Características basales | PCR normal (n=19) | PCR elevada (n=29) | Valor pa |
| Demográficas | |||
| Edad en años | 0,94 | ||
| Media ± DS | 69 ± 13 | 69 ± 13 | |
| Mediana (1C-3C) | 71 (60–79) | 70 (61–80) | |
| Género | 0,96 | ||
| Hombres | 13 (68,4%) | 20 (69%) | |
| Mujeres | 6 (31,6%) | 9 (31%) | |
| Antecedentes | |||
| Hipertensión arterial | 11 (61,1%) | 20 (69%) | 0,58 |
| Diabetes mellitus | 4 (21,1%) | 12 (41,4%) | 0,14 |
| Alcohol | 0,57 | ||
| Nunca | 8 (44,4%) | 9 (31%) | |
| Previo | 4 (22,2%) | 10 (34,5%) | |
| Actual | 6 (33,3%) | 10 (34,5%) | |
| Tabaco | 0,8 | ||
| Nunca | 9 (50%) | 14 (48.3%) | |
| Previo | 7 (38,9%) | 9 (31%) | |
| Actual | 2 (11,1%) | 6 (20,7%) | |
| ECG de FA | 1 (5,3%) | 6 (20,7%) | 0,14 |
| Características de la isquemia cerebral | |||
| Territorio vascular | |||
| Grandes vasos carotídeos | 10 (52,6%) | 14 (56%) | 0,76 |
| Pequeños vasos carotídeos | 8 (42,1%) | 7 (22%) | 0,18 |
| Vertebrobasilar | 1 (5,3%) | 11 (22%) | 0,01 |
| NIHSS | 0,41 | ||
| Media ± DS | 9 ± 6 | 10 ± 6 | |
| Mediana (1C-3C) | 10 (3–13) | 10 (5–15) | |
DS: desviación estándar; 1C: primer cuartil; 3C: tercer cuartil; ECG de FA: electrocardiograma sugestivo de fibrilación auricular; NIHSS: escala de ictus del Instituto Nacional de Salud (por sus siglas en inglés National Institutes of Health Stroke Scale).
Se comparó el territorio vascular del evento isquémico y sólo se halló diferencia en el territorio vertebrobasilar (p=0,01). No se hallaron diferencias en la puntuación en la escala de NIHSS entre los pacientes con niveles normales y elevados de la PCR (tabla 1). Sólo un paciente del grupo de PCR elevada presentó eventos vasculares nuevos (ictus recurrente) durante su estancia hospitalaria.
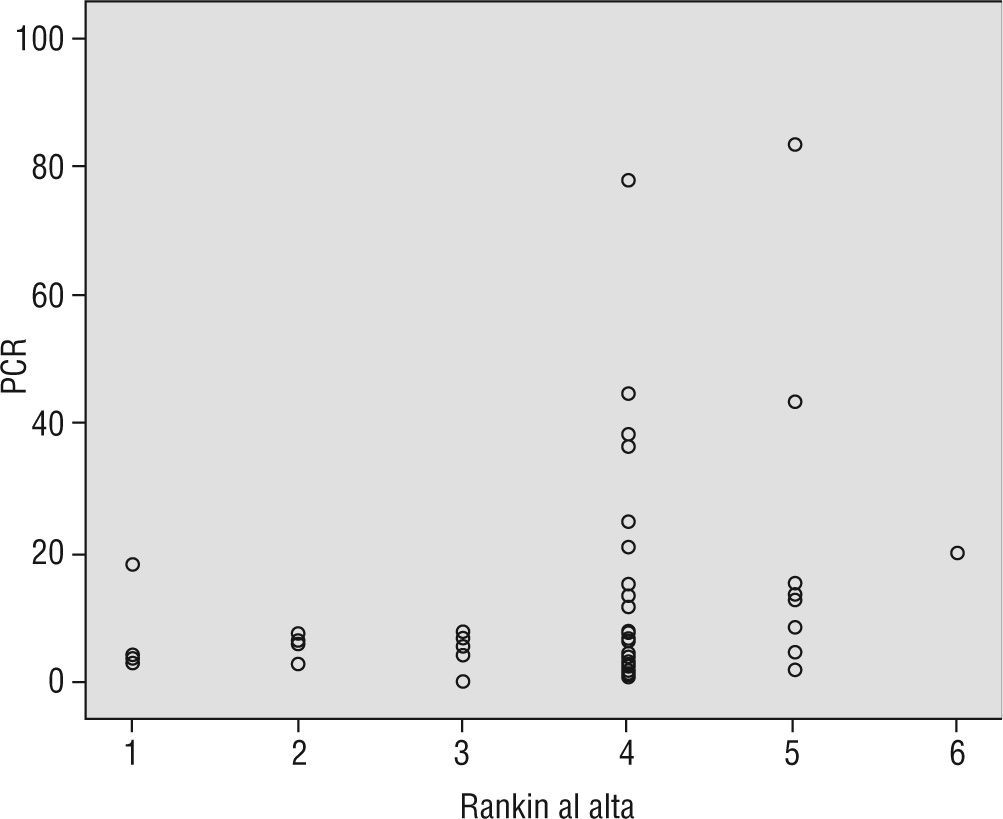
Se encontró correlación entre los niveles de PCR y la puntuación de Rankin (r=0,35; p=0,01) (fig. 2). Se analizó la puntuación de Rankin modificado al alta entre los pacientes con niveles normales o elevados de PCR, y aunque tanto las medias como los cuartiles eran mayores en los pacientes con PCR elevada, no se encontró diferencia significativa (p=0,15) (tabla 2). Al ver las puntuaciones de manera independiente según los niveles de PCR, se observa una mayor tendencia a las puntuaciones más altas en el grupo de PCR elevada (tabla 2 y fig. 3). En el análisis post hoc no se encontró diferencia significativa al comparar la puntuación de Rankin modificado entre los niveles de PCR dividido en cuartiles (p=0,09) (fig. 4). Se encontró asociación entre los niveles de PCR y la puntuación de Rankin modificado ajustada para el tiempo transcurrido entre el inicio de los síntomas y la toma de la muestra (p=0,008) al realizar regresión lineal múltiple con la muestra tomada en las primeras 24h (p=0,02) y entre las 24 y 48h (p=0,02).
Características al alta de los 48 pacientes con isquemia cerebral aguda
| Características al alta | PCR normal (n=19) | PCR elevada (n=29) | Valor pa |
| Rankin modificado | |||
| Media ± DS | 3 ± 1 | 4 ± 1 | 0,15 |
| Mediana (1C-3C) | 4 (3–4) | 4 (4–5) | |
| 1 | 3 (15,8%) | 1 (3,5%) | |
| 2 | 1 (5,3%) | 3 (10,3%) | |
| 3 | 2 (10,5%) | 3 (10,3%) | |
| 4 | 11 (57,9%) | 14 (48,3%) | |
| 5 | 2 (10,5%) | 6 (20,7%) | |
| 6 | 0 (0%) | 2 (6,9%) | |
| Días de estancia hospitalaria | |||
| Media ± DS | 11 ± 3 | 14± 9 | |
| Mediana (1C-3C) | 11 (9–13) | 12 (10–15) | 0,21 |
DS: desviación estándar; 1C: primer cuartil; 3C: tercer cuartil.
Puntuación de Rankin modificado al alta dependiendo de los valores de proteína C reactiva (PCR) estratificado en cuartiles. Los 48 pacientes con isquemia cerebral aguda se dividieron en cuatro grupos iguales (cuartiles) de acuerdo a sus niveles de proteína C reactiva (PCR). Al realizar la prueba de ANOVA entre la puntuación de Rankin modificado dividido en los cuartiles se encontró un valor p=0,091.
Con respecto a los días de estancia hospitalaria, no se encontró diferencia (p=0,21) entre los pacientes con niveles normales y elevados de PCR (tabla 2) aunque tanto la media, la mediana, la desviación estándar y los cuartiles tienen valores más altos en el grupo de PCR elevada. Las curvas de Kaplan-Meier muestran que los pacientes con niveles elevados de PCR tienen una mayor estancia hospitalaria (fig. 5), pero no se obtuvo diferencia estadística significativa al realizar la prueba de Log Rank (p=0,06).
DiscusiónEl objetivo de este estudio fue encontrar si existe una relación entre los niveles de PCR y el pronóstico a corto plazo en el ictus isquémico agudo. Existe evidencia fisiopatológica que explicaría esta relación. En el ictus se produce primero una reacción inflamatoria, lo que desencadena una cascada de liberación de citoquinas, moléculas de adhesión, proteínas de fase aguda como la PCR, y reclutamiento de células inflamatorias22, y la fuerza de esta reacción está relacionada con el pronóstico del paciente.
Nuestros resultados muestran una diferencia estadísticamente significativa entre los niveles de PCR y la puntuación de Rankin tanto en la correlación como en la regresión lineal. Aunque no encontramos una diferencia estadística en la puntuación de Rankin según el nivel de PCR, se observó que el grupo de pacientes con niveles elevados de PCR tuvieron una tendencia al peor pronóstico. También, al comparar la estancia hospitalaria, observamos esta tendencia en los pacientes con PCR elevada al peor pronóstico pero sin encontrarse diferencia significativa. La falta de significancia pudo deberse a que la muestra no tuvo el poder suficiente o a que el punto de corte que se utilizó para dividir los niveles de PCR normal del elevado no era el adecuado.
Nuestro estudio tiene dos grandes ventajas. Presentó criterios de exclusión e inclusión muy estrictos, lo que permitió disminuir el riesgo de incluir comorbilidades que pueden elevar, de forma independiente, los niveles de PCR y dificultar la interpretación de los resultados, ya que altas concentraciones de PCR pueden deberse a infección sistémica o enfermedades inflamatorias. Además, no sólo conseguimos controlar el valor dinámico de la PCR dependiente del tiempo de la toma de la muestra por medio de regresión lineal, sino además proponemos que el mejor momento para medir la PCR sería entre las 24 y 48h, porque en ese rango se encontró la mayor fuerza de asociación.
La limitación de este estudio es el tamaño de la muestra, la cual resultó muy pequeña para encontrar una diferencia significativa, si la hubiese. La principal razón del tamaño de la muestra fue que aproximadamente un 25% de los pacientes asistió al hospital luego de las 72h de inicio del cuadro clínico. Este tiempo fue escogido porque la literatura muestra que posiblemente dentro de las primeras 72h se encuentra el pico de PRC26, pero no pudimos prever la cantidad de pacientes que iban a llegar luego de 3 días de iniciado el cuadro, ya que no existe literatura nacional que indique el tiempo promedio en que llegan los pacientes al hospital una vez iniciado el cuadro. Este dato es muy importante, porque da a conocer un gran problema de salud pública en esta patología: el retraso en la búsqueda de atención médica. Además, al ser el primer reporte de datos nacionales sobre la magnitud de este retraso, esperamos que esta información sea útil para el cálculo de muestra de futuros estudios nacionales y posiblemente también en estudios en otros países en vías de desarrollo.
Dos estudios realizados por Corso et al27 en Italia y por den Hertog et al28 en los Países Bajos utilizaron puntos de corte más elevados para dividir a los grupos de pacientes. Ellos encontraron una asociación entre el pronóstico y nivel de PCR mayor o igual a 9mg/l y mayor o igual a 7mg/l, respectivamente. Esto podría indicar que, subiendo el punto de corte, el valor predictivo positivo y la especificidad de la PCR serían óptimos como factor pronóstico.
Un estudio coreano encontró una relación entre los niveles de PCR a los 7 días de hospitalización y el Rankin a los 12 meses, sugiriendo que a los pacientes no sólo se los debe seguir por un tiempo más prolongado, sino también considerar mediciones seriales de PCR durante la primera semana y no en los primeros 3 días, como han hecho la mayoría de estudios29.
En Noruega, un estudio encontró una relación entre la PCR y el estado funcional, la mortalidad, la severidad y la etiología cardioembólica del ictus, pero al hacer ajuste para variables confusoras únicamente permaneció significativa la relación con la severidad y la mortalidad30; Azarpazhooh et al31 tampoco encontraron relación entre los niveles de PCR y la etiología del ictus. Nuestro estudio no evaluó la relación entre la PCR y la etiología del ictus. Encontramos relación entre PCR elevada y el ictus de territorio vertebrobasilar que es frecuentemente de etiología embólica, y aunque esto puede parecerse a la tendencia encontrada por Idicula et al30 previo al ajuste, no podríamos llegar a una conclusión en nuestro estudio. Por otro lado, ya se mencionó que la PCR es considerada un marcador de aterosclerosis3,6,7, y aunque los resultados podrían ajustarse según la etiología aterosclerótica del ictus, los estudios no han podido determinar esta asociación y nosotros no encontramos diferencia en la enfermedad de pequeños vasos que es con gran frecuencia de origen aterosclerótico.
Otros abordajes interesantes utilizados en varios estudios, como la PCR y la predicción del deterioro cognitivo32, o la PCR como ayuda al diagnóstico precoz del ictus33, nos indican la amplia gama de posibles utilidades que se le pueden dar a la PCR al momento de evaluar el evento cerebrovascular isquémico.
En conclusión, encontramos asociación entre los niveles de PCR y la puntuación de Rankin, y vimos que tomar la muestra de la PCR entre las 24 y 48h luego del inicio de los síntomas sería el mejor momento. No encontramos una asociación entre los niveles de PCR y la estancia hospitalaria.
Aunque estos resultados no son concluyentes, muestran evidencia de que el valor de la PCR sérica puede predecir la gravedad y el comportamiento en el infarto cerebral. Creemos que todavía hay que profundizar en esta área. Otras variables que también pueden tener interés son la presión arterial al ingreso, el nivel de glucemia, la creatinina, los lípidos, otros reactantes de fase aguda34,35 y el tipo de tratamiento recibido. Además, se podría seguir a los pacientes tras su alta hospitalaria para determinar si los niveles de PCR se relacionan con el pronóstico a moderado o largo plazo. Y más importante aún, determinar si un tratamiento intensivo en pacientes con PCR elevada mejoraría su pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado como póster y presentación oral en el XII Congreso de la Sociedad Iberoamericana de Enfermedad Cerebrovascular. No ha recibido ningún tipo de compensación pública o privada. No ha sido publicado en ninguna revista.