En los últimos años han surgido numerosos dispositivos de neuromodulación, invasivos y no invasivos, que se han aplicado en pacientes con cefaleas y neuralgias sin que exista una revisión actualizada de su eficacia y seguridad, ni recomendaciones de ninguna institución sanitaria sobre su uso específico en cada entidad nosológica.
MétodosNeurólogos del Grupo de Cefaleas de la Sociedad Española de Neurología (SEN) y neurocirujanos expertos en neurocirugía funcional seleccionados por la Sociedad Española de Neurocirugía (SENEC), hemos realizado una revisión exhaustiva en el sistema Medline sobre neuromodulación en cefaleas y neuralgias.
ResultadosPresentamos una revisión actualizada y establecemos por primera vez unas recomendaciones consensuadas entre la SEN y la SENEC sobre el uso de la neuromodulación en cefaleas y neuralgias, adjudicando niveles de evidencia sobre su eficacia actual, específicamente en cada entidad nosológica.
ConclusionesLos resultados actuales de los estudios proporcionan evidencias para la indicación de técnicas de neuromodulación en casos refractarios de cefaleas y neuralgias (sobre todo en migraña, cefalea en racimos y neuralgia del trigémino), seleccionados por neurólogos expertos en cefaleas, tras comprobar el agotamiento de las opciones farmacológicas. Adicionalmente, en el caso de la neuromodulación invasiva, se recomienda que los casos sean debatidos en comités multidisciplinarios y la cirugía sea realizada por equipos de neurocirujanos expertos en neurocirugía funcional y con una morbimortalidad aceptable.
Numerous invasive and non-invasive neuromodulation devices have been developed and applied to patients with headache and neuralgia in recent years. However, no updated review addresses their safety and efficacy, and no healthcare institution has issued specific recommendations on their use for these 2 conditions.
MethodsNeurologists from the Spanish Society of Neurology's (SEN) Headache Study Group and neurosurgeons specialising in functional neurosurgery, selected by the Spanish Society of Neurosurgery (SENEC), performed a comprehensive review of articles on the MEDLINE database addressing the use of the technique in patients with headache and neuralgia.
ResultsWe present an updated review and establish the first set of consensus recommendations of the SEN and SENC on the use of neuromodulation to treat headache and neuralgia, analysing the current levels of evidence on its effectiveness for each specific condition.
ConclusionsCurrent evidence supports the indication of neuromodulation techniques for patients with refractory headache and neuralgia (especially migraine, cluster headache, and trigeminal neuralgia) selected by neurologists and headache specialists, after pharmacological treatment options are exhausted. Furthermore, we recommend that invasive neuromodulation be debated by multidisciplinary committees, and that the procedure be performed by teams of neurosurgeons specialising in functional neurosurgery, with acceptable rates of morbidity and mortality.
En los últimos años se han desarrollado varios dispositivos de neuromodulación que actúan a nivel central o periférico en el tratamiento de cefaleas y neuralgias craneofaciales refractarias a los tratamientos farmacológicos. El principio subyacente del tratamiento neuromodulador es el bloqueo o modificación controlada y reversible del sistema nociceptivo a través de la estimulación de los nervios periféricos, del nervio vago, médula espinal cervical o del cerebro a nivel cortical o profundo
Algunos dispositivos de neuromodulación son de autoaplicación externa (no invasivos) y otros requieren implantación quirúrgica (invasivos) (tabla 1). Por este motivo hemos dividido la guía en dos grandes apartados:
- •
Neuromodulación no invasiva
- •
Neuromodulación invasiva
Tipos de técnicas de neuromodulacIón
| Neuromodulación no invasiva |
| • Estimulación trigeminal transcutánea |
| • Estimulación magnética transcraneal de pulso simple |
| • Estimulación del nervio vago |
| Neuromodulación invasiva |
| • Periférica |
| • Ramas terminales y del tracto del nervio trigémino |
| • Ganglio esfenopalatino |
| • Nervios occipitales |
| • Central |
| • Medular cervical |
| • Cerebral |
| • Transcortical |
| • Profunda |
| • Hipotalámica |
| • Talámica |
Esta última se basan en tecnologías complejas y su manejo, implantación y monitorización, requieren un alto nivel de especialización neurológica y neuroquirúrgica. Adicionalmente, la accesibilidad a los dispositivos de neuromodulación es muy reducida por su alto coste, por lo que muchos profesionales los desconocen.
Se han comunicado múltiples estudios mostrando seguridad y eficacia que hacen necesario un posicionamiento sobre su recomendación y uso, aunque sin duda, la indicación de estas técnicas debe ser establecida por neurólogos expertos en cefaleas y neuralgias.
ObjetivosLa presente Guía de Neuromodulación en Cefaleas y Neuralgias Refractarias, primera en su área de conocimiento, es fruto de la colaboración de la Sociedad Española de Neurología (SEN) y la Sociedad Española de Neurocirugía (SENEC) y tiene un doble objetivo:
- •
Presentar los dispositivos y técnicas de neuromodulación.
- •
Analizar el nivel de evidencia actual de su eficacia y valorar su seguridad, realizando recomendaciones sobre su indicación.
Hemos realizado una exhaustiva y sistemática revisión y análisis de la bibliografía existente sobre neuromodulación en cefaleas y neuralgias craneofaciales en la base de datos Medline. No se ha aplicado ningún filtro y el período de publicación analizado comprende desde el año 1967, en el que Shealy1 implantó el primer sistema de neuromodulación, hasta mayo de 2019. Los niveles de evidencia y grados de recomendación adjudicados se han definido siguiendo los criterios de la Guía Oficial de Práctica Clínica en Cefaleas de la Sociedad Española de Neurología 20152 (tabla 2).
Metodología empleada por la Guía Oficial de Práctica Clínica en Cefaleas de la Sociedad Española de Neurología 20152 para actuaciones terapéuticas. Niveles de Evidencia y Grados de Recomendación empleados
| Nivel I | Ensayos clínicos controlados, prospectivos y con evolución ciega realizados sobre población representativaRevisiones sistemáticas de ensayos clínicos controlados en población representativaEn ambos se requieren las siguientes característicasa) Muestreo aleatorizadob) Objetivos claramente definidosc) Criterios de exclusión/inclusión claramente definidosd) Adecuado control de las pérdidas de seguimientoe) Las características basales de los pacientes son explícitas en el texto y equivalentes entre los grupos o las diferencias han sido ajustadas estadísticamente |
| Nivel II | Estudios de cohortes prospectivos en una población representativa con evolución ciega que reúne los criterios a-eEnsayos clínicos controlados, prospectivos y con evolución ciega realizados sobre población representativa que no cumplen algunos de los criterios a-e |
| Nivel III | Todos los demás estudios controlados en una población representativa, en los que la evolución es independiente del tratamiento del paciente |
| Nivel IV | Estudios no controlados, series de casos, casos aislados u opiniones de expertos |
| Grado A | Recomendación definitivamente efectiva, ineficaz o peligrosaRequiere al menos un estudio concluyente de Nivel I o dos estudios convincentes de Nivel II |
| Grado B | Recomendación probablemente efectiva, ineficaz o peligrosaRequiere al menos un estudio concluyente de Nivel II o varios estudios de Nivel III |
| Grado C | Recomendación posiblemente efectiva, ineficaz o peligrosaRequiere al menos dos estudios concluyentes de Nivel III |
El médico romano Escribonio Largo comunicó el primer caso terapéutico de neuromodulacIón en el siglo I d.C. al constatar la gran mejoría experimentada por la gota de Anteros, un oficial de la guardia del emperador Tiberio, tras el contacto accidental con un pez torpedo negro, animal que puede inducir descargas eléctricas de hasta 220 V como mecanismo de caza y defensa3,4. Los médicos romanos, griegos y musulmanes emplearon este pez en el tratamiento de las cefaleas y del prolapso anal, pero estas experiencias no volverían a suscitar interés médico hasta el desarrollo de la electricidad en el siglo XVIII3. El propio Benjamín Franklin constató el efecto de contracción muscular ante la estimulación eléctrica3.
En 1874, el norteamericano Robert Bartholow5 realizó la primera estimulación en un córtex humano provocando contracción muscular en un criticado experimento en el que falleció la paciente. Años después, en 1908, Horsley y Clark6 crearon la cirugía estereotáxica. Finalmente, la Teoría de «la Puerta de Entrada» de Melzack y Wall, planteada en 19657, proporcionaría el impulso definitivo para el desarrollo de la neuromodulación3. La tabla 3 recoge los principales hitos en la historia de la neuromodulación, específicamente en el dolor1,8-19. Desde entonces, se han desarrollado varios dispositivos de neuromodulación que actúan a nivel central o periférico en el tratamiento de cefaleas y neuralgias craneofaciales refractarias al tratamiento farmacológico20.
Principales hitos en la historia de la neuromodulación del dolor craneofacial1,8-19
| Autor | Año | Hito |
|---|---|---|
| Heath RG | 1953 | Primera estimulación cerebral en dolor oncológico8. |
| Wall PD | 1967 | Primera estimulación periférica. Se estimuló su propio nervio infraorbitario9 |
| Shealy CN | 1967 | Primera implantación de un neuroestimulador por dolor. Fue medular en un paciente con dolor oncológico1 |
| Hosobuchi Y | 1973 | Primeras ECP implantando un estimulador en el tálamo en 6 pacientes con anestesia dolorosa10 |
| Latinen L | 1976 | Primeras experiencias con TENS11 |
| Barker AT | 1985 | Primera experiencia con EMT12. |
| Tsubokawa T | 1991 | Primeras ECM en 12 pacientes con dolor por desaferentización13 |
| Weiner RL | 1999 | Implantación de ENO en neuralgia occipital14. |
| Leone M | 2001 | Implantación de ECP en CR15 |
| Popeney CA | 2003 | Implantación de ENO en migraña16 |
| Schwedt TJ | 2006 | Implantación de ENO en CR17 |
| Ibarra E | 2007 | Primera estimulación del GEFP en CR18 |
| Schoenen J | 2013 | Implantación de un estimulador en el GEFP en CR19 |
CR: cefalea en racimos; ECP: estimulación cerebral profunda; ECM: estimulación del córtex motor; EMT: estimulación magnética transcraneal; ENO: estimulación de nervios occipitales; GEFP: ganglio esfenopalatino; TENS: estimulación eléctrica transcutánea.
Consiste en la estimulación nerviosa eléctrica transcutánea del nervio supraorbitario o del nervio vago, y la estimulación magnética transcraneal utilizando dispositivos no implantados (tabla 3). La neuromodulación no invasiva es autoaplicable y evita la realización de procedimientos quirúrgicos, sus complicaciones y el coste asociado.
Estimulación trigeminal transcutánea: nervio supraorbitario (NSO)Modula la actividad nociceptiva a nivel del ganglio trigeminal y pueden tener acciones sobre el córtex cingulado anterior (fig. 1)21. Se ha evaluado en migraña:
Tratamiento preventivo: en el ensayo PREMICE22, se incluyeron pacientes con migraña con al menos dos ataques al mes y se aleatorizaron a tratamiento con 20 minutos/día de estimulación activa (n = 34) y estimulación placebo (n = 33). Tras tres meses se observó una reducción significativa en el número de días de migraña en el grupo activo respecto al control, sin efectos adversos. El porcentaje de pacientes con una reducción del número de ataques superior al 50% fue del 38% en el brazo activo y 12% en placebo. Esta excelente seguridad y tolerancia se observó también en una encuesta realizada a 2.313 pacientes con un porcentaje de efectos adversos del 4% (leves en todos los casos) y solo el 2% interrumpió el tratamiento23. Posteriormente, se realizó un estudio abierto (n = 23) en pacientes con migraña crónica utilizando el dispositivo 20 minutos/día durante 4 meses y sólo 8 pacientes presentaron una reducción del número de días de migraña24. Estudios abiertos posteriores en migraña episódica y crónica25,26 sugieren que esta terapia preventiva es eficaz, segura y bien tolerada. En un estudio abierto27 (n = 7) en pacientes con migraña crónica, la estimulación simultánea del NSO y del nervio occipital aportó beneficios adicionales.
Tratamiento sintomático: recientemente se ha evaluado la estimulación del NSO como tratamiento del ataque de migraña, en un estudio doble ciego, aleatorizado y controlado de estimulación activa (n = 52) frente a placebo (n = 54)28. El objetivo fue el cambio en la intensidad del dolor tras una hora de estimulación y se observó una reducción significativa en el grupo activo.
Entre los efectos adversos más relevantes observados21-24 destacan: parestesias, dolor local o problemas cutáneos en la región de estimulación. Este dispositivo se desaconseja en pacientes con implantes metálicos, estimuladores en la cabeza, marcapasos o desfibriladores.
Estimulación magnética transcraneal (EMT) de pulso simpleSu principal mecanismo de acción en la migraña es la modulación de la actividad eléctrica cortical y talámica29 y se considera que la inhibición de la depresión cortical propagada podría controlar el aura y la cefalea30.
Tratamiento sintomático: En un ensayo multicéntrico controlado frente a placebo31 se aplicaron dos pulsos magnéticos con una diferencia de 30 segundos al inicio del aura. Se utilizó un sistema de EMT portátil no invasivo (fig. 2) y se trataron 82 pacientes en el grupo activo y 82 con estimulación placebo. El 39% de los pacientes estaban libres de dolor a las dos horas en el grupo activo y 22% en el placebo31.
Tratamiento preventivo. Un estudio abierto32 evaluó la eficacia y seguridad, a los tres meses, de la EMT en 59 pacientes con migraña episódica y 131 con migraña crónica. La eficacia en el alivio del dolor fue del 62% sin efectos adversos. El número de días de cefalea se redujo de 12 a 9 en pacientes con migraña episódica y de 24 a 16 con migraña crónica32. Recientemente, el estudio abierto SPOUSE33 ha analizado 132 pacientes con migraña (la mayoría episódica). Los pacientes se aplicaron 2 pulsos/12 horas como prevención y 3 pulsos consecutivos en los ataques. El 46% de los pacientes presentaron una reducción superior al 50% en el número de días de cefalea, en el consumo de analgésicos y discapacidad. Sólo 9 pacientes abandonaron el estudio por efectos adversos. La EMT no debe utilizarse en pacientes con epilepsia, defecto óseo craneal, placas metálicas en la cabeza o cuello, marcapasos u otro tipo de estimuladores.
Estimulación no invasiva del nervio vago (ENV)El mecanismo de actuación de la ENV es multifactorial: inhibe la depresión cortical propagada33, actúa sobre el complejo trigémino-cervical34 e inhibe las vías parasimpáticas35 (fig. 3). Por ello, se ha utilizado en la migraña y en la cefalea en racimos (CR).
Migraña. Tratamiento sintomático: se incluyeron 27 pacientes en un estudio abierto36 y se administraron dos estímulos de 90 segundos de duración separados por 15 minutos al inicio del ataque. El 22% de los pacientes estaban libres de dolor a las dos horas y el 43% de los sujetos observaron mejoría. El 46% de los pacientes refirieron efectos adversos no graves36. Recientemente, el ensayo clínico PRESTO37, controlado frente a placebo, ha incluido 243 pacientes que fueron aleatorizados al uso de ENV vs. placebo en los primeros 20 minutos del inicio del dolor, pudiendo repetir la estimulación, si no había mejoría, en 15 minutos. El porcentaje de pacientes libres de dolor fue mayor en el grupo tratado (12%), comparado a placebo (4%) a los 30 minutos, pero no a los 60 minutos (30 vs. 19%). La estimulación fue bien tolerada37.
Tratamiento preventivo. El estudio EVENT38 evaluó la eficacia de la ENV en 30 pacientes con migraña crónica y 29 con estimulación placebo. Se administraron dos estímulos de 90 segundos de duración separados por 5-10 minutos/8 horas. La proporción de pacientes que alcanzó una reducción en el número de días de cefalea superior al 50% fue del 11% a los dos meses, del 25% a los cuatro meses y del 38% a los seis meses. En la fase abierta de ocho meses la reducción del número de días de cefalea fue de -7. El tratamiento fue bien tolerado con adherencia superior al 95% y sin efectos adversos graves38. Recientemente ha finalizado el estudio PREMIUM39, que analizó 332 pacientes sin hallar diferencias. Un análisis post hoc sí halló diferencias en la reducción del número de días de migraña.
Cefalea en racimos (CR). Tratamiento sintomático: el estudio ACT140 incluyó 85 pacientes con CR episódica y 48 con crónica. En CR episódica, la ENV mostró una mejoría clínica vs. placebo en los primeros 15 minutos (34 vs. 10%) y sostenida 15-60 minutos, con buena tolerancia. Sin embargo, este beneficio no se observó en la CR crónica40. En el estudio ACT241, con un diseño similar, incluyendo 27 pacientes con CR episódica y 65 con crónica, se observó igualmente beneficio solo en pacientes con CR episódica.
Tratamiento preventivo: un estudio abierto42 evaluó la eficacia preventiva y seguridad de la ENV en siete pacientes con CR episódica y siete con CR crónica. Se aplicaron estímulos dos veces al día y dosis adicionales para los ataques durante 13 semanas. Trece de los 14 pacientes relataron mejoría de un 60% con buena tolerancia. Siete de ellos redujeron sus analgésicos y los 14 pacientes recomendarían su uso a otros enfermos42.
El estudio PREVA43 aleatorizó 97 pacientes con CR crónica: 48 con tratamiento estándar y además ENV, y 49 únicamente con tratamiento estándar. Se administraron dos estímulos de 90 segundos de duración separados por 5-10 minutos dos veces al día, permitiéndose dosis adicionales para las crisis agudas. Tras cuatro semanas de tratamiento (fase aleatorizada) se observó una reducción significativa del número de crisis semanales en los pacientes tratados con ENV respecto a los de terapia estándar y una reducción en el uso analgésicos. En general el tratamiento fue bien tolerado43.
El dispositivo de ENV se desaconseja en pacientes portadores de marcapasos u otros estimuladores, con aterosclerosis carotidea y sometidos a cirugía de cuello con potencial lesión del nervio vago.
Neuromodulación invasivaNeuromodulación invasiva periféricaNeuromodulación de ramas terminales del nervio trigéminoTécnica. Las ramas terminales del nervio trigémino que se estimulan son el NSO y el nervio infraorbitario. El electrodo subcutáneo se implanta en el correspondiente orificio de salida del nervio en el macizo facial y se comprueba su eficacia antes de emplazar el generador conectado por cableado subcutáneo, aunque también existen dispositivos inalámbricos44.
Eficacia. Se han comunicado en la literatura 40 pacientes sometidos a esta técnica con un grupo heterogéneo de diagnósticos refractarios: neuralgias post-herpéticas, post-quirúrgicas o post-traumáticas45-47, neuralgias del NSO48, dolores faciales no especificados49,50 y cefaleas trigeminoautonómicas51. En estas experiencias (30 prospectivas y 10 retrospectivas) se han utilizado diferentes variables para analizar el dolor, informando un alivio del 50-100% con reducción del uso analgésico45-53. Por último, se han comunicado hasta un 30% de complicaciones, siendo las más frecuentes la migración de electrodo y la infección.
Neuromodulación del tracto trigeminalTécnica. Existen dos abordajes: el primero fue introducido por Shelden54 en 1967 y es semejante a las técnicas de ablación percutáneas de la neuralgia del trigémino (NT). Se basa en la introducción de una aguja de estimulación, habitualmente un electrodo monopolar cilíndrico, bajo control fluoroscópico, a través del agujero oval para acceder a la fosa gasseriana. El segundo fue introducido por Meyerson55 en 1980 y consiste en un abordaje subtemporal mediante craneotomía, suturando un pad con dos electrodos a la duramadre que envuelve el ganglio de Gasser conectados por cableado a un generador que se ubica a nivel subclavicular.
Eficacia. Se han publicado cinco estudios y pequeñas series incluyendo 365 pacientes54-66. Una revisión65 ha incluido 233 de estos pacientes y ha mostrado una reducción inicial del dolor del 50% en un 80-92% de pacientes, pero decae en torno a un 48% en un seguimiento superior a cuatro años. Debido a esta baja eficacia, la indicación de estimulación del tracto trigeminal no se contempla en el tratamiento de la NT. Se han descrito complicaciones en un 30% de pacientes, generalmente infección.
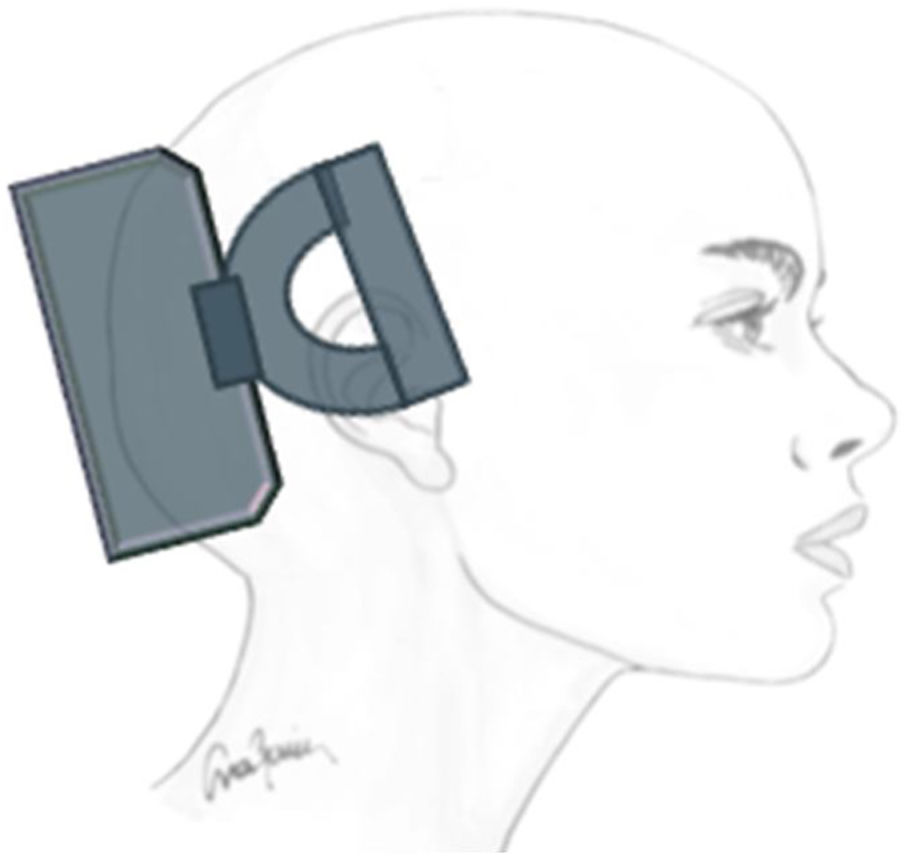
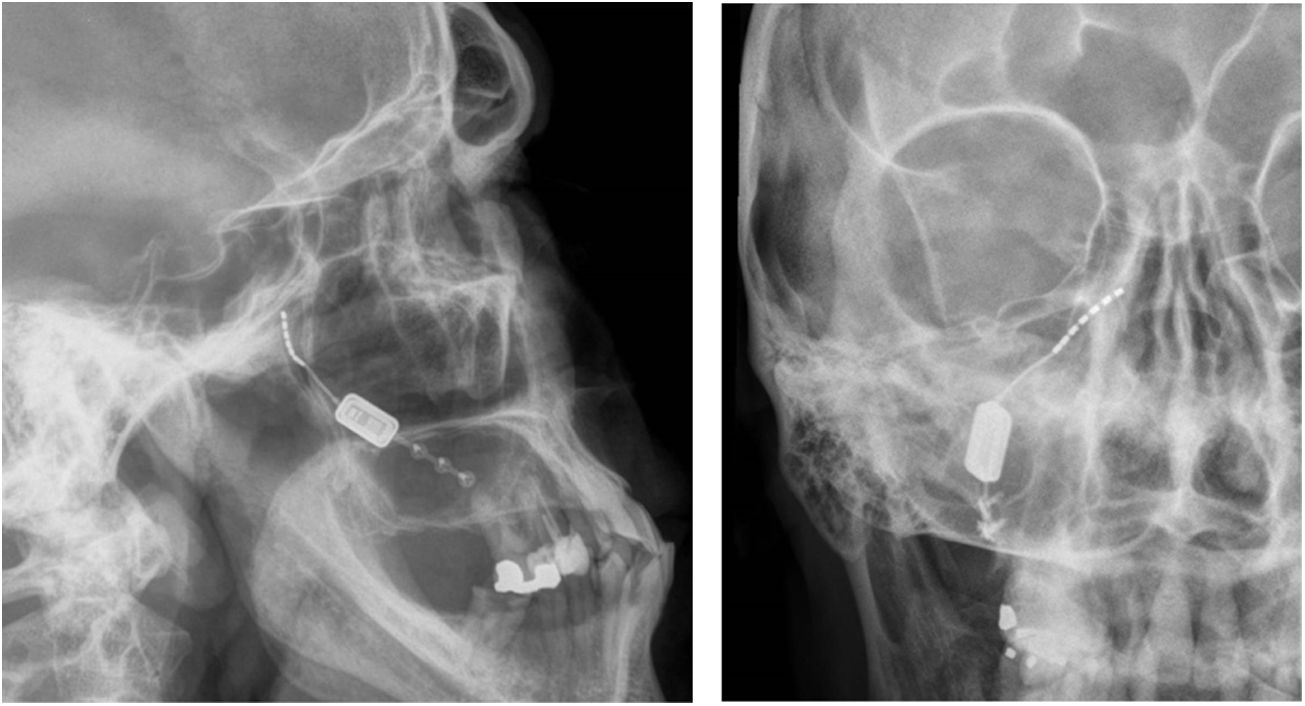
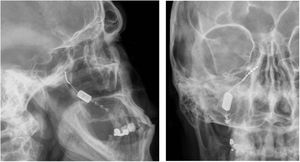
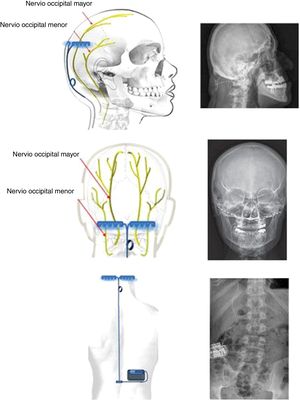
Neuromodulación del ganglio esfenopalatino ipsilateralLas experiencias iniciales de estimulación del ganglio esfenopalatino (GEFP) ipsilateral al dolor en la cefalea en racimos (CR) con electrodos no implantados17,67, mostraron eficacia en un 61% de pacientes. Posteriormente, se diseñó un microestimulador implantable en el GEFP que se coloca previo análisis radiológico de la fosa pterigopalatina con tomografía axial computerizada68 y profilaxis antibiótica. El abordaje es transoral utilizando una incisión gingival mínimamente invasiva69 con anestesia general e ingreso de 24 horas. Puede utilizarse navegación70 y, finalmente, se realiza una radiografía simple para verificar su posicionamiento (fig. 4).
Radiografías, perfil y posteroanterior, mostrando un dispositivo de neuroestimulación inalámbrico implantado en la fosa pterigopalatina en un paciente con cefalea en racimos crónica refractaria ipsilateral (cortesía del Dr. José Miguel Láinez, Hospital Clínico Universitario, Valencia).
El estimulador se activa mediante un mando inalámbrico que se aproxima a la mejilla y en el que esta insertada la batería, por lo que no se requiere cableado, ni generador subcutáneo, ni recambios quirúrgicos de baterías.
Eficacia. El estimulador fue diseñado originalmente para abortar las crisis de CR, pero posteriormente se observó también un efecto preventivo.
Eficacia como tratamiento sintomático. El ensayo Pathway Ch119 incluyo 28 pacientes con CR con criterios de selección consensuados71. Se ha publicado un estudio de seguimiento a largo plazo de 2 años72,73 y se ha iniciado un registro74. Son los estudios Pathway Ch2 y Pathway R1.
En el ensayo Pathway Ch119 los pacientes fueron aleatorizados en tres grupos de estimulación: completa, subóptima y falsa. Concluyeron el estudio 28 pacientes, con una media de estimulación de 11 minutos. Un 67% de los pacientes experimentaron una reducción del dolor a los 15 minutos (34% con resolución completa), mientras que solo mostraron esta mejoría el 7% de pacientes del grupo de subóptima y un 7% de los de falsa. Esta eficacia es semejante a la de sumatriptan subcutáneo, fármaco de primera línea en las crisis de CR. De hecho, un estudio de seguimiento de 71 pacientes durante un año muestra que se reduce un 51% el consumo analgésico y un 41% el de preventivos, suponiendo un ahorro anual de 7.484 euros75.
Eficacia preventiva. Se produjo una reducción de más del 50% de los ataques de CR en el 43% de los pacientes tras un mes. Asimismo, se redujo el consumo analgésico y mejoraron las escalas de calidad de vida. En los dos estudios de seguimiento de dos años en los que se trataron más de 18.000 crisis de CR, la eficacia como tratamiento sintomático de las crisis de CR se mantuvo en un 65-68% y la preventiva en un 55%72-74. Los resultados del estudio Pathway Ch2 fueron presentados en el congreso de la American Headache Association del año 2018, pero no han sido publicados al cierre de la edición de la presente guía. Este estudio con 99 pacientes confirmaba los datos de eficacia descritos en el estudio Pathway Ch1.
Seguridad. El ensayo Pathway Ch1 registró 128 efectos adversos, siendo el 92% leves18. En ocho pacientes (16%) se tuvo que retirar o revisar el dispositivo por dolor por afectación del nervio maxilar, migración del estimulador, mal posicionamiento del electrodo e infección quirúrgica.
En total, la tasa de reoperación fue del 18%. Esta cifra se ha mejorado sensiblemente en los estudios posteriores18,71-85. Los síntomas sensitivos (parestesias, disestesias) fueron los más frecuentes, 81% de los pacientes, desapareciendo en más de un 60% en un año. Otros efectos adversos poco frecuentes fueron trismus, sequedad ocular, conjuntivitis, infección local, hinchazón, hematoma. A pesar de ello, el 92% de los pacientes afirmó que volvería a someterse al procedimiento71-85. Los dos estudios posteriores71-74, al ensayo Pathway Ch1 mostraron una tasa de efectos adversos semejante, pero no se observaron casos de migración del dispositivo y solo ocho pacientes (10%) se sometieron a una nueva revisión quirúrgica.
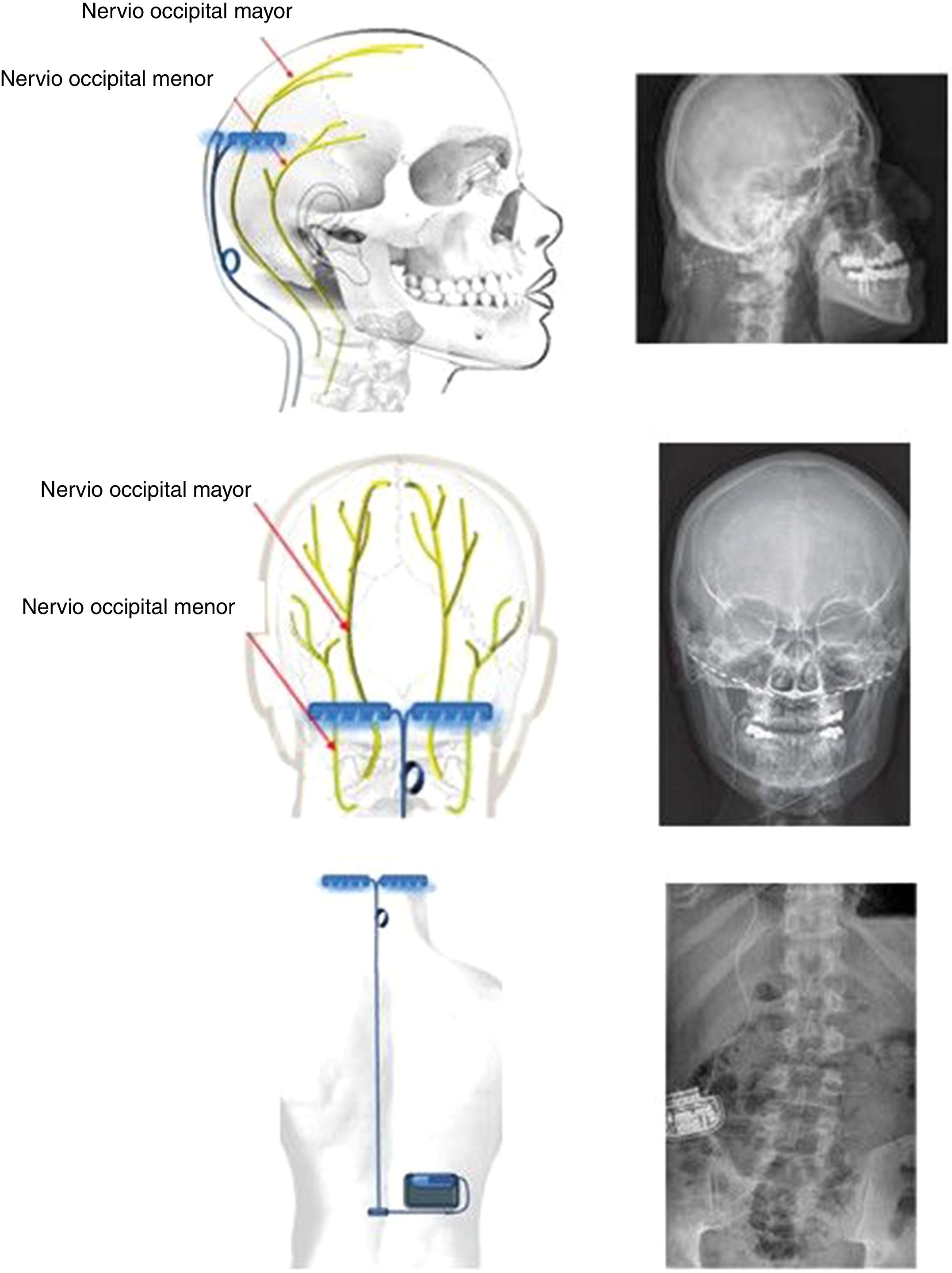
Neuromodulación bilateral de los nervios occipitalesPuede parecer paradójico que implantar electrodos en nervios occipitales sea terapéutico en una cefalea como la CR, que es claramente ocular-periocular, es decir, anterior y con origen central. Sin embargo, estudios en animales y en humanos han demostrado una convergencia entre las fibras aferentes de la pars caudalis del núcleo del nervio trigémino y el núcleo del nervio occipital mayor (NOM) a nivel cervical, concretamente C2. Esta teoría ya fue postulada por Kerr86 en 1961: The trigeminal and cervical volleys y, actualmente, a esta área se la conoce como complejo trigémino-cervical. Concretamente, se ha constatado en animales que la estimulación del NOM aumenta el metabolismo del complejo trigeminocervical87. Adicionalmente, el bloqueo del NOM en humanos disminuye la respuesta R2 del blink reflex trigeminal88. Cabe decir que estudios con PET, antes y después de implantar el estimulador del NOM en pacientes con CR, muestran que se normalizan múltiples áreas cerebrales hipermetabólicas tras la implantación, excepto una, el hipotálamo89. Por ello, este dispositivo de estimulación muestra un papel relevante en la prevención, pero no en el tratamiento de las crisis de CR. Por otra parte, ante la posibilidad de un cambio de lateralidad en la evolución de la enfermedad (descrito en un 36% de pacientes)90,91 y dado que es una cirugía extracraneal, resulta aceptable colocar adicionalmente un electrodo en el NOM contralateral al dolor.
Técnica. Se realiza una incisión vertical de 1 cm por encima y por debajo de la protuberancia occipital en la línea media con el paciente en decúbito prono. A continuación, se practican dos incisiones verticales bilateralmente a 4 cm de la línea media y se expone la fascia muscular insertando los dispositivos a nivel del hueso occipital extracranealmente, mediante placas horizontales que sujetan los electrodos (fig. 4). Dichas placas de sujeción se sitúan por encima del NOM y del nervio occipital menor, estimulando a ambos. El cableado se tuneliza subcutáneamente por la línea media cervical hasta un nivel medio dorsal. Desde allí, se dirigen al área glútea superior, donde se emplaza subcutáneamente el generador. El cableado se adapta a las medidas del paciente y se deja un «tirabuzón» deslizable para evitar la desconexión de cables ante posturas cervicales forzadas (fig. 5). Cabe decir que también se pueden implantar los electrodos percutáneamente sobre la fascia muscular occipital y existen varias técnicas y sistemas descritos: tipos, dirección y número de electrodos; así como emplazamientos anatómicos del generador.
Eficacia. Actualmente, se han comunicado en la literatura más de 200 pacientes con CR tratados con estos dispositivos de los que el 85% son bilaterales14,19,92-108. Se ha descrito una eficacia del 65-78% en la reducción del número de ataques superior al 50%, y un 10-40% de los pacientes logra pasar de CR crónica a CR episódica. Incluso se ha informado de periodos largos pain-free hasta en un 60% de pacientes92-108. No obstante, en ninguno de los estudios comunicados existe un grupo control de falsa estimulación o aleatorización con un grupo de pacientes tratado con fármacos y ello es debido a que el estimulador conectado induce parestesias por lo que el paciente sabe cuándo está en funcionamiento. Un metaanálisis109 ha incluido ocho de estos estudios abiertos con una muestra de 96 pacientes, mostrando una tasa de respondedores del 34-71% y una reducción de ataques semanales del 29% en un seguimiento de uno a tres años.
En los estudios de seguimiento a largo plazo el 80-100% de los pacientes continúa con fármacos preventivos, pero el 66% ya no requiere corticoides103-108.
Por otra parte, los factores predictivos de mala respuesta parecen ser: depresión/ansiedad grave y presencia de dolor occipital en el área C2-C3, previa a la implantación110,111. Se había propuesto el bloqueo anestésico del NOM como factor predictivo de eficacia, pero tres estudios muestran que no es un método fiable de selección112.
Está en marcha el ensayo ICON113, prospectivo aleatorizado, doble ciego, multicéntrico e internacional, con grupos paralelos para valorar la eficacia del estimulador occipital en la prevención de la CR.
Además de los pacientes con CR, 81 pacientes más con otras cefaleas trigeminoautonómicas se han sometido a este procedimiento con diagnóstico de SUNCT (60), hemicránea continua (18) y SUNA (3). En el SUNCT se ha informado de una eficacia preventiva del 77%, mantenida en 44 meses de seguimiento y con reducción de la intensidad del dolor de 4 puntos114-116. Por otra parte, también se ha probado la estimulación de los nervios occipitales en la migraña y en la neuralgia del NOM.
En la migraña se han aleatorizado un total de 263 pacientes en tres ensayos clínicos controlados117-119, en los que se ha observado una mejoría de la mayoría de las variables secundarias, pero no de la primaria, por lo que su eficacia preventiva o aún no ha sido fehacientemente demostrada a pesar de que estudios abiertos no controlados15,120 muestran resultados positivos. Por lo tanto, actualmente no hay evidencias que permitan recomendar su uso en pacientes con migraña.
En la neuralgia occipital, se han comunicado 107 experiencias en casos individuales o series abiertas, la mayor de 76 pacientes, que muestran una eficacia en el control del dolor del 50-85%. Un metaanálisis ha evaluado nueve estudios con esta indicación y ha conferido un nivel de evidencia III13,121-127.
Al igual que en el GEFP, también se diseñó un pequeño neuroestimulador sin cableado, implantado en el área occipital con resultados prometedores en CR, migraña y hemicránea, que continua en estudios preliminares114,128-130. Desafortunadamente, el desarrollo de este prototipo se ha detenido.
Seguridad. Se han descrito, como efectos adversos parestesias en el cuero cabelludo (100%) e infección (5%)92-108,131. Dos estudios de seguimiento superior a 10 años muestran una buena tolerancia a los efectos adversos cuando son persistentes. De hecho, solo un 25% de las parestesias se describen lo suficientemente molestas como para tener que modificar los parámetros de estimulación92-108,131. Tras la modificación, la inmensa mayoría de estas parestesias desaparecen. Solo se ha comunicado dos pacientes en los que tuvo que retirarse el dispositivo por esta causa.
Un registro MAUDE norteamericano132 ha analizado la seguridad en una muestra estimada de 11.000 dispositivos implantados en 10 años. Las complicaciones operatorias fueron inferiores al 3% y no se ha informado ningún caso de muerte. El porcentaje de complicaciones es del 11% con la migración del electrodo como más frecuente seguida de la infección del dispositivo, mal funcionamiento, rotura y desconexión del electrodo.
Los pacientes deberán someterse inexorablemente a nuevas cirugías de recambio de baterías, cuando no son recargables, que durarán más o menos tiempo en función de la frecuencia e intensidad de la estimulación requerida para controlar el dolor, ocurriendo en el 65% de los pacientes en una media de seis años de seguimiento92-108. El 100% de los pacientes refieren empeoramiento cuando se agotan las baterías. Finalmente, un 66-100% de los pacientes recomendarían este sistema a otro paciente.
Neuroestimulación invasiva centralNeuromodulación medularTécnica: se realiza una incisión en la línea media cervical y se expone la vértebra. Los electrodos se introducen a través de una laminectomía vertebral y se implantan en el espacio epidural medular cervical alto (C2-C3) mediante control fluoroscópico. Por lo demás, el cableado y emplazamiento del generador es semejante al estimulador de los nervios occipitales.
Eficacia: se han comunicado 76 experiencias en la literatura. Se han tratado ocho pacientes con CR informando en un 71% de ellos una eficacia en la reducción del dolor superior al 50%133,134 y 35 pacientes con migraña con una eficacia del 50-71%134-136. Además, se han tratado con eficacia 17 neuropatías trigeminales dolorosas137-139, 7 neuralgias occipitales139, 5 neuropatías post-herpeticas139, 2 SUNA134 y 2 cefaleas cervicogénicas140,141.
Seguridad: se ha informado infección, migración del electrodo y en un 3% de casos, fugas de LCR.
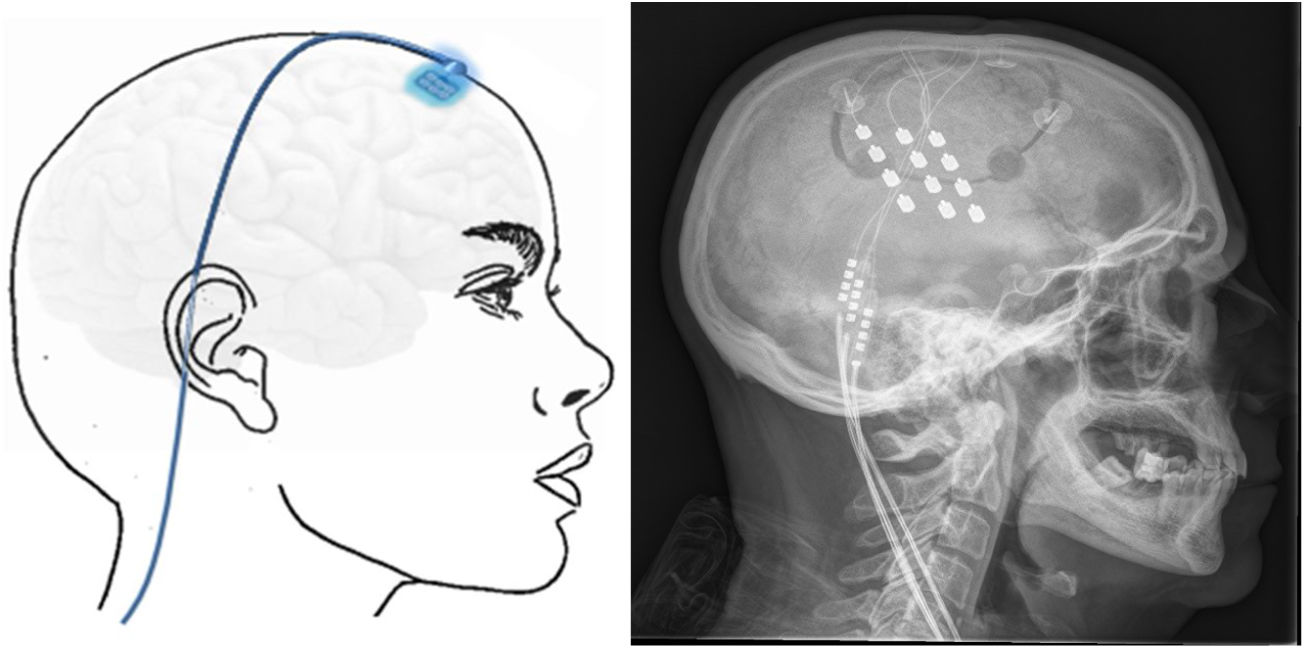
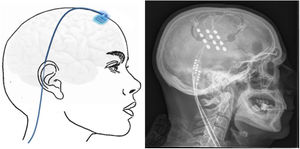
Neuromodulación cerebral transcorticalTécnica: se localiza el área del dolor facial mediante RM, anterior a la cisura de Rolando, a nivel del surco frontal inferior. Con estos datos, el neuronavegador guiará la craneotomía bajo anestesia local o general. Después, se localiza el área de la mano mediante potenciales evocados intraoperatorios. Los electrodos, generalmente cuatro, inicialmente se implantaban a nivel subdural, pero en la actualidad, se sitúan a nivel epidural para evitar complicaciones (fig. 6). Tras verificar el correcto emplazamiento del dispositivo y el funcionamiento de la estimulación, se conectan los electrodos a un generador subclavicular mediante tunelización subcutánea del cableado142-145.
Esquema mostrando electrodos implantados en el área cortical motora a través de un orificio de trepanación frontal y cableado subcutáneo. A la derecha, radiografía craneal postcirugía que muestra los electrodos implantados en el córtex motor en un paciente con neuralgia del trigémino contralateral refractaria secundaria a esclerosis múltiple.
Eficacia: se han comunicado 106 experiencias en seis estudios, la mayoría retrospectivos y ninguno con muestras superiores a 20 pacientes. Presentaban múltiples diagnósticos refractarios: NT refractaria a cirugía o secundarias a esclerosis múltiple o postraumática, neuropatía trigeminal dolorosa, dolor facial de causa central, dolor por desaferentización. La eficacia se estima en un 50-100% en un seguimiento de 3-40 meses142-149.
Seguridad: como complicaciones, al margen de los puramente quirúrgicos, se han descrito convulsiones relacionadas con la intensidad de la estimulación (12%) y alteraciones cognitivas142-149.
Neuromodulación cerebral profundaNeuromodulación hipotalámicaLa neuromodulación hipotalámica es una técnica quirúrgica de estimulación cerebral profunda (ECP) en los pacientes con CR refractaria; se realiza implantando un electrodo en el hipotálamo posterior inferior, ipsilateral al dolor, conectado mediante un cableado a un generador implantado en el área paraumbilical o infraclavicular.
A finales de los años 90 se descubrió que el hipotálamo posterior se activa durante el ataque de CR de forma ipsilateral y especifica en estudios de f-RM y de PET cerebrales150, pues la activación del hipotálamo no se observa durante el ataque de migraña ni en los brotes de NT. Además, estudios de post-procesado de RM cerebral muestran que la sustancia gris hipotalámica presenta un aumento de densidad y volumen del hipotálamo posteroinferior151. Por estos motivos, el hipotálamo es la actual diana de la ECP en la CR152-154. Cabe decir que se han propuesto nuevas dianas: el área tegmental ventral mesencefálica, la pared lateral del tercer ventrículo o electrodos flotantes que estimulan el suelo del tercer ventrículo155-160.
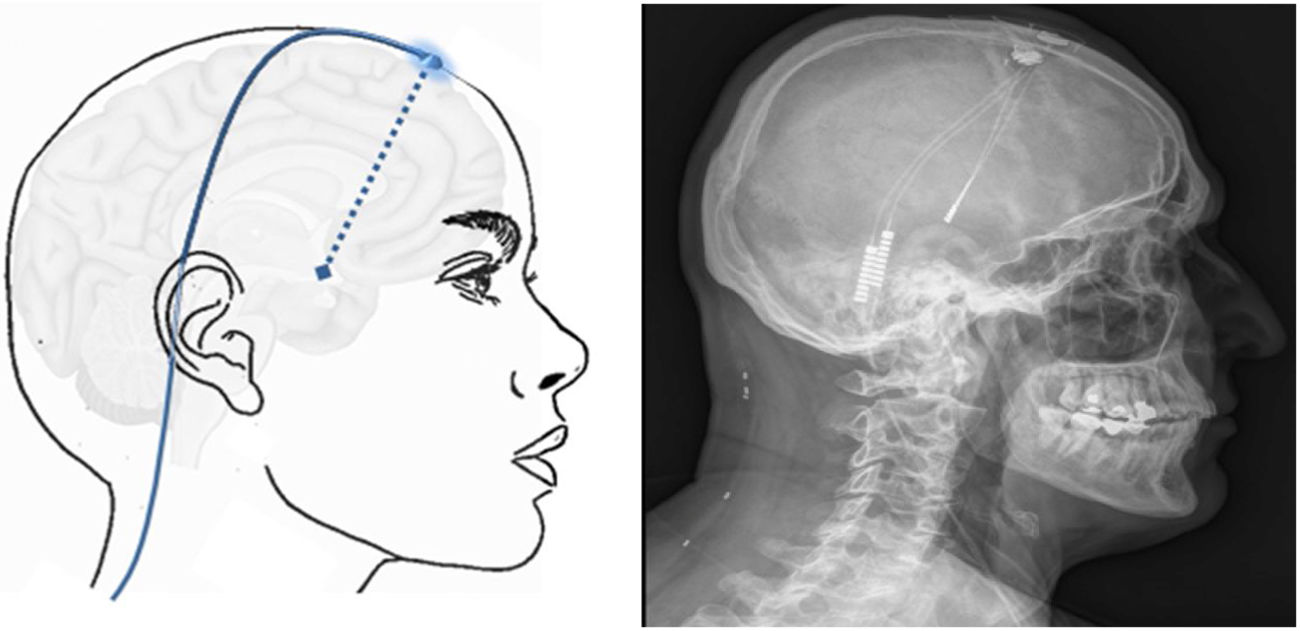
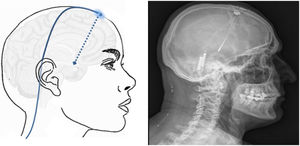
Técnica: la cirugía se realiza en pacientes seleccionados con criterios estrictos161 y se inicia mediante la colocación de un marco de estereotaxia y, posteriormente, se realiza una TC craneal, donde se ubican marcas de estereotaxia que localizan el hipotálamo. A continuación, se fusionan las imágenes obtenidas con la TC craneal con la RM cerebral realizada previamente en neuronavegador, obteniendo el mejor punto de entrada y trayecto para dirigir el electrodo a la diana. El electrodo se inserta en la diana a través de un orificio frontal de trepanación (fig. 7) y se tuneliza subcutáneamente el cableado desde el orificio de trepanación hasta el área paraumbilical o infraclavicular, donde se coloca el generador.
Esquema mostrando el electrodo implantado en el hipotálamo (flecha azul discontinua) a través de un orificio de trepanación frontal y cableado subcutáneo. A la derecha TC craneal post-cirugía que muestra el electrodo implantado en el hipotálamo en un paciente con cefalea en racimos crónica refractaria izquierda.
Eficacia: se han informado más de 100 pacientes con CR tratados con ECP. El mayor de los estudios (19 pacientes)161-164 informó una eficacia del 70% en la reducción de más del 50% de días de CR en un seguimiento medio de casi 9 años llegando a estar libres de dolor un 30%, pudiendo apagar el estimulador casi todos estos pacientes; y solo un 29-34% no experimentaron una mejoría siendo la CR bilateral el principal factor de ineficacia hasta en un 80%14,108,161-180. Sólo se ha comunicado un estudio que realizó una comparación con estimulador encendido/apagado en 11 pacientes, mostrado una eficacia del 60% en 10 meses de seguimiento177.
Adicionalmente, se han sometido a ECP nueve pacientes más: SUNCT (3), hemicránea paroxística (1), CR secundaria (1) y NT secundaria a esclerosis múltiple (5)181-188.
Seguridad: se ha informado una muerte operatoria (1%) por hemorragia cerebral14,108,161-188. Como efectos adversos relacionados con el estimulador se han descrito: mal posicionamiento y desplazamiento del electrodo, hemorragia no mortal del tercer ventrículo e infección, siendo ésta última la complicación más frecuente. Otros efectos adversos infrecuentes son: crisis epiléptica, diplopia, ansiedad, AIT, temblor, distonía, cambios de sed y apetito y sincope. A diferencia de otras cirugías de ECP en otras patologías, en la CR no se han descrito alteraciones cognitivo-conductuales189.
Neuromodulación talámicaSe han comunicado 91 experiencias de ECP con el tálamo como diana en pacientes y suelen corresponder a casos de NT secundaria a esclerosis múltiple, neuropatía trigeminal dolorosa post-herpética, dolor neuropático central post-ictus, dolor facial por desaferentización y dolor facial idiopático persistente. En otras ocasiones, se habla de NT intratable, sin especificar los tratamientos farmacológicos y quirúrgicos previos. La diana habitual es el núcleo ventroposteromedial del tálamo y, en otras ocasiones, la sustancia gris periventricular/periacueductal, pudiéndose realizar estimulación de ambos (estimulación dual). En el dolor de la primera rama del nervio trigémino, se puede seleccionar como diana el hipotálamo posterior, como en la CR. A pesar de la heterogeneidad de las entidades incluidas, procedimientos, dianas y seguimientos, podemos concluir que la eficacia en la reducción del dolor es del 37-85% en un seguimiento de 1-30 meses190-194.
ConclusionesLas técnicas de neuromodulación tienen que reservarse estrictamente a los pacientes con cefaleas y neuralgias craneofaciales refractarias a tratamientos farmacológicos, por lo que antes de plantear su indicación, un neurólogo experto en cefaleas y neuralgias tendrá que asegurar que el paciente ha agotado las terapias farmacológicas a las dosis óptimas y durante el tiempo necesario.
En el caso de la migraña195 y de la CR196 está consensuado el estado de refractariedad farmacológica, no así en otras entidades. Afortunadamente, el número de pacientes que llegan a un estado de refractariedad farmacológica no es elevado: migraña 5%197, CR 10%198 o NT 12%199. Por esta razón, los tamaños de muestra de los estudios de neuromodulación son pequeños en números absolutos, pero no en números relativos. Por ejemplo, el tamaño de muestra mínimo requerido en un estudio de migraña para poder extrapolar resultados a la población con potencia estadística es 10 veces superior que el de un estudio de CR, pues la migraña afecta al 12% de la población200 y la CR tan sólo al 0,1%201.
Por otra parte, ante escenarios de dolor tan grave y discapacitante, es éticamente controvertido plantear estudios comparando estimulador conectado con desconectado. De todo ello se desprende que las evidencias que suministran los estudios de neuromodulación sean mayoritariamente de nivel III y IV (tabla 4). No obstante, los estudios con fármacos presentan estas mismas limitaciones en algunas enfermedades como la CR o la NT, ya que prácticamente no existen estudios controlados con placebo.
Niveles de evidencia y grados de recomendación de la neuromodulación en diferentes cefaleas y neuralgias craneofaciales empleando los criterios para actuaciones terapéuticas de la Guía Oficial de Práctica Clínica en Cefaleas de la Sociedad Española de Neurología 201520
| Técnica de neuromodulación | Entidad y estrategia terapéutica | Nivel de evidencia | Grado de recomendación | |
|---|---|---|---|---|
| Estimulación transcutánea del nervio supraorbitario | Migraña | Tratamiento sintomático | II | B |
| Prevención | II | B | ||
| Estimulación magnética transcraneal de pulso simple | Migraña: | Tratamiento sintomático | II | B |
| Prevención | III | B | ||
| Estimulación no invasiva del nervio vago | Migraña: | Tratamiento sintomático | II | A |
| Prevención | II | B | ||
| Cefalea en racimos | Tratamiento sintomático | I | B | |
| Prevención | II | A | ||
| Estimulación invasiva de las ramas terminales del nervio trigémino | Prevención en neuralgia del trigémino, neuropatía trigeminal dolorosa, dolor facial idiopático persistente. | IV | C | |
| Estimulación invasiva del tracto del nervio trigémino | Prevención en neuralgia del trigémino, neuropatía trigeminal dolorosa, dolor facial idiopático persistente. | IV | C | |
| Estimulación invasiva del ganglio esfenopalatino | Cefalea en racimos | Tratamiento sintomático | II | A |
| Prevención | III | B | ||
| Estimulación invasiva de los nervios occipitales | Neuralgia occipital. Prevención | III | B | |
| Cefalea en racimos Prevención | III | B | ||
| Otras CTA. Prevención. | IV | C | ||
| Estimulación medular cervical | Prevención en cefalea en racimos, migraña, neuralgia del trigémino, neuropatía trigeminal dolorosa, dolor facial idiopático persistente. | IV | C | |
| Estimulación cerebral transcortical | Prevención en neuralgia del trigémino, neuropatía trigeminal dolorosa, dolor facial idiopático persistente. | IV | C | |
| Estimulación cerebral profunda hipotalámica | Cefalea en racimos. Prevención | II | B | |
| Otras CTA. Prevención. | IV | C | ||
| Estimulación cerebral profunda talámica | Prevención en neuralgia del trigémino, neuropatía trigeminal dolorosa, dolor facial idiopático persistente. | IV | C | |
CTA: cefaleas trigémino-autonómicas.
El neurólogo puede indicar la neuromodulación no invasiva pero, en el caso de la invasiva, es recomendable organizar comités multidisciplinarios integrados por neurólogos expertos en cefaleas y neuralgias, neurocirujanos, neurradiólogos y anestesistas de clínica del dolor para debatir la indicación. Así mismo, es muy difícil que un equipo quirúrgico consiga una morbimortalidad óptima operando exclusivamente en pacientes con cefaleas y neuralgias craneofaciales refractarias. Por ello, es aconsejable que estos pacientes se sometan a técnicas de neuromodulación invasiva con equipos quirúrgicos que hayan superado la curva de aprendizaje en neuromodulación acumulada en otras enfermedades: epilepsia, trastornos del movimiento o enfermedades psiquiátricas. Finalmente, la European Headache Federation202 recomienda que los pacientes refractarios al tratamiento farmacológico sigan un itinerario quirúrgico108, comenzando siempre por la técnica quirúrgica de neuromodulación de menor riesgo, posicionando la estimulación cerebral profunda como el último procedimiento a seguir.
FinanciaciónEsta guía no ha recibido ningún tipo de financiación pública ni privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Agradecemos a la Sra. Eva García Fernández las ilustraciones realizadas para la presente guía.