Hasta la fecha, Colombia no cuenta con un servicio especializado de medición de concentraciones séricas de antifúngicos, procedimiento esencial para el adecuado manejo del tratamiento de las infecciones invasivas por hongos.
ObjetivosEstandarizar y validar un protocolo simple, sensible y específico, basado en la cromotografía líquida de alta eficiencia, que, cumpliendo con los parámetros recomendados por la Food and Drug Administration, permita detectar y cuantificar concentraciones séricas de posaconazol.
MétodosSe usó un equipo de cromotografía líquida de alta eficiencia Agilent, serie 1200, con detector ultravioleta de matriz de diodos y columna analítica Eclipse-XDB-C18. Como estándar primario se utilizó posaconazol SCH56592 (lote IRQ-PAZ-10-X-103), y como control interno, itraconazol (lote ZR051211PUC921). La validación se hizo teniendo en cuenta los parámetros recomendados por la Food and Drug Administration (selectividad, curvas de calibración, recuperación, exactitud, precisión, sensibilidad, reproducibilidad y estabilidad de la muestra) para este tipo de métodos.
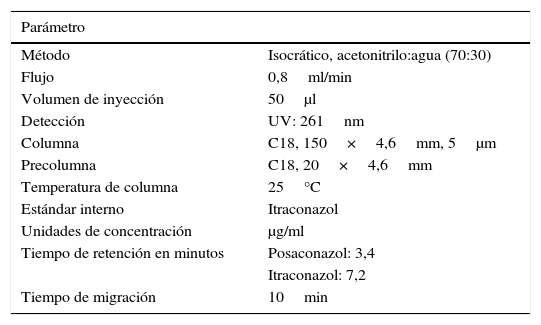
ResultadosLos parámetros cromatográficos más adecuados fueron los siguientes: temperatura de la columna, 25°C; detección ultravioleta, 261nm; volumen de inyección, 50μl; flujo, 0,8ml/min; tiempo de migración, 10min; fase móvil, acetonitrilo:agua (70:30). Los tiempos de retención finales fueron de 3,4 y 7,2min para posaconazol e itraconazol, respectivamente, con un rango de cuantificación amplio y confiable, desde 0,125 hasta 16μg/ml. Bajo estas condiciones el método fue selectivo, el R2 de las curvas de calibración fue≥0,99 y el porcentaje de recuperación fue del 98,7%, con un porcentaje del coeficiente de variación inferior al 10%. El porcentaje de error relativo en la exactitud, así como el porcentaje del coeficiente de variación en la precisión, fueron inferiores al 15%, cumpliendo así con los criterios de aceptación recomendados por la Food and Drug Administration.
ConclusionesLa selectividad y pureza de la señal cromatográfica obtenida, así como los límites de detección y cuantificación estandarizados, hacen de esta metodología una excelente herramienta para el seguimiento terapéutico de los pacientes bajo tratamiento con posaconazol.
Colombia currently does not have a specialised service for measuring antifungal levels in serum, which is of prime importance for the proper treatment and correct management of invasive fungal infections.
AimsTo standardise and validate a simple, sensitive, and specific protocol, based on high performance liquid chromatography, complying with the parameters recommended by the Food and Drug Administration, to detect, identify, and quantify serum concentrations of posaconazole.
MethodsA high performance liquid chromatography Agilent series-1 200 equipment was used with ultraviolet diode array detector and analytical column-Eclipse XDB-C18. Posaconazole-SCH56592 (batch IRQ-PAZ-10-X-103) was used as the primary control and itraconazole (batch ZR051211PUC921) was used as an internal control. The validation was performed taking into account all criteria recommended by the Food and Drug Administration (selectivity, calibration curves, recovery, accuracy, precision, sensitivity, reproducibility, and stability of the sample).
ResultsThe most suitable chromatographic conditions were the following: column temperature 25°C, ultraviolet detection at 261nm, 50μl injection volume, flow volume 0.8ml/min, 10min running time, mobile phase of acetonitrile:water (70:30), and final retention times of 3.4 and 7.2min for posaconazole and itraconazole, respectively, with a wide and reliable quantification range (0.125μg/ml to 16μg/ml). Using these parameters, the method was selective, R2 in the calibration curves was≥0.99, and the percentage recovery was 98.7%, with a coefficient of variation less than 10%. The relative error for accuracy and the coefficient of variation for precision were less than 15%, all meeting the acceptance criteria recommended by the Food and Drug Administration.
ConclusionsThe selectivity and chromatographic purity of the obtained signal, as well as the standardised limits of detection and quantification, make this method an excellent tool for therapeutic monitoring of patients treated with posaconazole.
Desde hace más de una década se viene observando un alarmante aumento en la incidencia de las infecciones fúngicas invasivas (IFI) causadas tanto por hongos filamentosos como por levaduras. Dicho aumento responde al creciente número de pacientes inmunosuprimidos, principalmente pacientes infectados por el virus de la inmunodeficiencia humana, trasplantados, o personas bajo quimioterapia o siguiendo algún tipo de terapia inmunosupresora5,17. Paralelamente a este aumento de casos de IFI, y más preocupante aún, son los continuos reportes de aislamientos de hongos resistentes a varios de los antifúngicos disponibles en el mercado2,9,15.
Entre los antifúngicos utilizados para el tratamiento de las IFI se encuentra el posaconazol, un derivado azólico aprobado por la Food and Drug Administration (FDA) en el año 2006 para su uso en personas10; este antifúngico es indicado como tratamiento profiláctico para infecciones invasivas por especies de Aspergillus y Candida, tanto en pacientes sometidos a procesos de inmunosupresión como en aquellos con malignidades hematológicas o neutropenia debido a quimioterapia12,20,21,23. Igualmente, diferentes estudios en fase iii han demostrado que el posaconazol es efectivo para el tratamiento de la candidiasis esofágica, incluidas aquellas refractarias a los azoles, así como en el tratamiento de IFI refractarias a otros antifúngicos12. En Colombia el posaconazol es usado cada vez más como profilaxis antifúngica en pacientes sometidos a trasplante de médula ósea, así como en aquellos con diagnóstico de leucemia mieloide aguda; igualmente, este antifúngico es usado como tratamiento en infecciones refractarias causadas por algunos hongos filamentosos.
El mecanismo de acción del posaconazol consiste en inhibir la síntesis del ergosterol mediante su unión a la enzima lanosterol-14α-desmetilasa, presente en la mayoría de los hongos. Debido a que su estructura química es diferente a la del fluconazol y el voriconazol10, este antifúngico puede interactuar fuertemente con otros dominios de la enzima diana, teniendo incluso efecto sobre cepas mutantes resistentes a otros azoles13; lo anterior hace del posaconazol el antifúngico azólico más potente que se encuentra disponible actualmente en el mercado12.
Debido a su estructura lipofílica, el posaconazol debe ser suministrado después de haber ingerido alimentos preferiblemente ricos en grasa, lo que incrementa la absorción respecto a su administración en ayunas; la concentración plasmática máxima se alcanza tras 5-8h7. La dosis terapéutica del posaconazol recomendada para el tratamiento de las IFI es de 800mg/día, que deben suministrarse en dos dosis de 400mg cada 12h o cuatro dosis de 200mg cada 6h. Los valores de referencia en sangre considerados eficaces están entre 0,7 y 1μg/ml, y no se han publicado concentraciones séricas asociadas a toxicidad6,16,18. Su vida media es de 35h y la concentración en equilibrio se puede alcanzar después del séptimo día14.
El escaso metabolismo del posaconazol se da predominantemente a través de la vía uridin-difosfato-glucuronil-transferasa, y no por enzimas del sistema citocromo P450, aunque sí tiene la capacidad de inhibir el sistema CP3A4, por lo que puede presentar problemas de interacciones medicamentosas16. Al igual que para todos los medicamentos antimicrobianos, durante la terapia antifúngica es necesario que el posaconazol alcance concentraciones sanguíneas adecuadas para evitar posibles fallos en el tratamiento debido a esta causa, más aún si se tiene en cuenta la alta variabilidad farmacocinética entre pacientes reportada para este antifúngico19. En este sentido, se recomienda que, independientemente de la presentación y la vía de administración del posaconazol, se realice constantemente una monitorización terapéutica del medicamento. Algunos autores plantean que la medición de las concentraciones sanguíneas alcanzadas desde el inicio de la terapia podrían dar una pista de cómo de eficientes son las concentraciones séricas11. Algunos investigadores han justificado incluso la importancia de realizar esta monitorización en pacientes bajo terapia profiláctica, lo que permitiría al médico tomar decisiones oportunas que lleven, en caso de ser necesario, al uso de un tratamiento profiláctico alternativo1.
Aun siendo recomendable y necesario, actualmente no se encuentra disponible en Colombia un servicio para la determinación de las concentraciones sanguíneas de posaconazol en pacientes bajo tratamiento, lo que posiblemente expone a estos a terapias ineficientes que generan complicaciones clínicas, prolongaciones innecesarias de hospitalización y posibles sobrecostes al sistema de salud. En el mejor de los casos el médico envía muestras clínicas al exterior, con los costes que ello implica y el tiempo que estos procedimientos consumen. Por todo lo anterior, el objetivo de este estudio fue estandarizar y validar en Colombia un método bioanalítico por cromotografía líquida de alta eficiencia (HPLC) para la determinación y cuantificación de posaconazol en suero humano, cumpliendo con todos los criterios de aceptación de los parámetros recomendados por la FDA8. Este método fue desarrollado previamente por Cendejas-Bueno et al. en el año 20123.
Materiales y métodosEstándares y reactivosComo producto estándar se utilizó posaconazol (SCH56592) 100% puro, lote IRQ-PAZ-10-X-103, de Merck Sharp & Dohme Corporation™. Como control interno se utilizó itraconazol 99,5% puro, lote ZR051211PUC921, de Janssen Pharmaceutica™. Estos antifúngicos fueron diluidos en dimetilsulfóxido (DMSO) (referencia 445103, Carlos Erba™). Para el tratamiento y análisis de las muestras se utilizó acetonitrilo grado HPLC (referencia 1.00030.5000, Merck™), agua tipo 1 (equipo Milli Q Direct 16, Millipore™) y filtros de celulosa Agilent Captiva de 0,45μm (referencia 5190-5109, Agilent Technologies™).
Equipo HPLC y condiciones cromatográficasSe utilizó un equipo HPLC Agilent serie 1200 (Agilent Technologies™) con detector ultravioleta de matriz de diodos, y una columna analítica Eclipse XDB C18 (4,6×150mm, 5μm) marca Agilent. Durante la estandarización de la metodología analítica se realizaron varios ensayos para determinar las mejores condiciones en cuanto al método, la fase móvil, la longitud de onda, el volumen de migración, el flujo, el tiempo de migración y los tiempos de detección que permitieran la clara identificación del posaconazol, así como del control interno (itraconazol).
Preparación de las soluciones estándarPara la preparación del estándar primario se diluyeron 3,2mg de posaconazol en 2ml de DMSO; la solución se agitó durante 2min en un vórtex y luego fue sometida a ultrasonidos durante 5min, obteniendo una solución stock a una concentración de 1,6mg/ml. A partir de esta solución se prepararon dos curvas estándar, una usando como diluyente acetonitrilo:agua (70:30) y otra con suero humano libre del medicamento. De la solución stock se tomaron 10μl y se realizó una dilución 1:100, siendo este el valor de mayor concentración (16μg/ml). Para preparar los restantes valores de la curva de calibración se realizaron diluciones dobles seriadas hasta llegar a la concentración más baja evaluada en la curva (0,125μg/ml). Para el estándar interno se diluyeron 2mg de itraconazol en 1ml de DMSO; la solución se agitó en vórtex durante 2min y se sometió a ultrasonidos durante 5min. A partir de esta solución se hizo una dilución 1:10 con DMSO para obtener una solución del control interno a una concentración de 200μg/ml.
Preparación y extracción de las muestrasPara el control de calidad se prepararon tres muestras de suero humano libre del medicamento, a las que se añadió el estándar primario de posaconazol para obtener igual número de sueros con concentraciones conocidas diferentes (baja, media y alta) a 0,25; 8 y 16μg/ml. Estos sueros fueron sometidos al proceso de extracción, que comenzó al añadir a 150μl de la muestra de suero 3μl de la solución stock del control interno; posteriormente se añadieron 147μl de acetonitrilo frío, y la solución se mezcló en vórtex durante 30s. Para inducir la precipitación, la muestra se centrifugó dos veces a 13.800rpm a 15°C durante 15min. El sobrenadante obtenido fue filtrado a través de una membrana de 0,45μm para posteriormente inyectar 50μl al equipo de HPLC.
Validación del método analíticoLa validación del método analítico se realizó cumpliendo con todos los criterios de aceptación de los parámetros recomendados por la FDA para la validación de este tipo de metodologías: selectividad, linealidad, recuperación, exactitud, precisión, sensibilidad, reproducibilidad y estabilidad de la muestra8. Para la evaluación de la sensibilidad se llevó a cabo la estimación del límite de cuantificación y el límite de detección, que fueron calculados utilizando la ecuación y el método basado en la extrapolación de la recta de calibración a concentración cero.
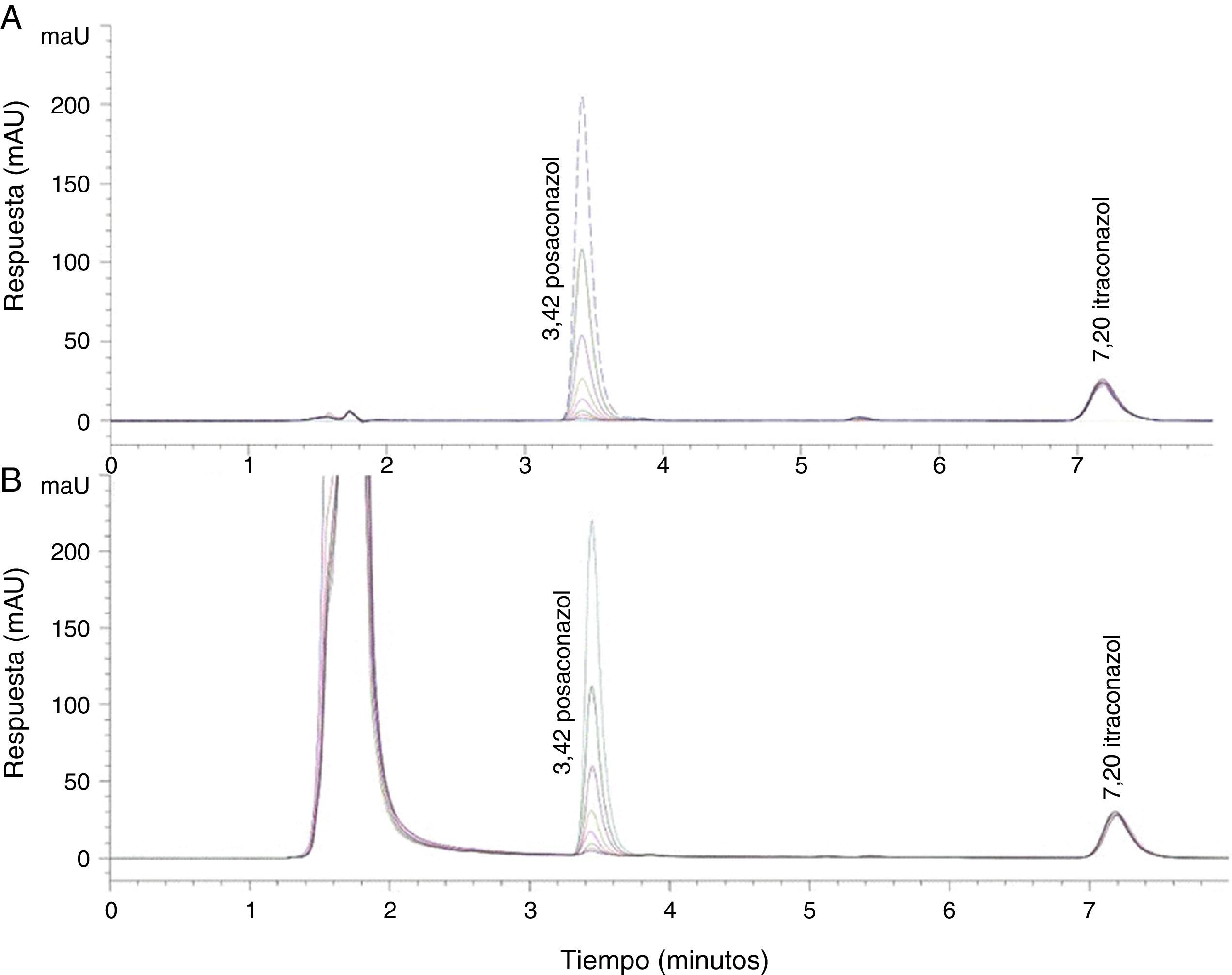
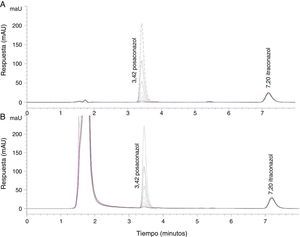
ResultadosEstandarización del método HPLC para el posaconazolLas mejores condiciones cromatográficas para la determinación de posaconazol en suero se obtuvieron bajo los siguientes parámetros (tabla 1): 25°C de temperatura de la columna, detección ultravioleta a 261nm, volumen de inyección de 50μl, flujo de 0,8ml/min, tiempo de migración de 10min, fase móvil de acetonitrilo:agua (70:30) y tiempos de retención de 3,42 y 7,20min para posaconazol e itraconazol, respectivamente (fig. 1).
Condiciones cromatográficas para la determinación de posaconazol en suero
| Parámetro | |
|---|---|
| Método | Isocrático, acetonitrilo:agua (70:30) |
| Flujo | 0,8ml/min |
| Volumen de inyección | 50μl |
| Detección | UV: 261nm |
| Columna | C18, 150×4,6mm, 5μm |
| Precolumna | C18, 20×4,6mm |
| Temperatura de columna | 25°C |
| Estándar interno | Itraconazol |
| Unidades de concentración | μg/ml |
| Tiempo de retención en minutos | Posaconazol: 3,4 |
| Itraconazol: 7,2 | |
| Tiempo de migración | 10min |
Cromatograma representativo de las curvas de calibración realizadas, en el que se observan los picos correspondientes al posaconazol y al control interno (itraconazol), así como los tiempos de retención para los mismos. A: Analitos diluidos en solución diluyente (acetonitrilo:agua). B: Analitos diluidos en suero.
La selectividad del método analítico cromatográfico fue demostrada al no evidenciarse en los cromatogramas de seis muestras distintas de suero humano libres de medicamento la presencia de picos apreciables, cuantificables o interferentes de posibles compuestos endógenos (fig. 1B).
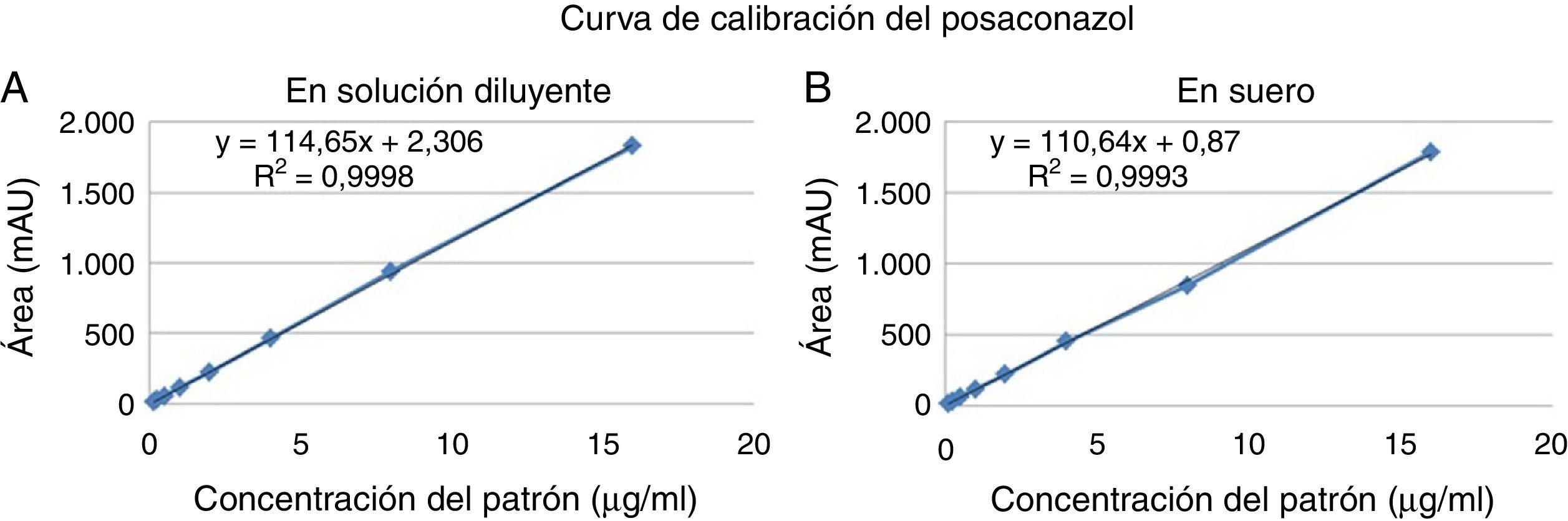
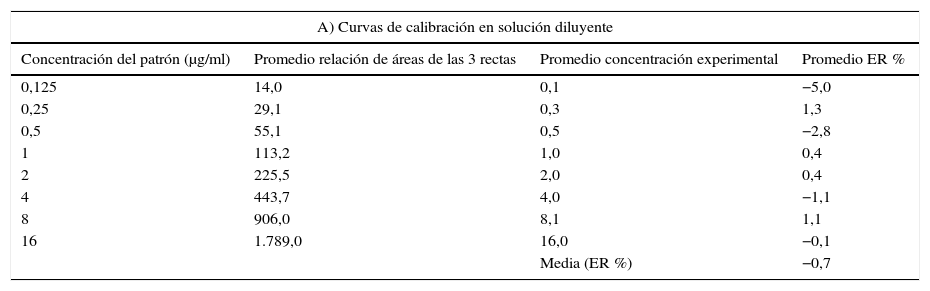
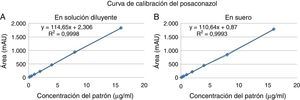
Curvas de calibraciónSe construyeron dos curvas de calibración con muestras patrón preparadas tanto en la solución diluyente (acetonitrilo:agua) como en suero humano al añadir cantidades conocidas de posaconazol. Las muestras así preparadas fueron sometidas al proceso de extracción y posteriormente analizadas. Cada una de las curvas se realizó por triplicado y con ocho concentraciones (0,125; 0,25; 0,5; 1; 2; 4; 8 y 16μg/ml). El coeficiente de determinación R2 fue siempre superior a 0,99 para todas las curvas (fig. 2); el error relativo porcentual de cada uno de los puntos de las curvas de calibración preparadas tanto en la solución diluyente como en el suero fue siempre inferior al 15%, cumpliendo así el criterio de aceptación recomendado por la FDA (tabla 2).
Resultados obtenidos del análisis de linealidad según las curvas de calibración realizadas para el posaconazol en solución diluyente acetonitrilo:agua (A) y suero humano (B)
| A) Curvas de calibración en solución diluyente | |||
|---|---|---|---|
| Concentración del patrón (μg/ml) | Promedio relación de áreas de las 3 rectas | Promedio concentración experimental | Promedio ER % |
| 0,125 | 14,0 | 0,1 | −5,0 |
| 0,25 | 29,1 | 0,3 | 1,3 |
| 0,5 | 55,1 | 0,5 | −2,8 |
| 1 | 113,2 | 1,0 | 0,4 |
| 2 | 225,5 | 2,0 | 0,4 |
| 4 | 443,7 | 4,0 | −1,1 |
| 8 | 906,0 | 8,1 | 1,1 |
| 16 | 1.789,0 | 16,0 | −0,1 |
| Media (ER %) | −0,7 | ||
| Parámetro | Recta 1 | Recta 2 | Recta 3 |
|---|---|---|---|
| a | 2,31 | −1,60 | 1,62 |
| b | 114,60 | 110,10 | 111,10 |
| r | 1,00 | 1,00 | 1,00 |
| R2 | 0,9990 | 0,9990 | 1,0000 |
| (Y=a+bX) |
| B) Curvas de calibración en suero | |||
|---|---|---|---|
| Concentración del patrón (mg/ml) | Promedio relación de áreas de las 3 rectas | Promedio concentración experimental | Promedio ER % |
| 0,125 | 15,7 | 0,1 | 12,1 |
| 0,25 | 30,5 | 0,3 | 9,2 |
| 0,50 | 61,0 | 0,5 | 9,6 |
| 1 | 118,3 | 1,1 | 6,4 |
| 2 | 226,2 | 2,0 | 1,8 |
| 4 | 436,1 | 3,9 | −1,8 |
| 8 | 862,1 | 7,8 | −3,0 |
| 16 | 1.791,1 | 16,1 | 0,8 |
| Media (ER %) | 3,7 | ||
| Parámetro | Recta 1 | Recta 2 | Recta 3 |
|---|---|---|---|
| a | 0,87 | −1,52 | 1,08 |
| b | 110,60 | 111,20 | 111,30 |
| r | 1,00 | 1,00 | 1,00 |
| R2 | 0,999 | 0,998 | 0,999 |
ER %: error relativo porcentual.
Este parámetro es relevante en la medida en que sea reproducible y fue determinado en tres muestras con concentraciones diferentes de posaconazol: 0,25μg/ml (baja), 8μg/ml (media) y 16μg/ml (alta). Fue calculado haciendo una comparación entre la respuesta en área obtenida para el posaconazol extraído de la matriz biológica (suero) y la respuesta obtenida del mismo en la solución patrón. El porcentaje de recuperación para el posaconazol fue de 98,7%, con un porcentaje del coeficiente de variación global de 6,7%.
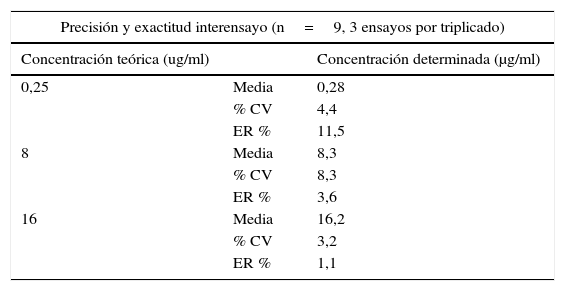
Exactitud y precisiónEstos parámetros fueron valorados tanto a nivel intra como inter ensayo, por triplicado y en días distintos. Fueron preparadas tres muestras de suero con concentraciones diferentes de posaconazol: 0,25μg/ml (baja), 8μg/ml (media) y 16μg/ml (alta). Los valores de error relativo porcentual, en el caso de la exactitud, y los valores del porcentaje del coeficiente de variación, en el caso de la precisión, estuvieron por debajo del 15%, lo que cumple con los criterios de aceptación recomendados por la FDA (tabla 3).
Resultados del análisis de exactitud y precisión del ensayo realizado con tres puntos de la curva y por triplicado
| Precisión y exactitud interensayo (n=9, 3 ensayos por triplicado) | ||
|---|---|---|
| Concentración teórica (ug/ml) | Concentración determinada (μg/ml) | |
| 0,25 | Media | 0,28 |
| % CV | 4,4 | |
| ER % | 11,5 | |
| 8 | Media | 8,3 |
| % CV | 8,3 | |
| ER % | 3,6 | |
| 16 | Media | 16,2 |
| % CV | 3,2 | |
| ER % | 1,1 | |
ER %: error relativo porcentual; % CV porcentaje del coeficiente de variación.
Se realizó por triplicado una curva de calibración en suero con 3 puntos a concentraciones bajas y supuestamente cercanas al límite de cuantificación. Con esta curva se calcula la señal ruido, la desviación estándar de la señal y la pendiente. Los límites de detección y de cuantificación para el ensayo bioanalítico basados en el modelo matemático de extrapolación de la recta de calibración a concentración cero fueron de 0,03 y de 0,125μg/ml, respectivamente.
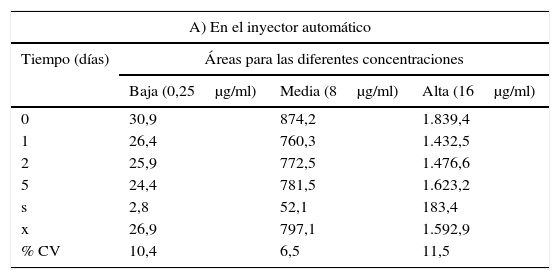
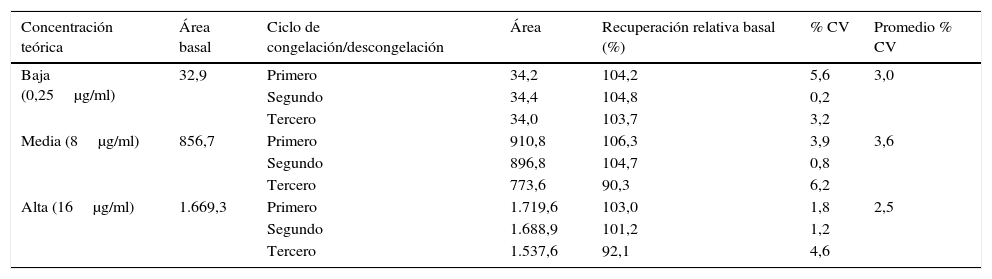
Estabilidad de la muestraEste parámetro fue evaluado teniendo en cuenta el tiempo de trabajo y las condiciones de temperatura a las que pueden ser sometidas las muestras durante su procesamiento. Los porcentajes del coeficiente de variación encontrados al evaluar tanto la estabilidad de las soluciones patrón del posaconazol después de ser almacenado durante 24h, 48h y 5 días en solución diluyente a temperatura ambiente, a −20°C y en el sistema de inyección del equipo (tabla 4), como al evaluar el porcentaje de recuperación del antifúngico de muestras de suero sometidas a tres ciclos de congelación/descongelación (tabla 5) y muestras almacenadas durante uno, 2 y 5 días en el sistema de inyección del equipo (tabla 6) estuvieron siempre por debajo del 15%, cumpliendo así con los criterios de aceptación recomendados por la FDA.
Estabilidad de las soluciones patrón
| A) En el inyector automático | |||
|---|---|---|---|
| Tiempo (días) | Áreas para las diferentes concentraciones | ||
| Baja (0,25μg/ml) | Media (8μg/ml) | Alta (16μg/ml) | |
| 0 | 30,9 | 874,2 | 1.839,4 |
| 1 | 26,4 | 760,3 | 1.432,5 |
| 2 | 25,9 | 772,5 | 1.476,6 |
| 5 | 24,4 | 781,5 | 1.623,2 |
| s | 2,8 | 52,1 | 183,4 |
| x | 26,9 | 797,1 | 1.592,9 |
| % CV | 10,4 | 6,5 | 11,5 |
| B) A temperatura ambiente | |||
|---|---|---|---|
| Tiempo (días) | Áreas para las diferentes concentraciones | ||
| Baja (0,25μg/ml) | Media (8μg/ml) | Alta (16μg/ml) | |
| 0 | 30,9 | 874,2 | 1.839,4 |
| 1 | 25,2 | 722,2 | 1.579,0 |
| 2 | 25,5 | 846,1 | 1.562,8 |
| 5 | 24,7 | 799,0 | 1.648,7 |
| s | 2,9 | 66,4 | 126,9 |
| x | 26,6 | 810,4 | 1.657,5 |
| % CV | 10,9 | 8,2 | 7,7 |
| C) A −20°C | |||
|---|---|---|---|
| Tiempo (días) | Áreas para las diferentes concentraciones | ||
| Baja (0,25μg/ml) | Media (8μg/ml) | Alta (16μg/ml) | |
| 0 | 30,9 | 874,2 | 1.839,4 |
| 1 | 24,1 | 765,9 | 1.431,9 |
| 2 | 30,9 | 824,0 | 1.615,5 |
| 5 | 24,3 | 799,0 | 1.635,6 |
| s | 3,8 | 45,6 | 166,7 |
| x | 27,5 | 815,8 | 1.630,6 |
| % CV | 14,0 | 5,6 | 10,2 |
s: desviación estándar; x: promedio; % CV: porcentaje del coeficiente de variación.
Estabilidad de posaconazol en suero humano después de varios ciclos de congelación/descongelación
| Concentración teórica | Área basal | Ciclo de congelación/descongelación | Área | Recuperación relativa basal (%) | % CV | Promedio % CV |
|---|---|---|---|---|---|---|
| Baja (0,25μg/ml) | 32,9 | Primero | 34,2 | 104,2 | 5,6 | 3,0 |
| Segundo | 34,4 | 104,8 | 0,2 | |||
| Tercero | 34,0 | 103,7 | 3,2 | |||
| Media (8μg/ml) | 856,7 | Primero | 910,8 | 106,3 | 3,9 | 3,6 |
| Segundo | 896,8 | 104,7 | 0,8 | |||
| Tercero | 773,6 | 90,3 | 6,2 | |||
| Alta (16μg/ml) | 1.669,3 | Primero | 1.719,6 | 103,0 | 1,8 | 2,5 |
| Segundo | 1.688,9 | 101,2 | 1,2 | |||
| Tercero | 1.537,6 | 92,1 | 4,6 |
% CV: porcentaje del coeficiente de variación.
Estabilidad de la muestra de acuerdo con el periodo de tiempo de permanencia en el inyector del cromotografía líquida de alta eficiencia
| Concentración teórica | Área basal | Tiempo en el inyector | Área | Recuperación relativa al basal (%) | % CV | Promedio % CV |
|---|---|---|---|---|---|---|
| Baja (0,25μg/ml) | 32,9 | 1 día | 35,5 | 107,9 | 4,6 | 5,0 |
| 2 días | 34,4 | 104,7 | 3,8 | |||
| 5 días | 29,4 | 89,6 | 6,4 | |||
| Media (8μg/ml) | 856,7 | 1 día | 966,9 | 112,9 | 6,9 | 5,3 |
| 2 días | 864,6 | 100,9 | 2,0 | |||
| 5 días | 758,9 | 88,6 | 6,9 | |||
| Alta (16μg/ml) | 1.669,3 | 1 día | 1.812,4 | 108,6 | 4,6 | 2,7 |
| 2 días | 1.674,3 | 100,3 | 0,9 | |||
| 5 días | 1.594,5 | 95,5 | 2,7 |
% CV: porcentaje del coeficiente de variación.
Los resultados del presente trabajo nos permitieron estandarizar y validar, siguiendo los parámetros recomendados por la FDA, una metodología basada en HPLC que de manera sencilla y rápida nos permite la identificación y cuantificación de concentraciones séricas de posaconazol con un rango de cuantificación amplio y confiable que va desde 0,125 hasta 16μg/ml, similar a lo encontrado por Cendejas-Bueno et al. en 20123. La selectividad y pureza de la señal cromatográfica obtenida, así como los límites de detección y cuantificación estandarizados, hacen de esta metodología una excelente herramienta para el seguimiento terapéutico de los pacientes bajo tratamiento con posaconazol.
El tratamiento de muestras mediante la precipitación de proteínas con el uso de acetonitrilo es un método sencillo y rápido de realizar, y presenta una alta reproducibilidad y firmeza. El uso de una fase móvil, que no requiere la preparación de soluciones tampón o aditivos, simplifica de forma significativa el desarrollo del ensayo y reduce los tiempos y costes de la prueba4,22.
El hecho de que la estabilidad o recuperación de los fármacos presentes en las muestras no se viera afectada ni por el tiempo de almacenamiento (72h) ni por las condiciones de almacenamiento de la muestra (entre el rango de congelación y la temperatura ambiente) demuestra la estabilidad que la molécula de interés (posaconazol) puede tener en el material biológico cuando este sea remitido para su análisis.
Con el marcado incremento en la incidencia de las IFI en los últimos años, el poder disponer de una nueva herramienta de laboratorio, altamente sensible y específica, para la determinación de niveles séricos de posaconazol facilitará al personal médico la toma de decisiones de forma más confiable y permitirá evitar así los fallos terapéuticos o las reacciones adversas, producto de concentraciones séricas inadecuadas. Igualmente, el uso de esta herramienta beneficiaría directamente al paciente al disminuir el riesgo de complicaciones durante su tratamiento y mejorar posiblemente su calidad de vida.
Finalmente, y desde el punto de vista económico, este tipo de análisis se puede efectuar a un coste relativamente bajo, comparado incluso con el coste de un análisis de determinación indirecta de concentración sérica de una molécula hecho mediante el método de bioensayo. La implementación de este tipo de metodología, considerada en la mayoría de los casos cara en coste-efectividad, influye directamente en la reducción de los gastos causados al sistema de salud al permitir las modificaciones oportunas en los esquemas de tratamiento, mejorar el manejo de las complicaciones y disminuir los tiempos de hospitalización de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores del presente trabajo expresan su agradecimiento a los doctores Manuel Cuenca-Estrella y Alicia Gómez, del Servicio de Micología del Centro Nacional de Microbiología, del Instituto Carlos III (Madrid, España), por su asesoría durante el desarrollo del proyecto. A la doctora Catalina de Bedout, de la Unidad de Micología Médica y Experimental, y al Dr. Ever Antony Rueda, de la Unidad de Fitosanidad y Control Biológico de la CIB. A las compañías farmacéuticas Merck Sharp & Dohme y Janssen-Cilag, quienes amablemente suministraron los estándares puros de los antifúngicos evaluados. Al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología, Francisco José de Caldas, COLCIENCIAS, Bogotá, Colombia, Proyecto con contrato número: 0104-2013; al Centro de Investigación para el Desarrollo y la Innovación de la Universidad Pontificia Bolivariana (CIDI-UPB), Proyecto: 698A-12/10-12; y al Fondo de Ciencia, Tecnología e Innovación del Sistema Nacional de Regalías, Proyecto con código de aprobación BPIN: 2013000100183.