Este trabajo fue presentado como conferencia titulada "Disruptores endocrinos y función testicular" en el Simposio Toxicología de la Reproducción, en el III Encuentro Iberoamericano de Androogía (ANDRO 2006) en La Habana (Cuba), del 3 al 8 de diciembre de 2006.
INTRODUCCIÓN
Los disruptores hormonales son cualquier compuesto químico contaminante del medio ambiente, que una vez incorporado a un organismo afecta al equilibrio hormonal de diversas especies, entre ellas el ser humano.
Se ha descrito numerosos sistemas; sin embargo, cualitativa y cuantitativamente son superiores los que resultan agonistas o antagonistas de las hormonas sexuales femeninas1.
La nomenclatura que han recibido los disruptores hormonales es muy diversa; en general, se los denomina estrógenos ambientales2, pero han recibido distintas denominaciones, como xenoestrógenos3, hormonas ambientales4,5, agentes hormonales activos6 y señales ambientales7, entre otras.
Las características químicas de los disruptores hormonales pueden ser de 3 tipos8,9: miméticos estrogénicos, compuestos clorados e hidrocarburos aromáticos policíclicos.
MIMÉTICOS ESTROGÉNICOS
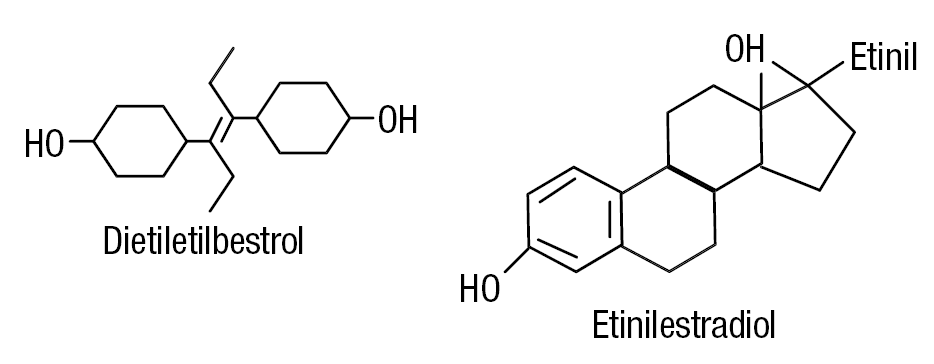
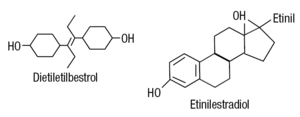
La figura 1 muestra las estructuras del dietiletilbestrol y el etinilestradiol; ambos compuestos tienen la misma potencia biológica que el 17-betaestradiol. Son derivados del núcleo estilbeno y, debido a su solubilidad y bajo costo, constituyen el estrógeno sintético de elección para la medicina y la agricultura10. En medicina humana se han utilizado en la terapia de reemplazo estrogénica, en la suspensión de la lactancia, en la anticoncepción poscoital, en el mantenimiento del embarazo y en el cáncer de próstata. En la agricultura, para castrar pollos y el desarrollo muscular vacuno. Este uso permitió la introducción de toneladas de estos compuestos en el ecosistema.
Figura 1. Estructura química del dietiletilbestrol, derivado del núcleo estilbeno, y del etinilestradiol, ambos de actividad estrogénica similar al estradiol.
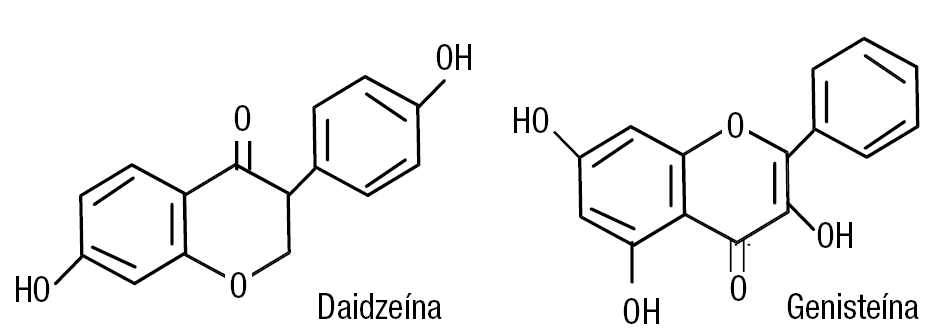
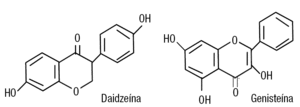
La figura 2 muestra la estructura química de 2 fitoestrógenos contenidos en la soja, la genisteína y la daidzeína. Se ha descrito que los monos chectahs en el zoológico de Cincinnati, con dieta abundante de soja, consumían alrededor de 50 mg por día de estos compuestos, y como consecuencia tuvieron fallos reproductivos y otras enfermedades relacionadas. El reemplazo por carnes rojas revirtió esta situación11. También se ha demostrado que 7 días de dieta con fitoestrógenos inducen aumento uterino similar al producido por dietiletilbestrol a la dosis de 6 partes por millón12.
Figura 2. Estructura química de la daidzeína y la enisteína, fitoestrógenos que la soja contiene.
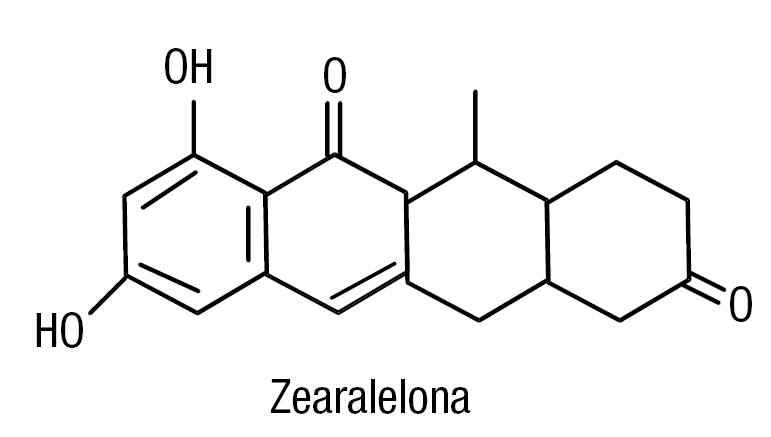
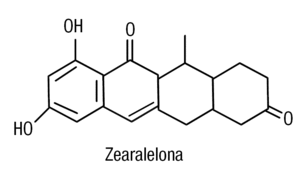
La figura 3 muestra la estructura química de la zearalelona, que es una micotoxina fúngica producida por Fursarium. Se une al receptor de estradiol. En pacientes con trastornos de la fertilidad se la ha asociado al consumo de maíz contaminado con esta sustancia. La contaminación en humanos se estima en 3 µg/persona/día13.
Figura 3. Estructura química de la zearelolona (lactona del ácido resorcíclico). Micotoxina fúngica producida por Fursarium.
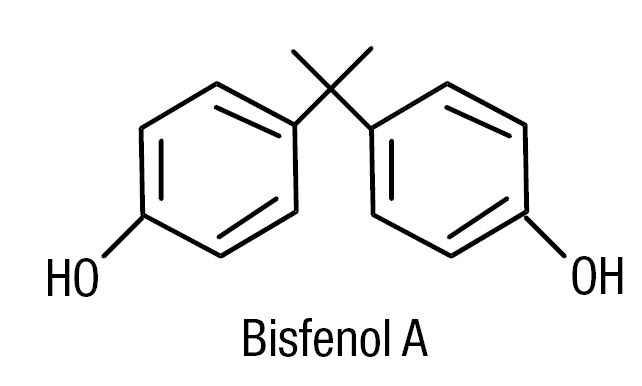
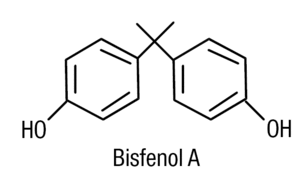
La figura 4 muestra la estructura química del bifenol A, que es un di-(p-hidroxifenil) dimetilmetano. Su mecanismo de acción es semejante al de los moduladores selectivos de los receptores de estrógenos (SERM)14. En la producción de polímeros de plástico es donde se utiliza el bifenol A. La exposición industrial a esta sustancia induce trastornos de la función reproductiva. Se ha descrito a varones contaminados con bifenol A que presentan oligospermia y mujeres con irregularidades menstruales.
Figura 4. Estructura química del bifenol A (BPA) di-(p-hidroxifenil) dimetilmetano.
COMPUESTOS CLORADOS
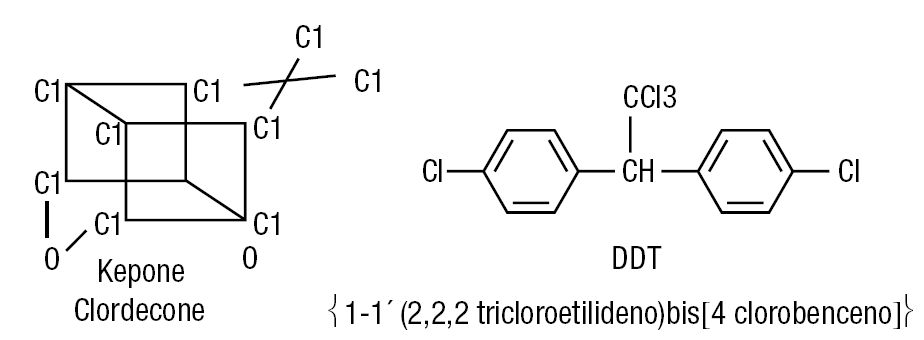
Los compuestos clorados más significativos son: el kepone, el DDT y los policlorados difenilos15-17.
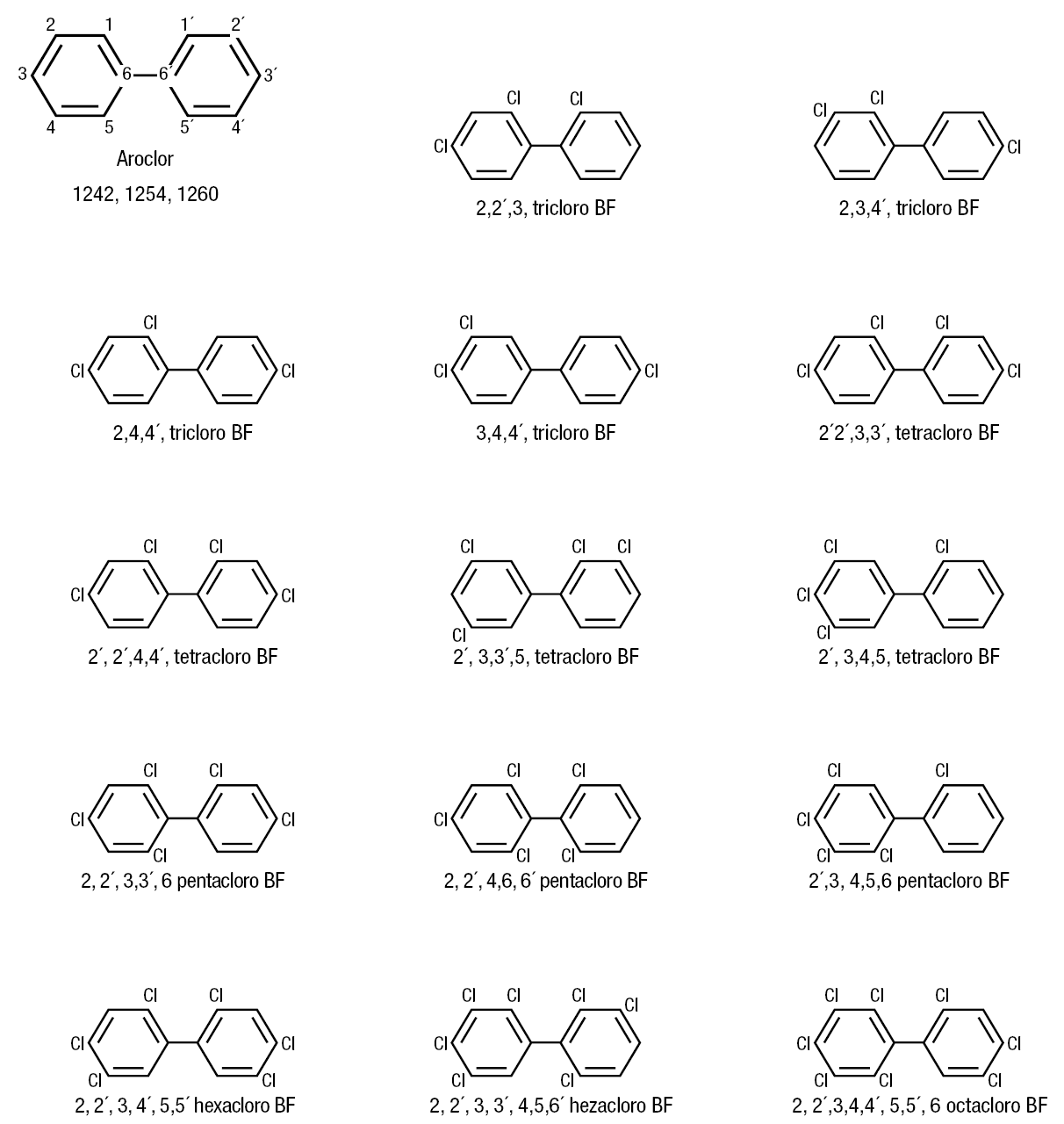
En la figura 5 se muestra las estructuras químicas del kepone y el DDT y en la figura 6, la de los compuestos clorados difenilos (PCB). Estos últimos son derivados del aerocloro, y pueden estar sustituidos por 3-8 átomos de cloro, como se muestra en la mencionada figura 6.
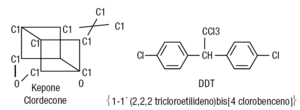
Figura 5. Estructura química del kepone y el DDT.
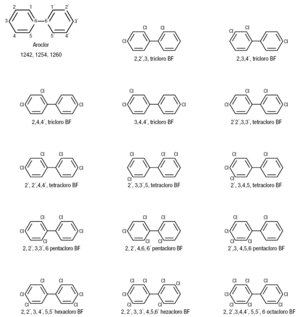
Figura 6. Estructura química de los compuestos policlorados bifenilos (PCB). Estos se derivan del aeroclor y pueden estar sustituidos por 3-8 átomos de Cl. BF: bifenilo.
Plásticos
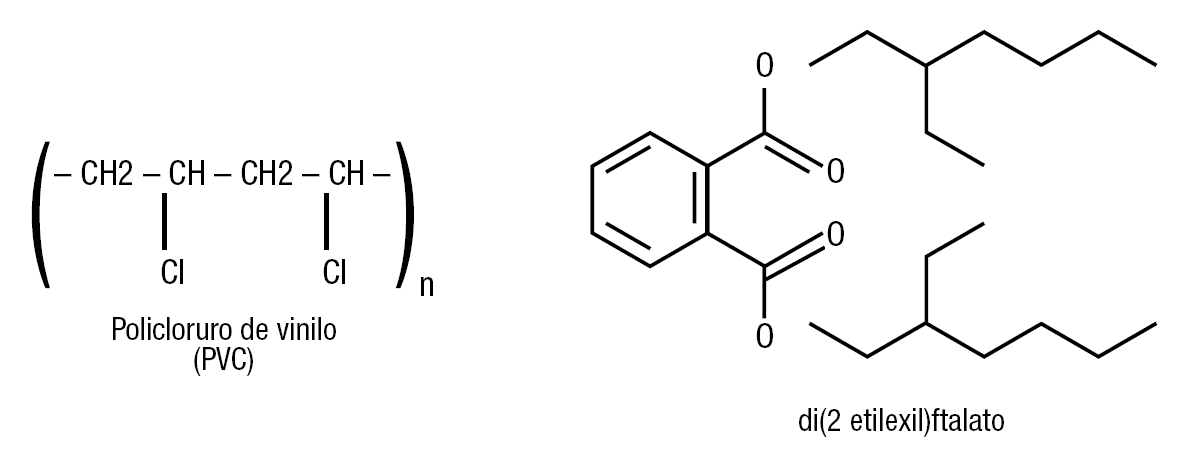
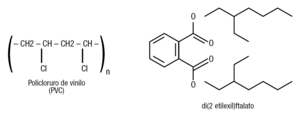
El ftalato se utiliza como plastificante en muchos plásticos desde 1930, además en tintas, productos de embalar, adhesivos, fórmulas de leche para bebés, quesos, margarinas, fluoruro de vinilo para pinturas de emulsión, pesticidas, aerosoles para el cabello y repelentes de insectos, entre otras aplicaciones. El 95% del [di (2 etilexil) ftalato] se emplea en la fabricación del policloruro de vinilo. La figura 7 muestra las estructuras químicas de estos 2 compuestos ampliamente utilizados en la producción de plástico. Son de uso habitual en esa industria, y se utilizan como aditivos que mejoran la calidad del producto final. Se usan también como conservantes alimentarios, debido a su capacidad antioxidante. Son solubles en grasa, se acumulan en tejido adiposo y también tienden a concentrarse en alimentos como la mantequilla, la margarina y el queso.
Figura 7. Estructura química del policloruro de vinilo (PVC) y del di(2 etilexil)ftalato. El 95% de la producción de este compuesto se emplea en la fabricación de los PVC.
Hay dos problemas principales que resultan de incinerar policloruro de vinilo en el medio ambiente:
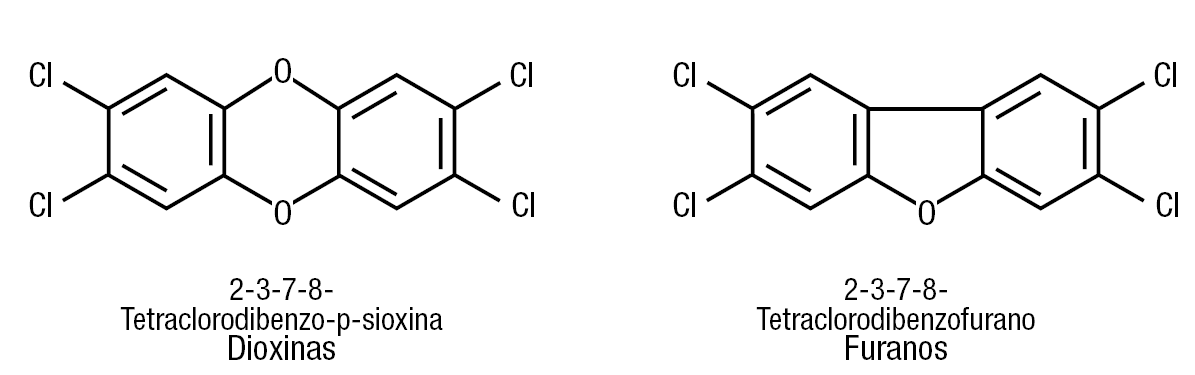
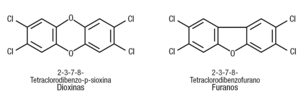
La formación de dioxinas y furanos. La figura 8 muestra la estructura química de estos 2 productos de la combustión de policloruro de vinilo. Este producto contiene un 57% de cloro, y en presencia de hidrocarburos forma dioxinas al calentarse hasta 200 °C, lo que no se puede evitar.
Figura 8. Estructura química de dioxinas y furanos. Estos tóxicos ambientales resultan de la incineración de policloruros de vinilo.
El otro problema es que, como el policloruro de vinilo puro es un material inflexible y frágil, se necesita agregarle arsénico y plomo. Al quemarse el policloruro de vinilo, estos metales pesados se trasforman en polvo y escapan al medio ambiente, por lo que se convierten en otra amenaza para la salud pública. Hay bastantes estudios, en Estados Unidos, Reino Unido y otros países, sobre los problemas relacionados con vivir cerca de un incinerador18,19.
La Environmental Protection Agency (EPA) asignó a estos compuestos efectos tóxicos múltiples, entre otros: atrofia gonadal y disminución de la testosterona y los caracteres sexuales del varón. La EPA acordó que el efecto tóxico de las dioxinas puede incluir: muerte, atrofia gonadal linfoidea, hiperplasia, metaplasia, interrupción endocrina, carcinogenia, toxicidad reproductiva y de desarrollo, toxicidad dérmica, inmunotoxicidad, neurotoxicidad y toxicidad hepática y vascular. Los efectos de la exposición a dioxinas en la población humana se manifiestan en enfermedades cardiovasculares, diabetes, cáncer, perfidia y endometriosis, y desde el punto de vista de lo que nos interesa en esta presentación, disminución de testosterona. Además puede producir cambios en el sistema inmunitario, en el neurológico, en las características cognitivas, en la dentición y en los caracteres sexuales.
En síntesis los compuestos clorados son menos potentes que el estradiol, a pesar de que interaccionan con su receptor. La potencia estrogénica está relacionada con la longitud de la cadena lateral y sus sustitutos20. Ha sido altamente significativo el efecto beneficioso que han tenido estos compuestos como plaguicida empleado para la protección de cultivos, pero manteniendo la actividad estrogénica21. Se los ha detectado en peces, carnes y lácteos, y por su liposolubilidad se acumulan en el tejido graso. Se ha demostrado efectos tóxicos a largo plazo, posiblemente por su acción estrogénica que produce trastornos reproductivos en la fauna salvaje. Son compuestos semivolátiles, por lo cual pueden ser transportados a sitios remotos, lejos de la fuente de producción y de uso, y acumularse en regiones frías22-24.
Desde finales de la década de los setenta, la producción y el uso de casi todos los compuestos organoclorados semivolátiles están prohibidos. Por lo menos muy restringidos, se los ha clasificado como contaminantes orgánicos persistentes.
HIDROCARBUROS AROMÁTICOS POLICÍCLICOS (PAH)
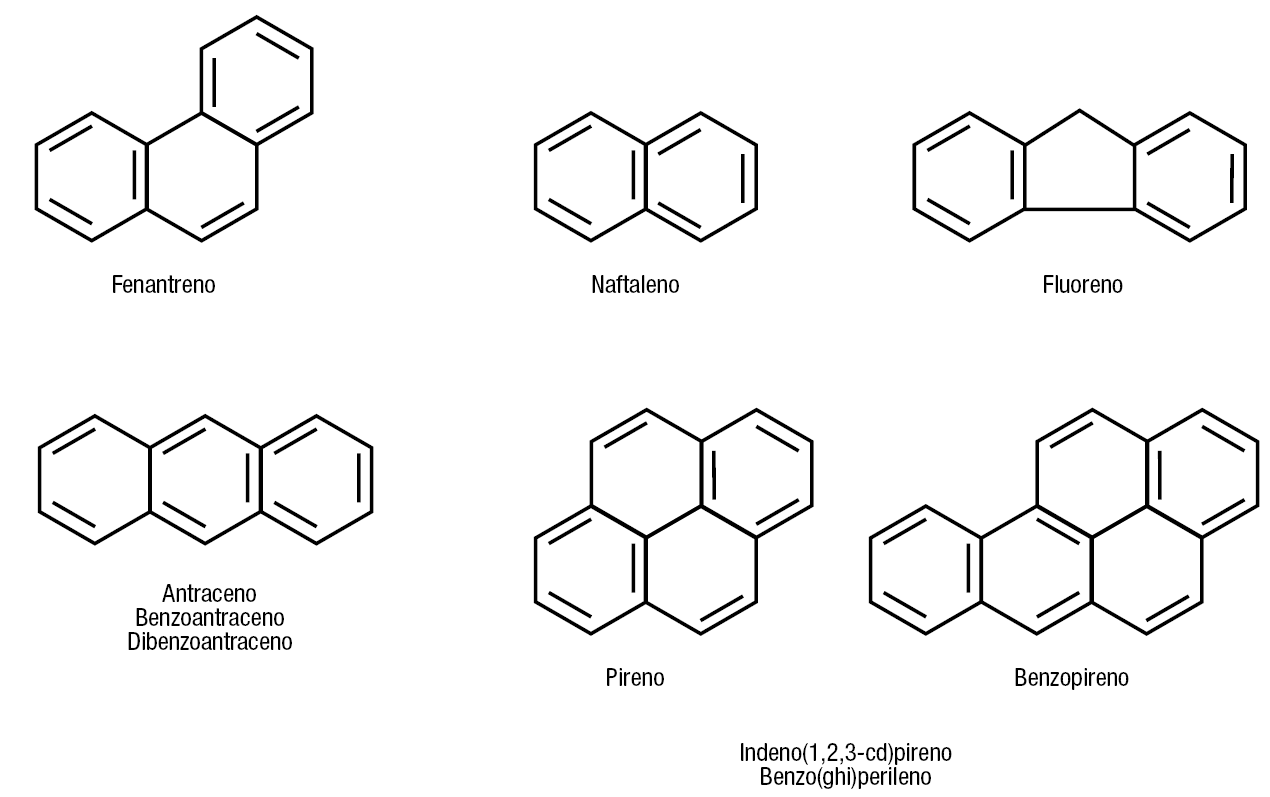
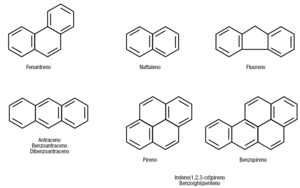
La figura 9 muestra la estructura de los PAH y su relación con el fenantreno. Recordemos que el fenantreno es la base de los esteroides sexuales mineral y glucocorticoides.
Figura 9. Estructura química de los principales hidrocarburos aromáticos. El fenantreno saturado (ciclopentano perihidrofenantreno) es el núcleo de los esteroides biológicos. El benzoantraceno y el dibenzoantraceno son derivados del antraceno y el indeno(1,2,3-cd)pireno y benzo(ghi)perileno son derivados del pireno y el benzopireno. No se muestra la estructura de estas cuatro sustancias.
Los PAH corresponden a un grupo de contaminantes ambientales, por su acción mutágena y carcinógena, activan primariamente el citocromo P450 y la epóxido hidroxilasa. Al reaccionar los PAH con el diolepóxido, se une al ADN y forma un ducto PAH-ADN. Se ha comunicado gran cantidad de estos ductos en tejidos mamarios de pacientes con cáncer de mama comparados con los controles, lo que indica que, por unión a los receptores de estradiol, los PAH pueden acumularse en el núcleo de la célula, lo que resulta en un incremento de la mutagenia21-25. Esta teoría no está adecuadamente corroborada; sin embargo, en presencia de altas dosis de estrógenos se inhibe el desarrollo y/o el crecimiento de tumores mamarios inducidos por PAH mutágenos.
El 3 metil-colantreno o el 7,12-dimetil-benzoantraceno, los estrógenos y los antiestrógenos ocupan los receptores de estradiol e impiden la unión de los PAH; en consecuencia, por este mecanismo inhibirían la mutagenia inducida por estos contaminantes. Los humanos están continuamente expuestos y tienen concentraciones detectables de PAH, lo que hace de estos compuestos potenciales agentes genotóxicos importantes en la iniciación del cáncer de mama, particularmente en estadios hipoestrogénicos26-31.
Desde el punto de vista de su acción, aunque no haya un consenso total en este sentido, se ha intentado agrupar estos disruptores en: a) plaguicidas (éstos, en organoclorados y no clorados); b) químicos organohalogenados; c) plásticos, y d) químicos industriales. En la tabla 1 se muestran los ejemplos de las distintas sustancias más significativas en cada uno de esos grupos de disruptores endocrinos.
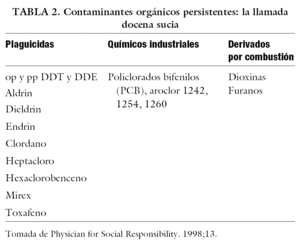
La llamada docena sucia
Se conoce comúnmente como docena sucia a los contaminantes más importantes, y se está trabajando sobre su eliminación, producción y uso. La tabla 2 muestra esta docena sucia; los principales componentes son los plaguicidas, los químicos industriales y los derivados generados por combustión32. En 1997, el programa de las Naciones Unidas para el medio ambiente pidió que se convocase un comité intergubernamental de negociación, con el mandato de elaborar un instrumento internacional, jurídicamente vinculante, para la aplicación de medidas internacionales respecto de ciertos contaminantes orgánicos persistentes. Se han realizado 6 comités: Montreal (1998), Nairobi (1999), Ginebra (1999), Bonn (2000), Johannesburgo (2000) y Ginebra (2002). Como resultados de estas secciones, se ha logrado acordar un texto de convenio, firmado oficialmente el 23 de mayo de 2001 en Estocolmo32.
ACCIONES TÓXICAS DE LOS DISRUPTORES ENDOCRINOS
Como hemos visto, los disruptores endocrinos tienen una acción patogénica vinculada a diversas alteraciones del equilibrio humano. Nosotros, por las características de esta presentación, nos referiremos a la acción tóxica de algunos de estos disruptores sobre la función testicular que ha sido documentada en numerosas publicaciones científicas.
En varones recién nacidos contaminados con PCB, dioxinas, furano y DDT, se observó micropene, pero no se describieron efectos en el tamaño testicular o estados de desarrollo de Tunner33.
También se ha descrito alteraciones en el espermograma. En cantidades de espermatozoides < 20 millones/ml, se encontró una relación inversa con la concentración circulante del disruptor endocrino. Además se describió una relación entre el tiempo de exposición al disruptor endocrino y la movilidad y la morfología anormales de los espermatozoides34.
Los contaminantes orgánicos persistentes inducen importantes modificaciones de la función espermática. En estudios realizados en 61 países, los involucran en la disminución del volumen espermático. Entre 1949 y 1990, el volumen espermático disminuyó de 3,4 a 2,75 ml en el eyaculado, y en ese mismo período, de 113 a 66 millones de espermatozoides/ml35.
Dado que estos di sruptores endocrinos interaccionan con el receptor de estradiol, describiremos brevemente las características del receptor y la acción biológica del estradiol en él.
RECEPTORES PARA ESTRADIOL Y ACCIÓN BIOLÓGICA DEL ESTEROIDE
Los receptores para estrógenos (RE2) son miembros de una superfamilia de receptores nucleares a la que pertenecen los de otras hormonas esteroides, como andrógenos, progesterona, corticoides, hormonas tiroideas, vitamina D y ácido retinoico. Los receptores actúan como factores de transcripción, inducidos por el ligando, y son capaces de potenciar o inhibir la transcripción génica interactuando con un grupo de coactivadores y correpresores llamados correguladores.
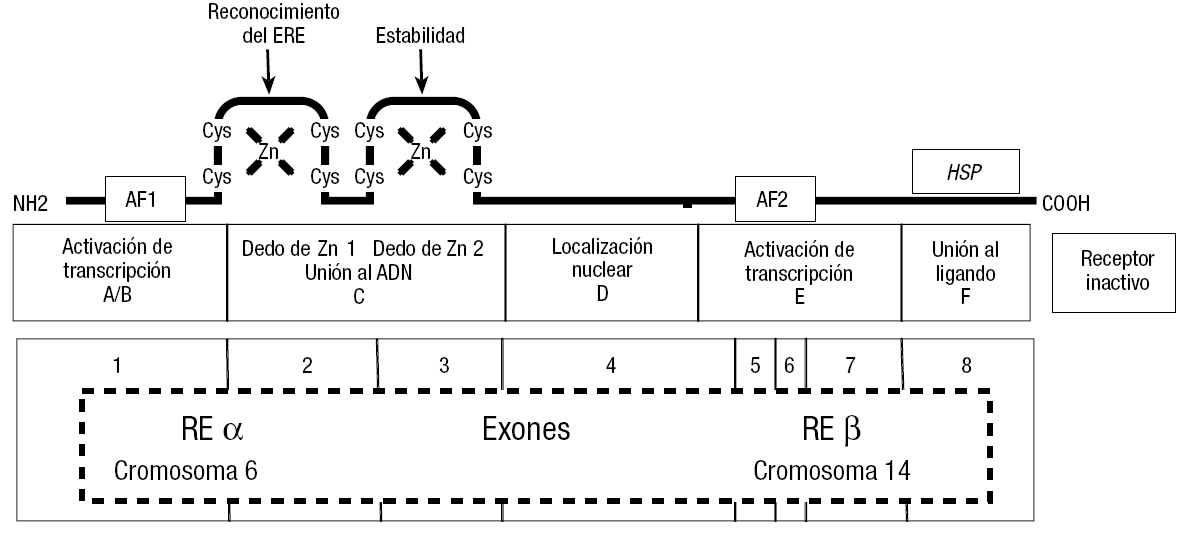
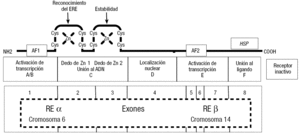
El receptor es una proteína de 66 kDa, que contiene 6 regiones denominadas A a F. La figura 10 en su parte inferior muestra un esquema de las características del receptor y de su gen, el cual tiene 8 exones. Se ha descrito 2 receptores, el RE2 alfa, que está codificado en el cromosoma 6, y el RE2 beta, que está codificado en el cromosoma 14.
Figura 10. Representación esquemática de dos de las formas del receptor de E2 (RE2), α y β. El gen tiene para ambas 8 exones. El gen del RE2α se encuentra en el cromosoma 6 y el del RE2β, en el 14. En la figura se describen las distintas funciones de las porciones de la proteína inducidas por cada exón. El RE2 se encuentra inactivo cuando está unido a una de las denominadas heat shock protein (HSP). El E2 o cualquier ligando de acción mimética agonista del E2, al unirse al RE2, desplaza la HSP y activa el RE2.
El exón 1 induce la porción N-terminal de la proteína con los sitios de activación de transcripción. Los exones 2 y 3 inducen una doble de dos de Zn, debido a la unión del Zn a 4 moléculas de cisteínas. Uno de éstos es fundamental para el reconocimiento del RE2 al elemento de respuesta al estradiol (ERE), y el otro para dar estabilidad a la molécula cuando se encuentra unida al receptor. El exón 4 induce la porción de la proteína de localización nuclear y los 5, 6 y 7, la zona de transcripción a través de AF2; finalmente, el exón 8 induce la porción carboxiloterminal del receptor, donde se produce la unión al ligando.
El receptor inactivo está unido en esta zona por una proteína que se denomina heat shok protein. La interacción del RE2 con el estradiol induce la liberación de esta proteína y así el receptor inactivo es capaz de iniciar el mecanismo de acción biológica de la hormona.
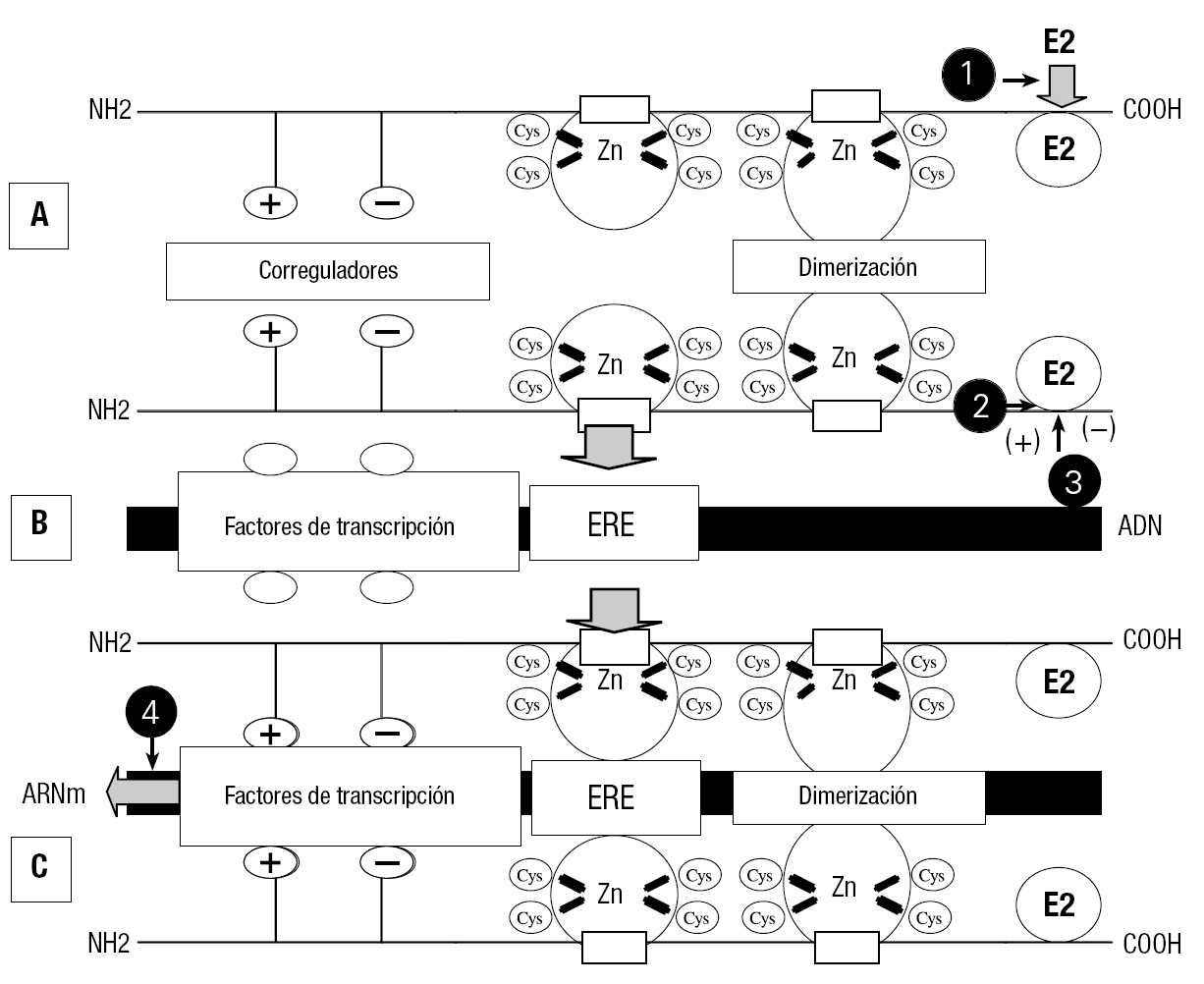
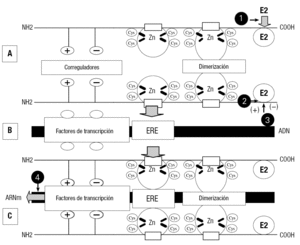
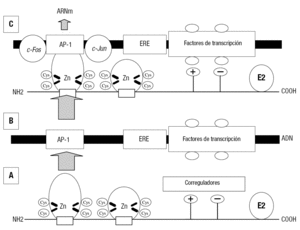
Esta acción biológica puede producirse de dos formas, y la figura 11 es un esquema de uno de los mecanismos de la acción del estradiol mediada por su receptor. El receptor, una vez unido al ligando, se dimeriza por uno de los dedos de Zn (fig. 11A), finalmente, por el otro dedo de Zn interacciona con el ERE del ADN permitiendo a los factores correguladores que actúen mediante los factores de transcripción, que pueden ser positivos, induciendo la acción biológica o negativos inhibiéndola. Si se induce la acción biológica, se va a expresar un ARN mensajero que en el ribosoma va a inducir la respuesta hormonal (figs. 11B y C).
Figura 11. Mecanismo de acción genómica del complejo E2:RE2 por interacción con el elemento de respuesta al estrógeno (ERE). A: el E2 unido al RE2 lo activa y el complejo se dimeriza y estabiliza por uno de los dedos de Zn. B: representación de las zonas del ADN donde se une el complejo RE2:E2. C: por el otro dedo de Zn se une al ERE del ADN en la región de regulación donde los correguladores positivos (+) o negativos () inducen por los factores de transcripción la expresión o represión de genes específicos. La interacción de los disruptores hormonales activando o inhibiendo la acción estrogénica se producen, entre otras, por las siguientes causas: a) unión y activación del RE2; b) unión pero no activación del RE2; c) el disruptor endocrino en estos casos puede modificar el E2 a formas impedidas de unirse al RE2, y d) inhibición de la transcripción.
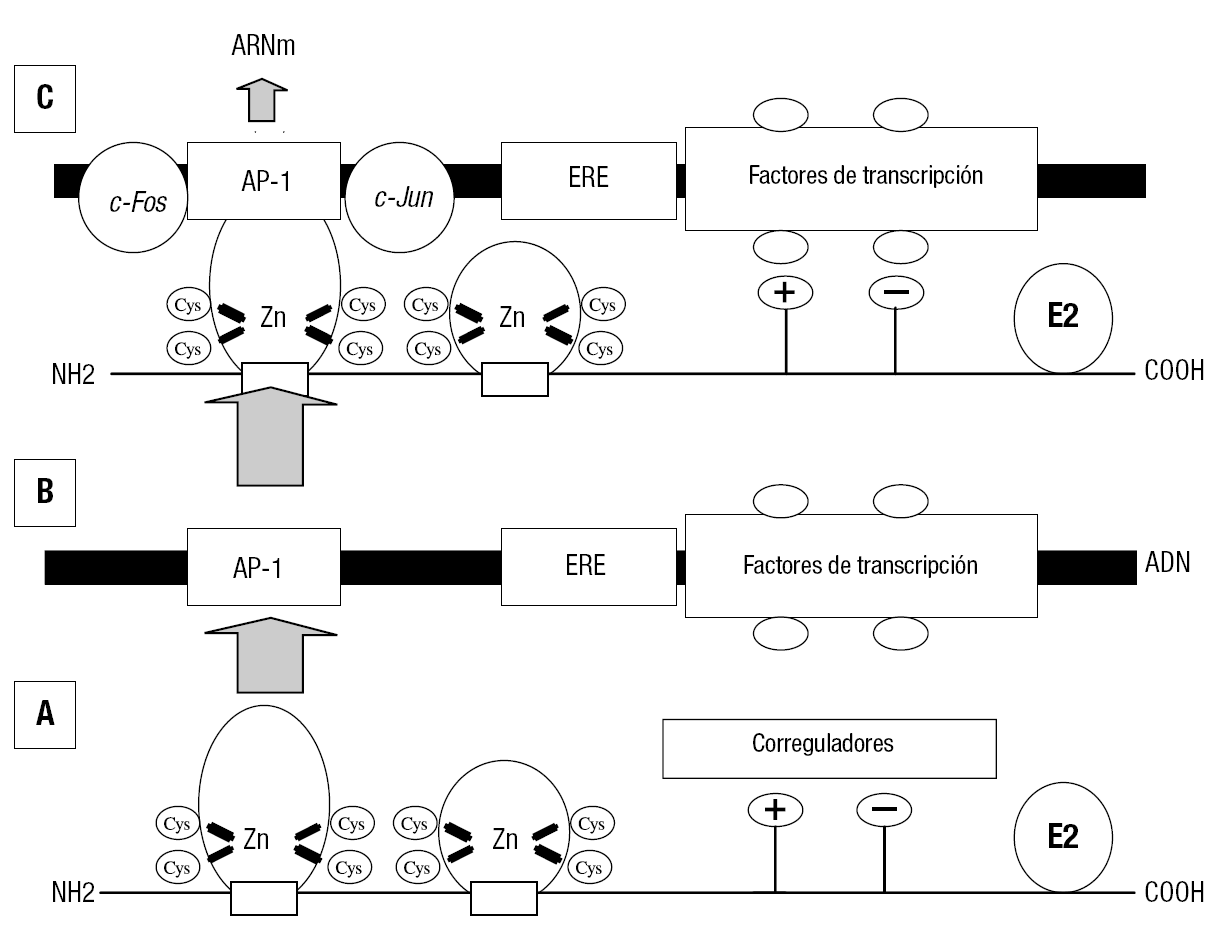
El otro mecanismo de acción resulta de la interacción del complejo estradiol-receptor, en una zona distinta del ERE del ADN. La figura 12 muestra un esquema de esta acción. El estradiol unido al receptor no se dimeriza, y por uno de los dedos de Zn activa la zona AP1 del ADN. Una vez unido al ADN (fig. 12B) activan 2 proteínas: la c-Fos y la c-Jun. Estas proteínas permiten la transcripción de un ARN mensajero que en el ribosoma va a inducir la respuesta biológica del estradiol36.
Figura 12. Mecanismo de acción genómica del E2:RE2 por interacción con una región del ADN denominada AP-1. A: interacción del complejo monomérico E2:RE2 con la región AP-1 del ADN, distinta del ERE. B: representación de las zonas del ADN donde se une el complejo E2:RE2. C: transcripción del complejo E2:RE2 en la zona AP-1 regulando la expresión de genes específicos a través de la interacción con proteínas reguladoras c-Fos y c-Jun.
Un tercer mecanismo de acción del estradiol es unirse a receptores de membrana. Activando la ruta de proteínas como el C-Src, Ras o Raf, que llevan a la activación de la proteincinasa activada por mitógenos (MAPK), que por fosforilación de sitios específicos de zonas de regulación del gen modulan la transcripción37.
MECANISMO DE ACCIÓN DE LOS DISRUPTORES ENDOCRINOS
Los disruptores endocrinos pueden actuar por lo menos a de cuatro maneras36,38-42:
Unión y activación del RE2 (efecto positivo).
Unión pero no activación del RE2 (efecto negativo).
Modificación del estradiol a formas impedidas de unirse al RE2 (efecto negativo).
Inhibición de la transcripción.
También los receptores de membrana podrían activarse por estrógenos ambientales, como un mecanismo de interrupción hormonal de éstos.
En síntesis, el mecanismo de acción de los disruptores hormonales podría tener varias vías:
Unión y activación de receptores estrogénicos.
Unión pero no activación del receptor estrogénico (en estos casos actuaría como un antiestrógeno).
Unión a otros receptores, como los receptores de andrógenos para hormonas masculinas. Esta unión puede activar o inactivar el receptor. Eso pasa con los antiandrógenos como el DDT y sus metabolitos.
Modificando el metabolismo hormonal. Algunos químicos como el lindano y la atrasan pueden efectuar el cambio metabólico del estradiol, produciendo más metabolitos estrogénicos. Otros químicos activan enzimas que aceleran el metabolismo de las hormonas y afectan a su estado natural. Los testículos contienen enzimas específicas para metabolizar estrógenos a una forma impedida de unirse a su receptor específico.
Modificando el número de receptores hormonales de la célula; el número de receptores en estas células es un mecanismo de control complejo y un químico podría reducir o incrementar el número de receptores y, por lo tanto, afectar al estado de respuesta a las hormonas naturales o artificiales.
Modificando la producción de hormonas naturales. Los químicos pueden afectar a la producción normal de hormonas por interferir en otros sistemas, como el tiroideo, el inmunitario o el nervioso.
Por inhibición selectiva de la transcripción del ADN. Se ha demostrado que el arsénico produce una interrupción en la transcripción del ADN inducida por glucocorticoides y mediada por su receptor.
Los disruptores endocrinos, que interaccionan activando el mecanismo del receptor, pueden inducir alteraciones en la espermatogénesis y en la producción de testosterona. Para tratar de explicar este fenómeno, dado que por este mecanismo se potencia la acción del estradiol, lo que describiremos son estudios de nuestro grupo en que demostramos que el incremento de estradiol produce estas alteraciones de la función testicular43-45. Se ha demostrado que una inyección de gonadotropina coriónica humana (hCG) produce una respuesta bifásica tanto en testosterona como en 17-hidroxiprogesterona. En ambos casos hay una respuesta rápida, aguda, luego un estado de quiescencia, y finalmente una respuesta tardía entre las 24 y 72 h, con un incremento significativamente mayor de ambos esteroides. Si en estas mismas muestras se determina el estradiol, éste tiene un aumento monofásico, con valores aumentados entre las 12 y las 24 h, que es el tiempo de latencia de la acción de la hCG en el testículo.
A la administración de una segunda inyección de hCG 24 h después, la respuesta aguda de testosterona está inhibida, pero francamente incrementada la segunda respuesta de 17-hidroxiprogesterona. La administración de un inhibidor de la aromatasa durante la semana previa a este estudio restituye la repuesta aguda de testosterona a la segunda inyección de hCG e inhibe la respuesta de 17-hidroxiprogesterona. Estos resultados indican que el incremento de estradiol inducido por la hCG indujo una resistencia parcial al estímulo con la gonadotrofina.
Se ha demostrado que el estradiol en la célula de Leydig, mediado por su acción a través del receptor, induce una heat shok protein que inhibe el citocromo P45017, y la segunda inyección induce una acumulación de 17-hidroxiprogesterona.
El mismo estudio realizado en pacientes oligoastenoespérmicos comparados con los varones normales, demuestra que presentaron diferentes tipos de respuestas: respuesta similar a la normal o nula o escasa respuesta aguda de la testosterona a la hCG.
Estos resultados indican que, en este subgrupo de pacientes oligoastenoespérmicos, su perfil hormonal al estímulo gonadotrófico fue similar al de si 24 h antes hubieran recibido un primer estímulo con hCG, lo que indica una resistencia testicular.
A los efectos de demostrar si esta resistencia parcial en este subgrupo de pacientes se debe al incremento de la concentración intratesticular de estradiol, analizamos lo del tratamiento con dos inhibidores de la aromatasa: la aminoglutetimida administrada conjuntamente con glucocorticoides y un derivado de la androstenediona. Ninguno de los pacientes con respuesta aguda normal de testosterona al estímulo con hCG mejoró el espermograma, ni hubo cambios en la respuesta de la testosterona a la hCG.
Los pacientes sin respuesta aguda al estímulo con hCG se clasificaron en 3 grupos: con severa oligospermia (n = 10), con una moderada oligospermia (n = 14) y astenospérmicos (n = 17).
La respuesta a los inhibidores de aromatasa mostró un incremento de espermatozoides de 2 ± 1 a 30 ± 18 millones/ml, y de 10 ± 9 a 21 ± 18% de espermatozoides grado 3 en los pacientes con severa oligospermia. En el grupo de pacientes con moderada oligospermia, la concentración espermática se modifico de 10 ± 4 a 46 ± 37 millones/ml y de 7 ± 5 a 21 ± 18% de espermatozoides grado 3. En los pacientes astenospérmicos, obviamente no hubo cambios significativos en la modificación de la concentración espermática, pero sí se modificaron el porcentaje del grado 3 de espermatozoides de 7 ± 6 a 21 ± 9. De los pacientes con severa oligospermia, 8 de los 10 mejoraron la calidad del semen y se lograron 3 embarazos. En los pacientes con moderada oligospermia, 13 de los 14 mejoraron el semen y se lograron 6 embarazos, y de los pacientes astenospérmicos, 12 de los 17 mejoraron el semen y se lograron 5 embarazos.
Estos resultados demuestran el efecto nocivo en la calidad espermática y la producción de testosterona en pacientes con altas concentraciones de estradiol intratesticulares. Posiblemente el mecanismo de los disruptores endocrinos agonistas del estradiol sea semejante al descrito.
CONCLUSIONES
Se han publicado datos alarmantes en estudios de campo, experimentos de laboratorio y estadísticas humanas, que plantean que este peligro no pase inadvertido. Este problema ambiental se ha descrito en numerosos libros, entre ellos, los de Carson46, Colborn et al47 y Krinsky48. Particularmente en este último libro, se establece que un grupo de productos químicos industriales y de la agricultura en contacto con humanos imitan u obstruyen la función hormonal, distorsionando el desarrollo normal.
Los disruptores endocrinos, además, presentan otros mecanismos diferentes de la acción estrogénica; entre otros, pueden activar o inhibir el receptor de andrógenos49,50; modular el receptor de glucocorticoides, inhibiendo la transcripción51, y activar el receptor retinoide, actuando como un retinoide ambiental52. Aunque no son categóricos los resultados, hay trabajos que muestran que activan los receptores de las hormonas tiroideas53, aunque otros investigadores no encuentran tales resultados54. Pero sí se ha descrito que algunos disruptores endocrinos modifican las proteínas transportadoras de T4 y T353,55.
Podríamos decir que las concentraciones de estos disruptores son muy superiores a las circulantes y no los transportan las proteínas, por lo cual esta concentración resulta biológicamente activa.
Las distintas sociedades científicas deberían tratar de obtener mayor efectividad en el control de las sustancias químicas, para la protección de la salud y del medio ambiente. Eso no significa que se prohiba la síntesis de estos compuestos, alguno de los cuales tiene importantes acciones en la agricultura y la ganadería. Lo que sí debería lograrse es una mayor motivación para que la industria química desarrolle compuestos con estas acciones benéficas que no intervengan en el mecanismo hormonal.
Correspondencia: H.E. Scaglia.
IABE.
Calle 53 #969. La Plata. República Argentina.
Correo electrónico: iabe@speedy.com.ar