O espermatozoide é o gâmeta masculino e, como tal, a sua principal função é fecundar o oócito. Aquando da ejaculação, esta célula ainda não se encontra madura, pelo que não consegue realizar a sua função. Ao entrar em contato com o trato reprodutor feminino, o espermatozoide sofre a capacitação. Este processo é caracterizado por alterações bioquímicas e funcionais. A reação acrossómica é o processo final para a fecundação e caracteriza‐se pela libertação das enzimas de proteolíticas que hidrolisam a zona pelúcida. Todos estes processos dependem de vias de sinalização. A maioria das vias de sinalização descritas para células somáticas já foram identificadas no espermatozoide, contudo, os seus efeitos não são completamente conhecidos. Nesta revisão serão descritas as principais vias de sinalização dos espermatozoides, nomeadamente PPP1CC2, cAMP/PKA, fosfolipase C, PI3K‐AKT e ROS.
Spermatozoon is the male gamete and its main function is to fertilize the oocyte. When ejaculation occurs, this cell is immature and therefore cannot perform its function. When it contacts the female reproductive tract, the sperm undergoes capacitation. This process is characterized by biochemical and functional changes. The acrosome reaction is the last process for fertilization and it is characterized by the release of proteolytic enzymes which hydrolyze the zona pellucida. All of these processes depend of signaling pathways. Most of the signaling pathways described for somatic cells have been identified in the sperm, but their effects are not completely known. In this review the main signaling pathways of sperm are described, including PPP1CC2, cAMP/PKA, phospholipase C, PI3K‐AKT and ROS.
Os organismos multicelulares apresentam várias características funcionais e estruturais únicas, sendo que esta situação se deve à capacidade das células comunicarem entre si, permitindo que uma única célula influencie o comportamento de outras células1. As células podem comunicar entre si de diversas maneiras, entre as quais se podem referir os mensageiros químicos, as gap junctions (canais que ligam 2 células vizinhas permitindo assim uma troca de moléculas), e as interações célula‐célula. Estas interações célula‐célula ocorrem devido a proteínas de superfície que permitem a comunicação direta entre 2 células vizinhas1,2.
As comunicações entre células dependem de vias de sinalização. Estas vias de sinalização ocorrem devido à participação de diferentes moléculas sinalizadoras, denominadas de mensageiros. Assim, numa via de sinalização celular, as moléculas que fornecem informação às células, promovendo o início da via correspondem aos mensageiros primários. Estes mensageiros ligam‐se a recetores específicos, que podem estar na membrana plasmática ou no interior da célula. Os recetores reconhecem o sinal, transmitindo um sinal para os mensageiros secundários, que são moléculas intracelulares, e que, que por sua vez, têm como função transmitir os sinais para alvos moleculares intracelulares específicos1,2.
A transdução de sinais intercelulares influencia quase todas as reações fisiológicas e ganha particular importância ao assegurar que todas as células têm uma reação sincronizada1,2.
O espermatozoide é o gâmeta masculino, cuja produção ocorre nos testículos (espermatogénese). Contudo, após a espermatogénese, o espermatozoide não é funcionalmente maduro. As modificações funcionais que o espermatozoide sofre no epidídimo e trato reprodutor feminino (aquisição da mobilidade, capacitação e reação acrossómica) são fundamentais para a fecundação do oócito3. Esta revisão irá abordar as principais vias de sinalização envolvidas na aquisição da mobilidade, capacitação e reação acrossómica no espermatozoide.
EspermatozoideO espermatozoide tem como objetivo percorrer o trato reprodutor feminino e fundir‐se com um oócito, de forma a formar um ovo, que posteriormente evolui para embrião4,5. Esta célula está coberta com uma única membrana plasmática, designada plasmalema e encontra‐se dividida em 2 partes: a cabeça e a cauda ou flagelo5.
A cabeça do espermatozoide tem uma forma achatada e pontiaguda e é constituída pelo núcleo, pelo acrossoma e por uma membrana celular. O núcleo contém o ácido desoxirribonucleico (ADN) condensado e ligado a protaminas, moléculas que substituem as histonas, conduzindo a uma maior condensação do ADN. O facto de o ADN estar altamente condensado impossibilita a sua transcrição e como tal não existe expressão génica no espermatozoide. O núcleo encontra‐se revestido por um envelope nuclear reduzido e protegido pela teca perinuclear5.
A cauda do espermatozoide consiste num arranjo de 9 pares de microtúbulos em círculo e um par central – axonema flagelar espermático –, fornecendo a força de mobilidade ao espermatozoide. A cauda encontra‐se dividida em 4 regiões: peça conectora, peça intermédia, peça principal e peça final. Na peça conectora encontram‐se os centríolos e corresponde ao local de origem das fibras densas, que são estruturas que recobrem o axonema. Na peça intermédia encontram‐se as mitocôndrias (organelos que fornecem energia para o movimento da cauda), que se encontram a rodear fibras densas e o axonema. A peça principal é a região mais comprida do espermatozoide e contém as bainhas fibrosas externas que envolvem as fibras densas e o axonema. A peça final contém axonemas duplos e termina exteriormente com fibras densas e uma camada fibrosa5.
A produção e maturação dos espermatozoides são divididas em 4 processos: (a) espermatogénese (nos testículos), (b) maturação no epidídimo, (c) capacitação no trato reprodutor feminino e (d) reação acrossómica3,6–8. É de referir que apenas uma pequena parte dos espermatozoides que entram em contato com o trato reprodutor feminino vão sofrer processos de maturação6.
A maturação dos espermatozoides no epidídimo caracteriza‐se principalmente pela aquisição de mobilidade progressiva. O processo de capacitação, já no trato reprodutor feminino, é caracterizado pela mudança no padrão da mobilidade (hiperativação) do espermatozoide e a aquisição de capacidade, para posterior ocorrência da reação do acrossoma3,8. As modificações preparatórias que ocorrem na capacitação referem‐se à remoção de proteínas/glicoproteínas do plasma seminal, adsorvidas na superfície dos espermatozoides ejaculados, e modificação/reorganização das moléculas da superfície dos espermatozoides, durante a passagem pelo trato reprodutor feminino, resultando na modificação do plasmalema destas células6. A reação acrossómica caracteriza‐se pelo reconhecimento e ligação do espermatozoide capacitado à zona pelúcida do oócito, através de uma ligação ligando‐recetor e libertação do conteúdo acrossómico6,8. Morfologicamente, a exocitose de conteúdos acrossomais inicia‐se com a fusão gradual da membrana plasmática do espermatozoide e a membrana externa do acrossoma, em diversos locais. O processo é lento e pode ser regulado pelas mudanças nas membranas do espermatozoide e nos elementos do citoesqueleto, tal como os filamentos de F‐actina presentes entre a membrana plasmática e a membrana externa do acrossoma, que podem ajudar o espermatozoide a penetrar gradualmente na zona pelúcida. A ação poderosa das enzimas hidrolíticas libertadas na superfície da zona pelúcida torna possível a ligação dos espermatozoides ao oócito, que é, assim, fertilizado6,9.
Vias de sinalização no espermatozoideTal como referido anteriormente, as vias de sinalização celular têm início com a ligação de um mensageiro primário, produzido por células sinalizadoras, a recetores específicos, presentes na membrana plasmática ou no interior das células. Esta ligação ativa moléculas intracelulares, denominadas mensageiros secundários, que, por sua vez, transmitem sinais para alvos moleculares intracelulares específicos1,2,10.
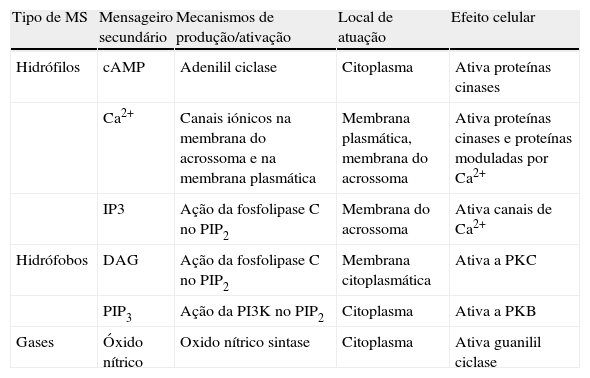
De entre as vias de sinalização celular presentes nos espermatozoides, aquelas que têm maior relevância são as que estão relacionadas com o processo de aquisição de mobilidade, capacitação e com a reação acrossómica. Seguidamente, serão discutidas as principais vias envolvidas nos processos mencionados: via da fosfoproteína fosfatase 1 centro catalítico 2 (phosphoprotein phosphatase 1 catalitic center 2 – PPP1CC2), via da adenosina monofosfato cíclico/proteína cinase A (cyclic adenosine monophosphate/protein kinase A – cAMP/PKA), via da fosfolipase C (phospholipase C – PLC), via de fosfatidilinositol‐3‐cinase/proteína cinase B (phosphatidylinositide 3‐kinase/protein kinase B – PI3K/AKT) e via das espécies reativas do oxigénio (reactive oxygen species – ROS). Na tabela 1 são apresentados os mensageiros secundários com relevância para as vias anteriormente referidas1.
Mensageiros secundários envolvidos nas vias de sinalização dos espermatozoides. Na tabela encontram‐se apresentados os locais de produção, de atuação e o efeito celular destes mensageiros
| Tipo de MS | Mensageiro secundário | Mecanismos de produção/ativação | Local de atuação | Efeito celular |
| Hidrófilos | cAMP | Adenilil ciclase | Citoplasma | Ativa proteínas cinases |
| Ca2+ | Canais iónicos na membrana do acrossoma e na membrana plasmática | Membrana plasmática, membrana do acrossoma | Ativa proteínas cinases e proteínas moduladas por Ca2+ | |
| IP3 | Ação da fosfolipase C no PIP2 | Membrana do acrossoma | Ativa canais de Ca2+ | |
| Hidrófobos | DAG | Ação da fosfolipase C no PIP2 | Membrana citoplasmática | Ativa a PKC |
| PIP3 | Ação da PI3K no PIP2 | Citoplasma | Ativa a PKB | |
| Gases | Óxido nítrico | Oxido nítrico sintase | Citoplasma | Ativa guanilil ciclase |
MS: mensageiros secundários.
Após a espermatogénese, os espermatozoides são morfologicamente maduros, mas incapazes de movimento. A mobilidade é adquirida ao longo do epidídimo e aparenta ser dependente da PPP1CC2, uma isoforma da fosfoproteína fosfatase 1 (PPP1), específica de espermatozoide11. Nos espermatozoides, níveis elevados de atividade de PPP1 estão associados à imobilidade dos espermatozoides no caput do epidídimo. Na zona distal do epidídimo, os níveis de atividade da PPP1 são baixos e os espermatozoides apresentam mobilidade progressiva12. A regulação da atividade da PPP1CC2 é controlada por proteínas que interagem com esta, «PPP1 interacting proteins» (PIP)11.
Uma PIP que modula a atividade da PPP1CC2 é a regulador 2 da fosfoproteína fosfatase 1 (phosphoprotein phosphatase 1 regulator 2‐ PPP1R2), um inibidor da PPP1CC2. Quando a PPP1CC2 e a PPP1R2 formam um complexo, a atividade da PP1CC2 é inibida. Contudo, no caput do epidídimo, a PPP1R2 é fosforilada pelo glicogénio sintase cinase 3 (GSK3) e sofre uma mudança conformacional que resulta na disrupção do complexo. Consequentemente, a PPP1CC2 está ativa e os espermatozoides imóveis. Durante a passagem dos espermatozoides pelo epidídimo, um resíduo de serina GSK3 sofre fosforilação progressiva por ação da PKB, inibindo esta cinase. Desta forma, a fosforilação do PPP1R2 diminui resultando na formação do complexo PPP1CC2‐PPP1R2, inibição da PPP1CC2 e aquisição de mobilidade pelos espermatozoides. Fardilha et al. identificaram no espermatozoide uma isoforma de PPP1R2, a PPP1R2R3. Esta proteína apresenta uma particularidade: é incapaz de ser fosforilada pela GSK3, sendo um inibidor constitutivo da PPP1CC2. Esta proteína pode ser responsável pela inibição irreversível da PPP1CC2 na cauda do epidídimo e assim garantir a mobilidade dos espermatozoides11,13.
Existem outras PIP que regulam a atividade da PPP1CC2 no espermatozoide, como por exemplo, sds22. No caput do epidídimo, o sds22, um inibidor da PPP1CC2, está ligado ao p17, sendo incapaz de inibir a PPP1CC2. Contudo, na cauda do epidídimo, o sds22 deixa de estar ligado ao p17 e assim liga‐se a PPP1CC2, inibindo a sua atividade11.
Via de sinalização do cAMP/PKAA capacitação do espermatozoide envolve a ocorrência de diversos eventos moleculares, tais como a remoção de colesterol da membrana plasmática e o fluxo de iões na membrana. Estes eventos provocam alterações no potencial de membrana e aumento da fosforilação de proteínas envolvidas na indução da hiperativação e na reação acrossómica do espermatozoide14.
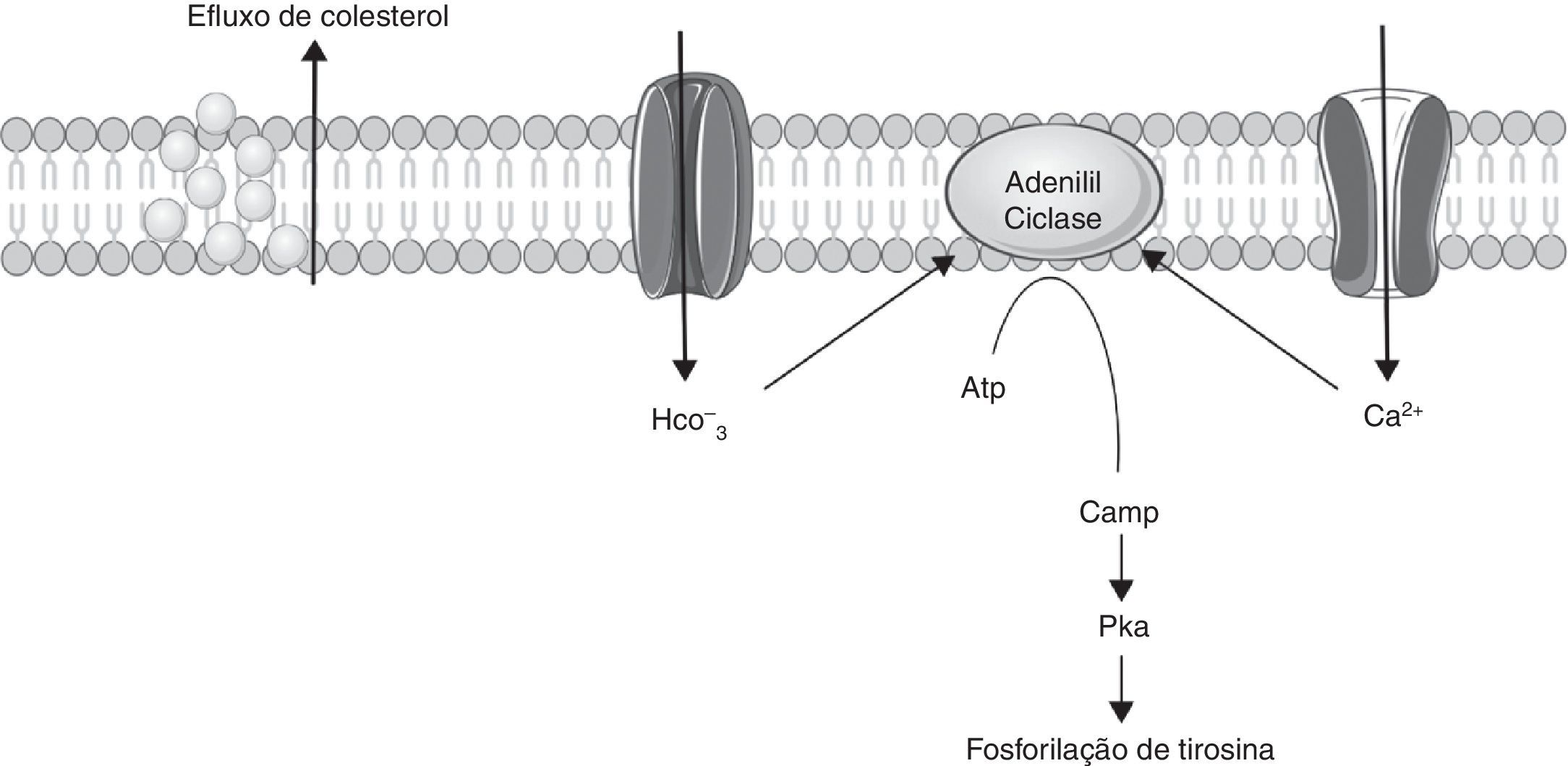
Efluxo de colesterolA albumina é a principal proteína nas secreções do trato reprodutor masculino, desempenhando um papel importante na capacitação, destacando‐se a remoção do colesterol e outros esteróis da membrana plasmática15. Esta remoção de esteróis, mais especificamente do colesterol, leva a um decréscimo da taxa de colesterol/fosfolípidos, que, por sua vez, é responsável pela alteração da fluidez da membrana, devido à redistribuição das proteínas da membrana. As alterações relacionadas com a capacitação, que ocorrem no comportamento fosfolipídico da bicamada e resultam numa desordem lipídica na membrana, estão associadas à via dependente de adenosina‐3’,5’‐monofosfato cíclico (cAMP) após a exposição do espermatozoide a bicarbonato (HCO3−)14,16.
Fluxo de iõesOs espermatozoides estão sujeitos a mudanças significativas no meio extracelular, quer no seu trajeto pelo trato masculino quer pelo trato feminino, sendo que as alterações nas concentrações de iões extracelulares e a osmolaridade são os mais significativos. Relativamente aos iões extracelulares, os espermatozoides presentes na cauda do epidídimo encontram‐se num meio rico em potássio (K+), com baixa concentração de sódio (Na+) e HCO3−. No entanto, quando presentes no fluido seminal, após ejaculação, e no trato reprodutor feminino, ocorre uma diminuição da concentração de K+ e Na+ e um aumento da concentração de HCO3−. Estas mudanças na concentração do meio extracelular desencadeiam uma alteração da concentração iónica intracelular, levando a uma mudança do potencial de membrana na membrana plasmática dos espermatozoides14,17.
Vias do HCO3− do Ca2+ e da cAMPA capacitação é um processo dependente de HCO3−. O movimento transmembranar dos aniões de bicarbonato é mediado por membros da família dos cotransportadores da Na+/HCO3−. Este movimento de HCO3− é responsável pelo aumento do pH intracelular, que ocorre durante a capacitação18. Para além disso, este anião regula o metabolismo de cAMP, visto que a síntese de cAMP pela adenilil ciclase (AC) é fortemente estimulada pelo HCO3−. Estas alterações, estimulação da AC e produção de cAMP, provocadas pelo aumento de HCO3− e de cálcio (Ca2+), desempenham um papel importante na capacitação6,14,16,17,19,20. É de notar que nos espermatozoides há uma isoforma específica de AC, a adenilil ciclase solúvel (sAC), que, ao contrário das restantes isoformas presentes nas células eucarióticas, não é sensível à proteína G ou à regulação pela forskolin, sendo mais ativa na presença de manganésio (Mn2+) do que na presença de magnésio (Mg2+)6,14,18. Esta via encontra‐se representada na figura 1.
Representação esquemática da via da cAMP/PKA. A concentração intracelular de bicarbonato e de cálcio ativam a adenilil ciclase. Esta ativa o cAMP através da sua interação com o ATP. Por sua vez, a cAMP ativa a PKA que está envolvida na fosforilação proteica. A fosforilação de proteínas é o principal mecanismo envolvido na capacitação dos espermatozoides.
ATP: adenosina trifosfato; cAMP: adenosina 3’,5’‐monofosfato cíclico; HCO3−: bicarbonato; PKA – proteína cinase A. Elementos gráficos retirados da Servier Medical Art.
O cálcio é uma importante molécula de sinalização para a capacitação do espermatozoide. Este catião divalente exerce o seu efeito através das interações que estabelece com a calmodulina e com outras proteínas de ligação ao cálcio1,21. Os espermatozoides possuem altos níveis de calmodulina na cabeça e no flagelo, localização que está de acordo com o seu papel fisiológico desempenhado na capacitação e na indução da reação acrossómica6,14.
Fosforilação de tirosinaO aumento da fosforilação da tirosina depende da concentração de albumina, de Ca2+ e de HCO3−. Estas concentrações são semelhantes às necessárias para o processo de capacitação6,14,17.
A fosforilação da tirosina, induzida pela cAMP, é dependente do efluxo de colesterol. Atualmente não se sabe se a remoção de colesterol ocorre antes ou simultaneamente à ação do Ca2+ ou do Na/HCO3+, contudo, uma das hipóteses estudadas refere que a remoção de colesterol provoca alterações na fluidez da membrana plasmática e consequentemente modula os fluxos iónicos de Ca2+ e de HCO3−, que levam à ativação da sAC6,14,17.
A cAMP tem como principal função ativar a PKA, uma cinase de tirosinas. O envolvimento desta proteína na fosforilação da tirosina foi corroborado por estudos em que os inibidores da atividade da PKA inibiram, também, a fosforilação da tirosina, bem como o processo de capacitação22. A PKA pode exercer a sua ação através de 3 mecanismos: (1) estimulação direta ou indireta de uma tirosina cinase; (2) inibição direta ou indireta da fosfatase fosfotirosina; (3) fosforilação direta ou indireta de proteínas nos resíduos de serina ou treonina que marcam essas proteínas para consequente fosforilação dos resíduos de tirosina6,14,16,17,20.
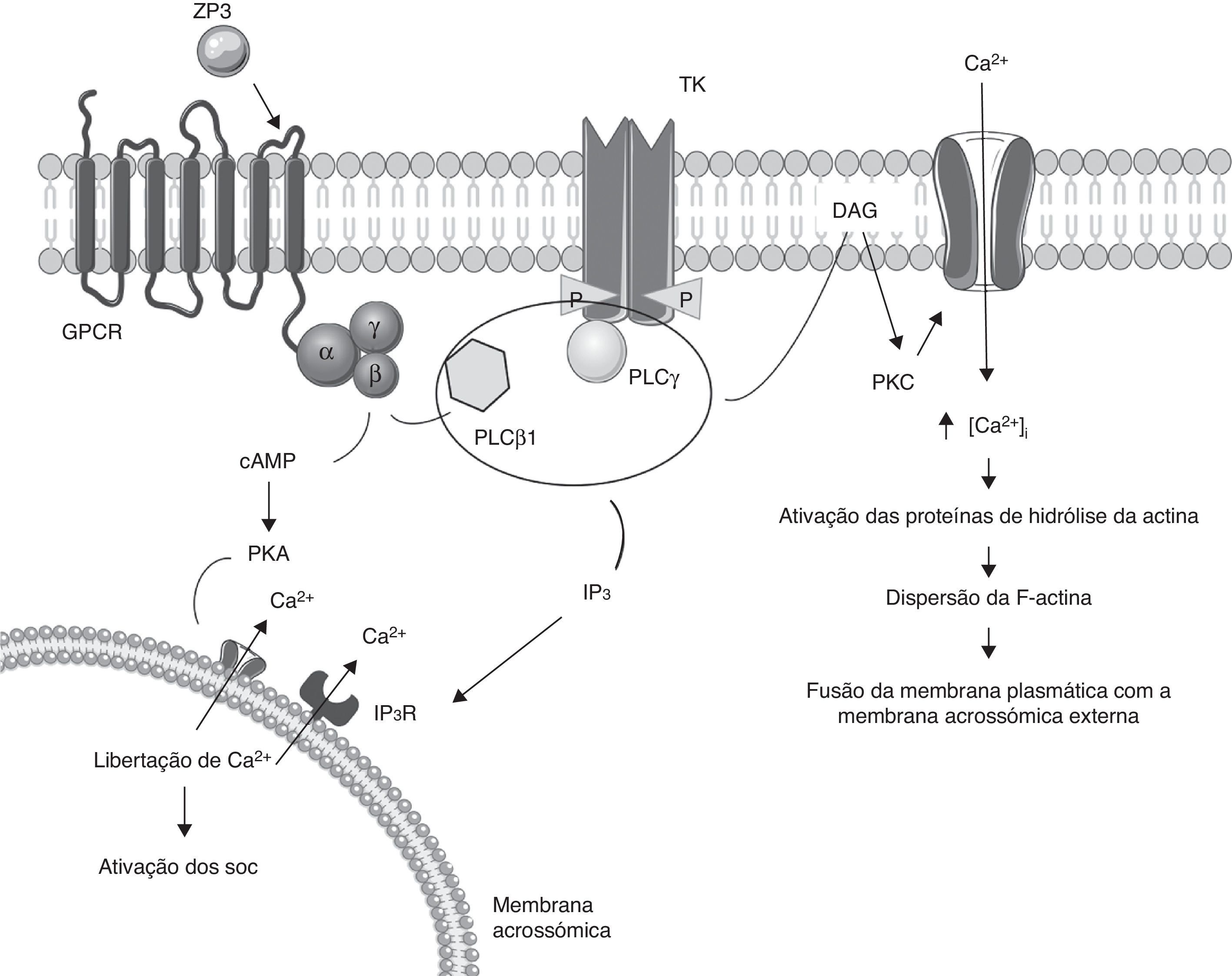
Via de sinalização da fosfolipase CA glicoproteína da zona pelúcida 3 (ZP3) desempenha um papel importante na reação acrossómica (fig. 2). Esta proteína liga‐se a 2 recetores na membrana plasmática: recetores acoplados a proteínas G inibitórias (recetores Gi) e recetores de tirosina cinase15,23. A ligação da ZP3 aos recetores Gi ativa a PLC, neste caso a isoforma PLCβ1, e regula a atividade da sAC para a produção de cAMP e, assim, ativar a PKA. Por outro lado, a ligação da proteína aos recetores de tirosina cinase leva à ativação da PLC, isoforma PLCγ. A ativação de ambas as fosfolipases leva à formação de Inositol‐1,4,5‐trifosfato (IP3) e de diacilglicerol (DAG). O IP3, bem como o PKA, ativam os canais de Ca2+ presentes na membrana acrossómica externa, promovendo a transferência de Ca2+ das reservas intracelulares (neste caso, o acrossoma) para o citoplasma16. Por sua vez, o DAG ativa a proteína cinase C (PKC) levando à abertura dos canais de Ca2+ na membrana plasmática24. Como resultado destas alterações, a concentração de Ca2+ citosólico aumenta enquanto a concentração de Ca2+ acrossomal é reduzida, o que leva à ativação do Store‐operated Ca2+ channels (SOC) e a um posterior aumento significativo da concentração de Ca2+ citosólico18,25. Os níveis elevados de cálcio ativam a proteína de hidrólise da actina, de forma a dispersar a barreira de f‐actina que está presente entre a membrana externa do acrossoma e a membrana plasmática subjacente9,16. Desta forma, as 2 membranas podem entrar em contacto, sofrendo uma posterior fusão, num processo designado reação acrossómica16,26.
Representação esquemática da via da fosfolipase C. A ligação das proteínas ZP3 aos recetores acoplados a proteína G ativa a cAMP e a PLCβ1. A cAMP, por sua vez, ativa a PKA, levando à abertura dos canais de cálcio na membrana do acrossoma, com libertação do cálcio para o meio intracelular. A ligação da ZP3 aos recetores de tirosina leva à ativação da PLCγ. As PLC ativam o IP3 e o DAG. O IP3 ativa os canais de cálcio da membrana do acrossoma, levando à libertação do cálcio acrossómico para o espaço intracelular. O DAG, ao ativar a PKC, promove a abertura dos canais de cálcio da membrana plasmática. O aumento da concentração intracelular de cálcio degrada a actina, levando à fusão das membranas acrossómicas e citoplasmáticas.
cAMP: adenosina 3’,5’‐monofosfato cíclico; DAG: diacilglicerol; GPCR: recetor acoplado à proteína G; IP3: inositol‐1,4,5‐trifosfato; IP3R: recetores do inositol‐1,4,5‐trifosfato; PKA: proteína cinase A; PKC: proteína cinase C; PLC: fosfolipase C; SOC:store‐operated Ca2+ channels. Elementos gráficos retirados da Servier Medical Art.
A progesterona é uma hormona esteroide que funciona como regulador fisiológico da hiperativação e da reação acrossómica no espermatozoide, através da ativação de cinases presentes nestas células. A progesterona é produzida pelas células do cumulus oophorus e é importante para a quimiotaxia, a motilidade e a hiperativação do espermatozoide, bem como a reação acrossómica27–30. Nas células somáticas, a progesterona liga‐se aos seus recetores presentes no núcleo e regula a transcrição de genes. No entanto, os espermatozoides não possuem recetores de progesterona neste organelo. Assim, a progesterona atua na membrana plasmática, iniciando uma série de eventos de sinalização intracelular27,19,31. Esta hormona é responsável por aumentar o cálcio intracelular nos espermatozoides, atuando sobre os canais CatSper presentes no flagelo destas células27,28,32.
A progesterona atua, também, como mensageiro primário ao ativar o PI3K. Este por sua vez fosforila a proteína cinase B nos resíduos Thr308 e Ser473, ativando‐a. Esta ativação ocorre ao longo do flagelo do espermatozoide e necessita do influxo de cálcio, que, por sua vez, está dependente da atividade dos canais CatSper4,20,27,32.
Para além do seu papel na via da PI3K‐AKT, a progesterona é responsável por ativar inúmeras proteínas cinases, tais como o PKA e o PKC, em outras vias de sinalização presentes nos espermatozoides27.
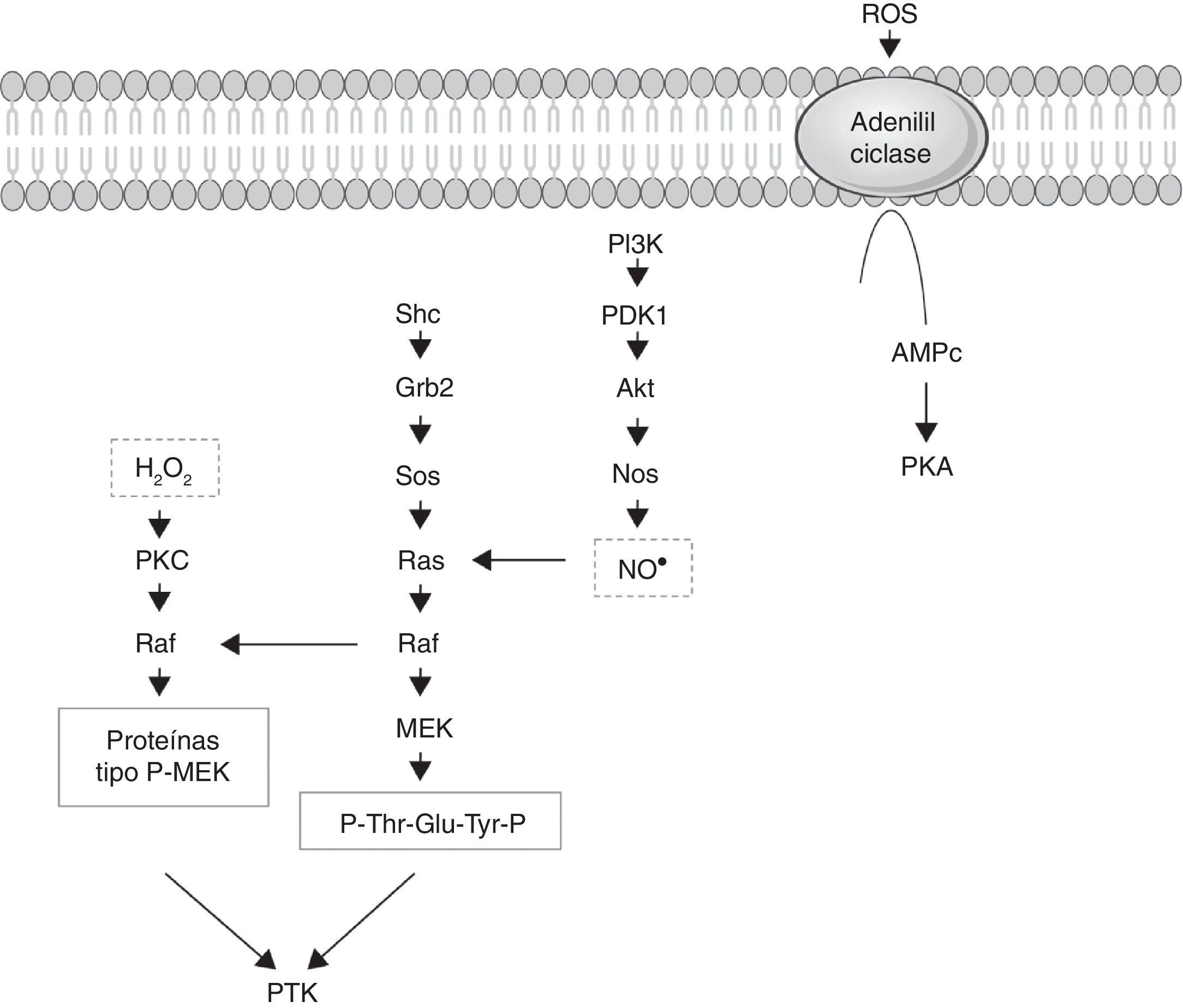
Via de sinalização das ROSAs ROS desempenham uma dupla função na fisiologia do espermatozoide. Quando presentes em grandes quantidades desempenham uma função crítica no espermatozoide, danificando o seu ADN e membranas, o que pode levar a um funcionamento anormal destas células ou até mesmo à morte celular33. No entanto, quando presentes em concentrações controladas, desempenham um importante papel na capacitação. Entre os ROS mais comuns pode‐se referir o anião superóxido (•O2−), o peróxido de hidrogénio (H2O2) e o óxido nítrico (NO−)4,20. Estas espécies reativas ativam recetores na membrana plasmática dos espermatozoides, dando início a várias vias de sinalização celular envolvidas na capacitação, representadas na figura 34,20.
Representação esquemática da via de sinalização iniciada pelas ROS. As ROS podem participar no processo de capacitação por diversos mecanismos: ativação das AC, com produção celular de PKA; ativação das vias do ERK, do PI3K e do PKC, que conduzem à ativação da PTK, que, por sua vez, é responsável pela fosforilação de proteínas. A fosforilação de proteínas pela PKA e pelo PTK está na base do processo de capacitação.
Akt: fosfolipase B; cAMP: adenosina 3’,5’‐monofosfato cíclico; ERK: extracellular signal‐regulated kinase; H2O2: peróxido de hidrogénio; PDK1: phosphoinositide‐dependent kinase‐1; MEK: MAP/ERK cinase; NO: óxido nítrico; PKA: proteína cinase A; NOS: sintetase do óxido nítrico; PI3K: fosfatidilinositol 3‐cinase; PKC: proteína cinase C; ROS: espécies reativas de oxigénio. Elementos gráficos retirados da Servier Medical Art.
Um dos possíveis alvos das ROS é a sAC. A estimulação da sAC pelas ROS leva a um aumento da cAMP intracelular que, por sua vez, estimula a PKA4,20,34,33,35. Este processo é idêntico ao descrito anteriormente para a via de sinalização da cAMP/PKA.
Para além da via descrita acima, o H2O2 atua sobre a PKC ativando‐a, o que leva à fosforilação da Raf, uma cinase responsável pela fosforilação da MEK e de proteínas tipo‐MEK4,20,33,36,37.
O PI3K está presente em várias vias de sinalização. Uma das suas ações consiste em fosforilar o 3,4,5‐trifosfato de fosfatidilinositol (PIP3), um intermediário da ativação de várias enzimas, entre as quais a cinase dependente de PIP3 (PDK), AKT, a PLC, a PKC, a PKA e a óxido nítrico sintetase (NOS). A estimulação da sintetase de NO− pela AKT resulta no aumento dos níveis deste ião, que por sua vez, ativa o Ras4,20,38.
A proteína Shc está presente na região acrossomal do espermatozoide humano e é fosforilada em resíduos de tirosina. Contudo, o mecanismo de regulação desta proteína pelas ROS ainda não foi descrito. Esta proteína, quando fosforilada, ativa a Grb2, que por sua vez ativa a Sos. Esta última tem como função ativar a Ras. A Ras ativa sequencialmente um módulo (denominado ERK) composto por 3 cinases: Raf (MAPK kinase kinase, uma cinase de serina treonina), MEK (com dupla especificidade para a serina/treonina e a tirosina) e proteínas tipo MEK. O MEK fosforila os resíduos de treonina e de tirosina presentes nos motivos Thr‐Glu‐Tyr4,20,39.
ConclusãoO espermatozoide, após ser produzido nos testículos, necessita de passar por várias etapas de desenvolvimento para ser capaz de fertilizar o oócito. As etapas mais importantes ocorrem no epidídimo, onde adquire a mobilidade, e no trato reprodutor feminino, onde sofre a capacitação e reação acrossómica. Estas etapas envolvem a ativação de várias vias de sinalização celular, que culminam com a fosforilação de várias moléculas. A fosforilação de moléculas desencadeia várias alterações nos espermatozoides que lhe permitem exercer a sua principal função: fertilizar o oócito. As diferentes vias de sinalização envolvidas no processo de capacitação do espermatozoide e na reação acrossómica podem interagir entre si, o que significa que modificações numa via influenciam outras vias e, consequentemente, a resposta final.
Responsabilidades éticasDireito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo
Proteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Conflito de interessesOs autores declaram não haver conflito de interesses.