El Mielomeningocele (MMC) es una malformación congénita frecuente asociada a morbimortalidad importante. El manejo post natal estándar no ha ofrecido cambios significativos en sus resultados en los últimos años. La publicación del MOMS (Management of Myelomeningocele study) en 2011 demostró que la cirugía fetal del MMC disminuía la necesidad de derivativa de líquido cefalorraquídeo, revertía la herniación del tronco cerebral y mejoraba la calidad de la marcha a los 30 meses de vida, a pesar de un mayor número de parto prematuro y complicaciones maternas. Estos resultados motivaron a nuestro grupo a iniciar una experiencia en cirugía fetal del MMC. Este trabajo generó un protocolo de manejo en Clínica Las Condes contabilizando a la fecha 26 casos operados con resultados alentadores. Los avances en esta técnica siguen adelante en pos de disminuir la incidencia de parto prematuro, abriendo la posibilidad al tratamiento intrauterino de otras patologías.
Myelomeningocele (MMC), is a common congenital malformation associated with significant morbidity and mortality. The standard postnatal management has offered no significant changes in its results in the last years. The publication of the MOMS (Management of Myelomeningocele study) in 2011 showed that fetal surgery for MMC decreased the need for shunt of cerebrospinal fluid, reversed brainstem herniation and improved ride quality at 30 months, despite a greater number of premature delivery and maternal complications. These results encourage our group to start an experience in fetal surgery for MMC. This work generated a management protocol at Clínica Las Condes accounting to date 26 cases operated with encouraging results. The advances in this technique are continuing towards reducing the incidence of premature delivery and opening the possibility of intrauterine treatment for other fetal pathologies.
Los defectos de tubo neural constituyen la segunda causa de malformaciones congénitas en Chile. Es una malformación devastadora, de alto impacto sobre la calidad de vida de los pacientes y de elevado costo para las familias y sus sistemas de salud 1,2. La incidencia en Chile antes del año 2000 era de 17,03 a 17,1 x 10.000 nacidos vivos y de 8,7 considerando solo espina bífida abierta. Posterior a la implementación del Programa de Fortificación de Harinas con Ácido Fólico en el 2000, ésta se ha reducido a una tasa estimada de 7,8 en general y 3,9 para espina bífida abierta x 10000 en RN, vivos y muertos, con peso igual o mayor a 500 gramos (52% de reducción). Esto implica que en Chile, con 260.000 RN vivos por año, podemos esperar 166 casos nuevos anuales 3.
La espina bífida abierta o mielomeningocele (MMC) es una anomalía congénita del tubo neural. Se caracteriza por un cierre incompleto del tubo neural, esto lleva a una falta de inducción del cierre de la columna ósea, de los planos musculares y de la piel, quedando la médula espinal y las meninges expuestas al líquido amniótico de la cavidad uterina. Este tejido neural expuesto se daña en forma mecánica por roce a medida que el feto va creciendo. Además, el líquido amniótico va cambiando su composición a medida que progresa el embarazo, volviéndose más alcalino y generando daños químicos sobre la sensible placa neural.
Los avances en el manejo de la espina bífida se han visto primero en el diagnóstico antenatal precoz, gracias al desarrollo de la ecografía obstétrica de alta resolución y de la resonancia magnética fetal. Estas técnicas han permitido hacer diagnóstico de malformaciones del tubo neural, en etapas precoces del embarazo. Por otra parte, el estudio etiológico contribuye a encontrar factores genéticos, nutricionales y ambientales como causas de la aparición de malformaciones del tubo neural. Dentro de estos, está el ya mencionado déficit de ácido fólico, que generó una política de salud pública en Chile, logrando disminución considerable de presentación de esta patología con la consiguiente disminución del número de casos de espina bífida en el país 3.
Hasta la década de los 90 en el mundo y hasta septiembre 2011 en Chile, el único tratamiento disponible del MMC consistía en el cierre del defecto al momento de nacer. La instalación de una derivativa para resolver la hidrocefalia presente en el 90% de los casos dentro de los primeros días de vida y posterior manejo de rehabilitación de apoyo por el resto de la vida 4. Sin embargo, estudios recientes y fundamentalmente la publicación de los resultados del MOMS (Management of Myelomeningocele Study) 4 en marzo 2011 indicaron que la reparación del defecto in útero antes de las 26 semanas de gestación lleva a una mejoría de la función neurológica y reduce la morbilidad secundaria a hidrocefalia y malformación de Chiari, al producirse una regresión del descenso amigdaliano con un desarrollo adecuado de la fosa posterior craneal 5.
En la evolución natural de un paciente con MMC es que se irá presentando un gran número de complicaciones a lo largo de la vida, además de su déficit sensitivo motor inicial en las extremidades inferiores. Inicialmente, el 90% de los casos requerirá de una derivativa ventrículo peritoneal y de este 90%, la mitad requerirá de una revisión durante el primer año de vida 6–8. Esta evolución tórpida, con secuelas muy invalidantes, lleva a pacientes intelectualmente normales a un alto índice de dependencia. Esto motivó a los investigadores a buscar una terapia que permita mejorar estos resultados.
Origen de la cirugía fetalEl desarrollo embriológico humano se divide en 23 etapas, cada una de ellas de 2 a 3 días. El sistema nervioso central (SNC) se desarrolla en 2 distintas etapas, la neurulación primaria y secundaria. La neurulación primaria se refiere a la formación de los tubos neurales que se desarrollan en el cerebro y la médula espinal. La neurulación secundaria se refiere a la formación del tubo neural caudal que se origina en los segmentos sacros y coccígeos. La placa neural se forma en el estadio 8, la invaginación de ésta y su fusión en las etapas 9 y 10. El primer cierre de la invaginación neural ocurre a nivel del bulbo raquídeo en estadio 10, de allí se extiende en dirección caudal y rostral, formando los neuróporos rostral y caudal. El neuróporo rostral se cierra en estadio 11 (día 22), el neuróporo caudal se cierra en estadio 12 (día 26). El MMC se desarrolla por una falla en el cierre de los neuróporos. Considerando que el neuróporo caudal se cierra alrededor del día 26, cualquier evento teratogénico posterior no es capaz de producir un MMC torácico o lumbosacro 9.
Hay numerosas publicaciones que dan cuenta del deterioro neurológico de fetos con MMC evaluados in útero y que al momento de nacer, presentan mayor daño funcional que en la etapa fetal 10–13. Por otra parte, variantes menos severas de disrrafias como el lipomeningocele, habitualmente se acompañan de menor compromiso neurológico ya que el tejido neural se encuentra cubierto. Estos hallazgos llevaron a formular la hipótesis de daño primario y secundario en el MMC 14.
Por lo tanto, la etapa siguiente fue el trabajo en modelos animales que llevaron a comprobar que la cobertura intrauterina del tejido neural ayudaba a disminuir la secuela neurológica. Múltiples modelos animales de MMC en monos, ovejas, cerdos y ratas se desarrollaron a partir de la década de los 80 15–21, se crearon defectos con exposición de la placa neural de manera quirúrgica y también farmacológica, corrigiendo estos MMC inducidos con cirugía fetal. La conclusión fue que el cierre intrauterino de estos defectos, mejoraba el pronóstico funcional de los modelos experimentales. Además, se observó incidentalmente que se producía una retroceso del descenso amigdaliano 22–24. Teniendo la hipótesis confirmada con modelos animales, el paso siguiente fue pasar al trabajo en humanos.
Experiencia clínicaPrevio a 1997 25, solo se consideraban candidatos a cirugía intrauterina los fetos portadores de una patología con riesgo vital o de muy mal pronóstico, sin embargo la morbilidad importante, la mortalidad significativa y los promisorios resultados de la cirugía experimental en animales llevaron a considerar la cirugía fetal, una alternativa para el MMC. A esto se sumó, que cada vez la ultrasonografía y la resonancia magnética fetal permitieron hacer diagnósticos más precoces y precisos, por lo tanto se generaba una expectación considerable en las mujeres embarazadas que recibían el diagnóstico de una disrrafia abierta. En un principio, debido al alto riesgo de la cirugía fetal, solo se aconsejó en caso de fetos con grandes defectos tóracolumbares, asociados a ventrículomegalia, malformación de Chiari, con movimiento conservado de las extremidades inferiores, cariograma normal y ausencia de otras malformaciones importantes. Los primeros resultados fueron esperanzadores en el sentido de revertir la herniación del tronco cerebral y llevando a incluir defectos más bajos y de menor tamaño 26–30. Estos hallazgos entusiasmaron a diferentes grupos que fueron acumulando experiencia con resultados cada vez más positivos, disminuyendo el porcentaje de parto prematuro y mortalidad fetal.
Desde 1997 al 2003, más de 200 fetos fueron intervenidos, realizándose una reparación del defecto mediante histerotomía y reparación del defecto. Los datos preliminares mostraron avances notables en lograr revertir la malformación de Chiari con la consiguiente mejoría en el grado de hidrocefalia y disfunciones de tronco. Sin embargo esto también estuvo acompañado de riesgo materno que incluía básicamente alto riesgo de parto prematuro, dehiscencia de la histerotomía, además de los riesgos de prematurez extrema, muerte fetal o neonatal. Estos hechos llevaron a que se desarrollara un estudio multicéntrico, prospectivo donde se compararon los resultados en términos de eficacia y seguridad de la reparación intrauterina versus la reparación estándar postnatal del MMC 5.
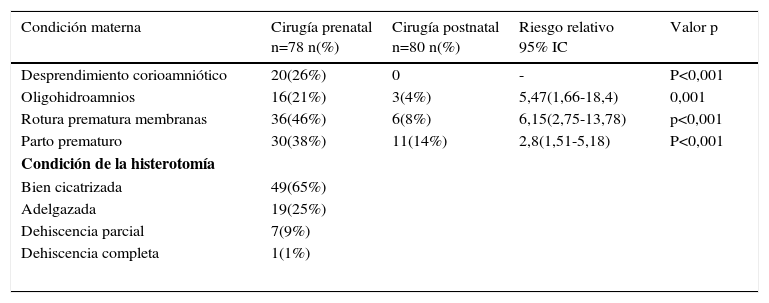
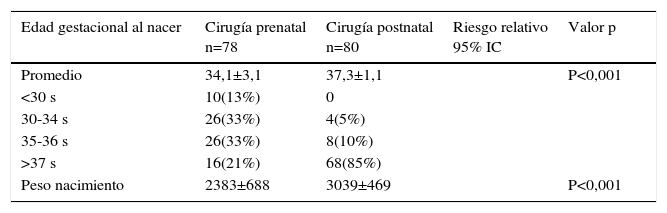
El resultado de este estudio ampliamente esperado por la comunidad científica fue publicado en marzo 2011 en The New England Journal of Medecine con conclusiones favorables a la cirugía fetal. De hecho el estudio fue detenido por la eficacia demostrada por la cirugía prenatal, después del reclutamiento de 183 pacientes de las 200 planificadas inicialmente. Los resultados están basados en 158 pacientes cuyos niños fueron evaluados a los 12 meses de vida. El porcentaje de niños en el que fue necesario instalar una derivativa ventrículo peritoneal (DVP) fue de un 40% en el grupo prenatal vs un 80% en el grupo control lo cual fue estadísticamente significativo. Además hubo una mejoría en el score de rendimiento intelectual y función motora a los 30 meses, pero con un incremento en el riesgo de parto prematuro y de dehiscencia uterina (ver tablas 1-4).
Outcome materno
| Condición materna | Cirugía prenatal n=78 n(%) | Cirugía postnatal n=80 n(%) | Riesgo relativo 95% IC | Valor p |
|---|---|---|---|---|
| Desprendimiento corioamniótico | 20(26%) | 0 | - | P<0,001 |
| Oligohidroamnios | 16(21%) | 3(4%) | 5,47(1,66-18,4) | 0,001 |
| Rotura prematura membranas | 36(46%) | 6(8%) | 6,15(2,75-13,78) | p<0,001 |
| Parto prematuro | 30(38%) | 11(14%) | 2,8(1,51-5,18) | P<0,001 |
| Condición de la histerotomía | ||||
| Bien cicatrizada | 49(65%) | |||
| Adelgazada | 19(25%) | |||
| Dehiscencia parcial | 7(9%) | |||
| Dehiscencia completa | 1(1%) | |||
Extracto y traducido de Adzick NS, Thom EA, Spong CY, Brock JW III, Burrows PK, Johnson MP, Howell LJ, Farrell JA, Dabrowiak ME, Sutton LN, Gupta N, Tulipan NB, D’Alton ME, Farmer DL (2011). A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med 364:993–1004.
Outcome recién nacido
| Edad gestacional al nacer | Cirugía prenatal n=78 | Cirugía postnatal n=80 | Riesgo relativo 95% IC | Valor p |
|---|---|---|---|---|
| Promedio | 34,1±3,1 | 37,3±1,1 | P<0,001 | |
| <30 s | 10(13%) | 0 | ||
| 30-34 s | 26(33%) | 4(5%) | ||
| 35-36 s | 26(33%) | 8(10%) | ||
| >37 s | 16(21%) | 68(85%) | ||
| Peso nacimiento | 2383±688 | 3039±469 | P<0,001 |
Extracto y traducido de Adzick NS, Thom EA, Spong CY, Brock JW III, Burrows PK, Johnson MP, Howell LJ, Farrell JA, Dabrowiak ME, Sutton LN, Gupta N, Tulipan NB, D’Alton ME, Farmer DL (2011). A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med 364:993–1004.
Outcome a los 12 meses de vida
| Cirugía prenatal n=78 n(%) | Cirugía postnatal n=80 n(%) | Riesgo relativo 95% IC | Valor p | |
|---|---|---|---|---|
| Instalación de derivativa | 31(40%) | 66(82%) | 0,48(0,36-0,64) | P<0,001 |
| Presencia de Chiari n/total/% | 45(64%) | 66/69(95%) | 0,67 | P<0,001 |
| 0 | 25(36%) | 3/69(4%) | ||
| Leve | 28(40%) | 20/69(29%) | ||
| moderado | 13(19%) | 31/69(45%) | ||
| Severo | 4(6%) | 15/69(22%) |
Extracto y traducido de Adzick NS, Thom EA, Spong CY, Brock JW III, Burrows PK,J ohnson MP, Howell LJ, Farrell JA, Dabrowiak ME, Sutton LN, Gupta N, Tulipan NB, D’Alton ME, Farmer DL (2011). A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med 364:993–1004.
Outcome a los 30 meses de vida
| Cirugía prenatal n=78 | Cirugía postnatal n=80 | Riesgo relativo 95% IC | Valor p | |
|---|---|---|---|---|
| Marcha independiente n/total (%) | 26/62(42%) | 14/67(21%) | 2,01(1,16-3,48) | 0,01 |
| No camina | 18/62(29%) | 29/67(43%) | ||
| Camina con órtesis | 18/62(29%) | 24/67(36%) |
Extracto y traducido de Adzick NS, Thom EA, Spong CY, Brock JW III, Burrows PK, Johnson MP, Howell LJ, Farrell JA, Dabrowiak ME, Sutton LN, Gupta N, Tulipan NB, D’Alton ME, Farmer DL (2011). A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med 364:993–1004.
En suma, las conclusiones del estudio MOMS son, que la cirugía fetal del MMC realizada antes de las 26 semanas disminuye la mortalidad y la necesidad de dvp (derivación ventrículo- peritoneal) a los 12 meses de vida, también mejora la función mental y motora ajustada según nivel de lesión a los 30 meses de vida. Además produce mejoría en otros aspectos como el grado de herniación de tronco cerebral, función motora ajustada a nivel anatómico y la capacidad de marcha independiente en comparación con la cirugía post natal estándar 5.
Basándonos en estos datos, nuestro grupo, compuesto por los especialistas en medicina materno fetal, inicia la experiencia de cirugía fetal en Chile en septiembre 2011. El primer caso fue operado en nuestro país en conjunto con un equipo obstétrico neuroquirúrgico de Medellín, Colombia, que ya tenía una experiencia acumulada de 17 pacientes operadas con resultados satisfactorios. Era una paciente de 28 años, G1P0A0, con un embarazo de 24 semanas con diagnóstico de una disrrafia abierta, con ventriculomegalia, malformación de Chiari, cariograma normal y sin otras malformaciones aparentes.
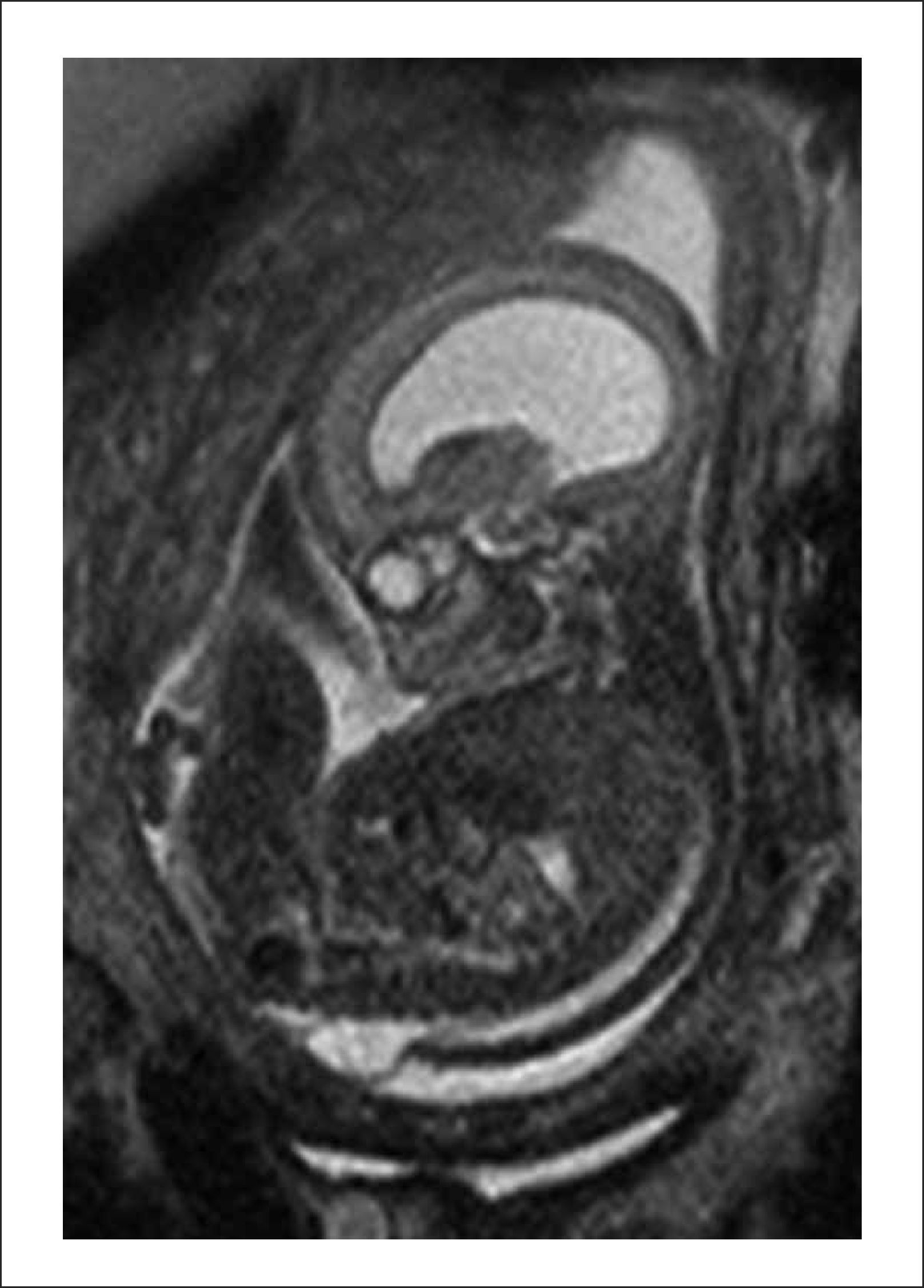
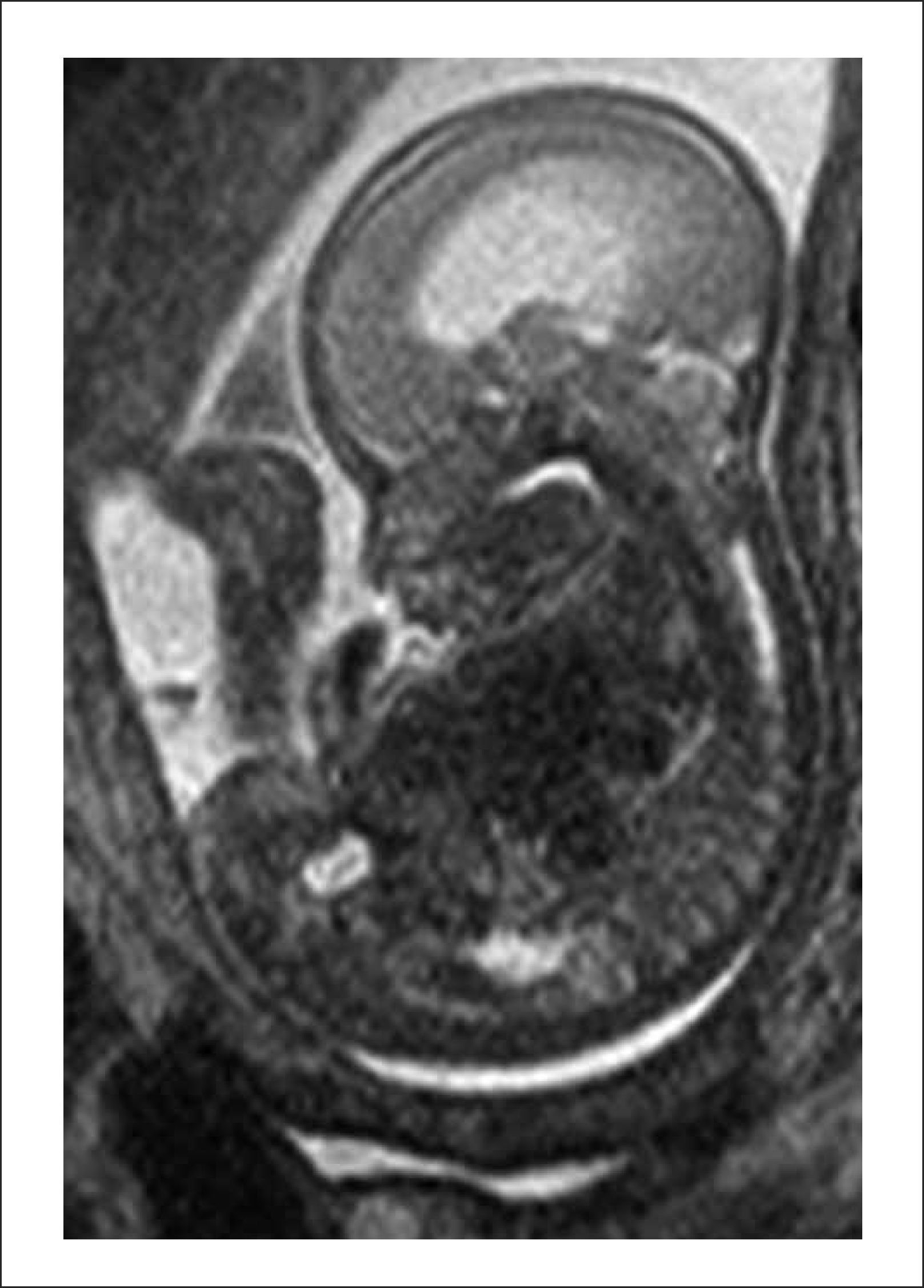
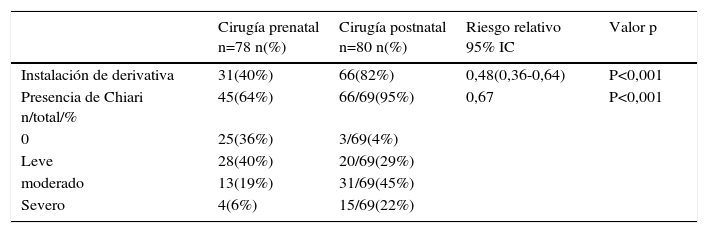
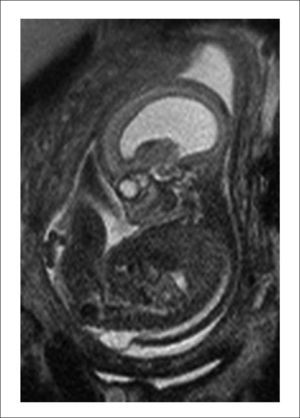
Este caso pionero operado por nuestro equipo, nació por cesárea a las 30 semanas por una sospecha de dehiscencia de la histerotomia que finalmente fue descartada, evolucionando favorablemente. Figuras 1 y 2.
Esta experiencia clínica inicial motivó fuertemente al equipo a seguir adelante y desde septiembre 2011 a marzo 2015 se han realizado 26 intervenciones intrauterinas, 20 pacientes en Clínica Las Condes y 6 en el Hospital Regional de Rancagua, transformando a nuestro centro en el de mayor experiencia a nivel nacional en este tipo de intervenciones.
Para la puesta en marcha de este ambicioso proyecto fue necesario implementar un modelo de trabajo que permitiera el desarrollo de la técnica dentro de un marco ético aprobado por nuestra institución. Esto se concretó con un protocolo de trabajo que fue aceptado por la institucionalidad de Clínica Las Condes y el cual es dado a conocer a todos los potenciales pacientes a intervenir con el diagnóstico de disrrafia abierta.
Este protocolo está basado en el utilizado en el estudio MOMS y se desarrolla de la siguiente manera:
PROTOCOLO CIRUGÍA INTRAUTERINA DE MIEOLOMENINGOCELE1. Criterios de inclusión
- •
Mujer embarazada mayor de 18 años.
- •
Feto único diagnosticado como portador de espina bífida abierta.
- •
Mielomeningocele comprendido entre T1 y S1, con descenso de tronco encefálico.
- •
Edad gestacional al momento de la intervención entre las 19+0/7 y 25+6/7 semanas.
- •
Cariotipo normal o en su defecto ausencia de malformaciones asociadas no relacionadas con la espina bífida (como hidrocefalia y anomalía postural de las extremidades inferiores, que son consecuencia del defecto neural).
2. Criterios de exclusión
- •
Cuello corto, incompetente o cerclaje cervical
- •
Placenta previa
- •
Índice de masa corporal mayor o igual a 35
- •
Parto previo espontáneo menor de 37 semanas
- •
VIH, Hepatitis B o Hepatitis C sero-positivo
- •
Anomalía uterina
- •
Condición médica materna que contraindique la cirugía o anestesia general
- •
Presencia de otra anomalía fetal o cariograma alterado No se considera criterio de exclusión la presencia de cicatriz uterina por cesárea(s) previa(s)
Las pacientes que cumplan los criterios de inclusión serán evaluadas en forma independiente por los equipos de Medicina Materno-Fetal y Neurocirugía de CLC.
Los padres tendrán asesoramiento en forma dirigida y acceso a aclarar dudas directamente por los profesionales que participarán en la intervención. La decisión de intervenir un feto con espina bífida en aquellos casos en que se ha realizado el diagnóstico prenatal es una opción que se analizará con tiempo, se discutirá en conjunto con los padres y un equipo multidisciplinario y se tomará la decisión más adecuada para cada caso. La decisión debe considerarse tomando en cuenta la evolución natural de la enfermedad, los riesgos de la cirugía, las complicaciones y el pronóstico a largo plazo. Todas las pacientes que cumplan con los criterios de inclusión podrán participar en este protocolo. Una vez aclarado estos puntos, son los padres quienes deben expresar su consentimiento para la cirugía. El momento de la cirugía fetal será entre las 19 y las 26 semanas de embarazo.
3. Estudios preoperatorios obligatorios
A. Examen ecográfico: Detallado, el que incluirá un mapeo prolijo de la posición fetal y placenta, estudio anatómico fetal completo, determinar la vía de abordaje quirúrgico y medición del cuello uterino vía transvaginal.
B. Resonancia Magnética fetal: La que ayudará evaluar el estudio de la anatomía fetal y a precisar el grado de descenso de la fosa posterior, segmentos vertebrales afectados y contenido preciso del saco herniario.
C. Exámenes generales pre-quirúrgicos
La intervención la realizará el equipo quirúrgico de Medicina Materno-Fetal y Neurocirugía bajo anestesia general, en planos anestésicos profundos para asegurar relajación uterina máxima y anestesia materno-fetal, en posición decúbito prono.
4. Cirugía
Primera etapa quirúrgica
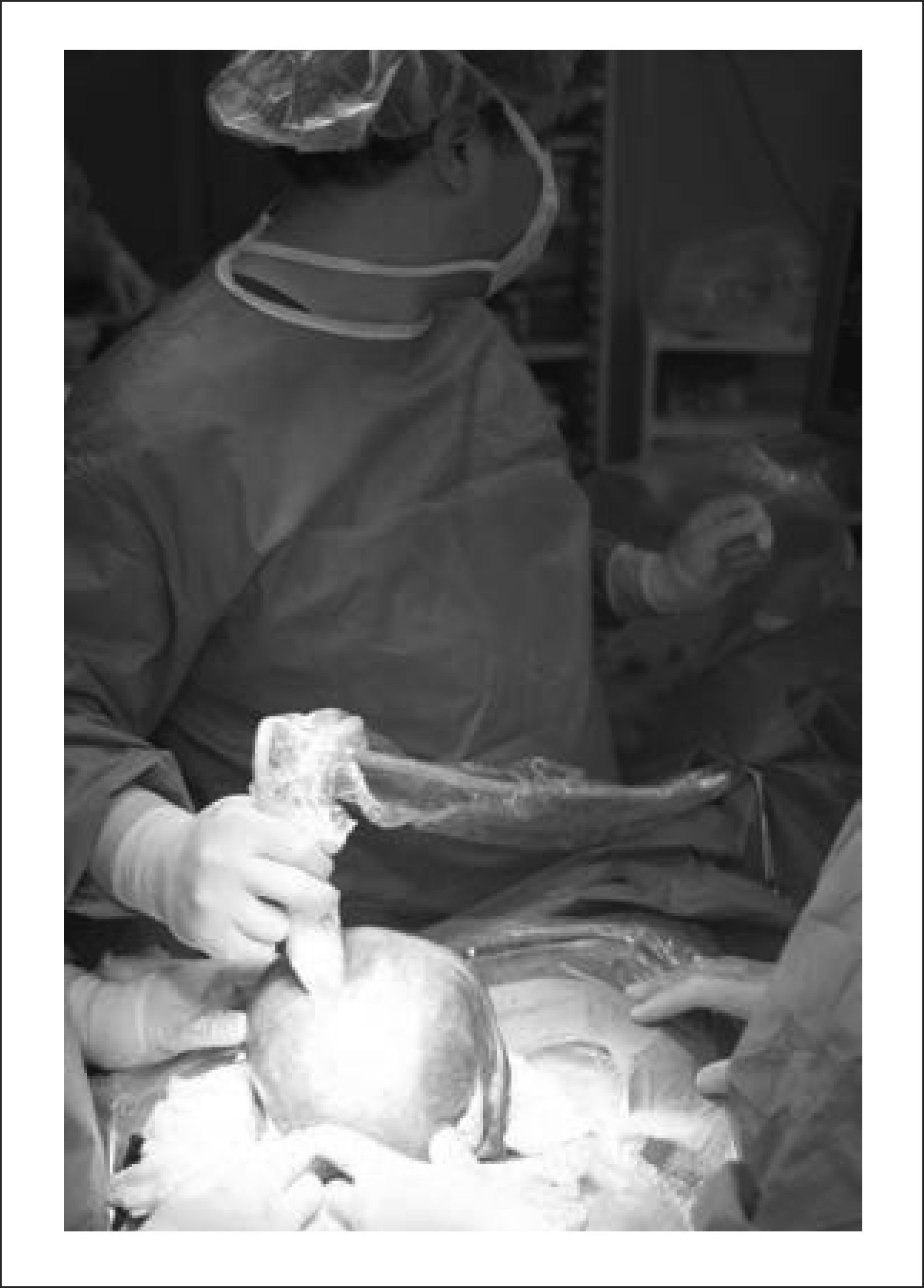
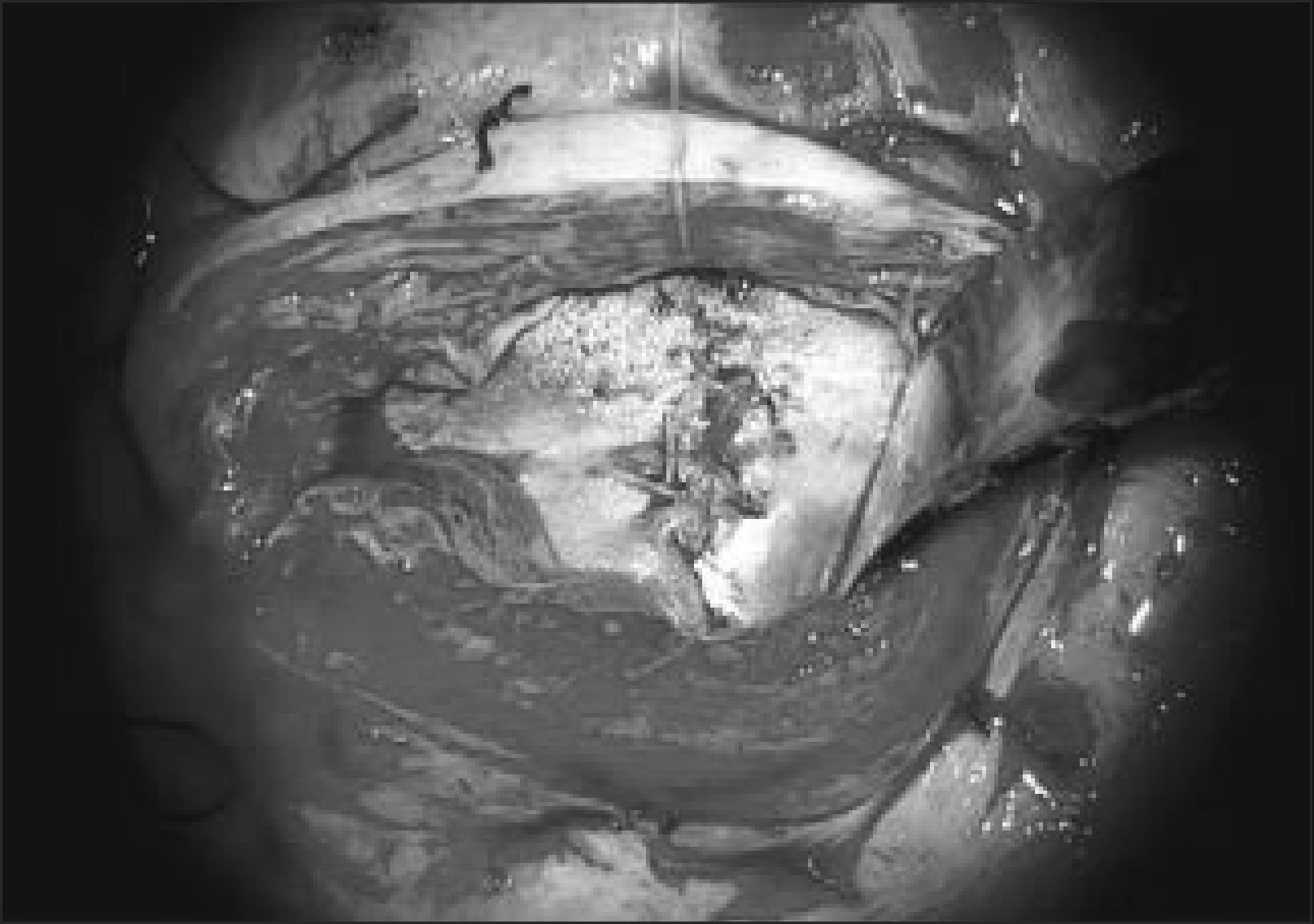
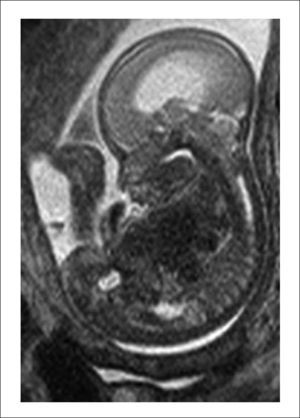
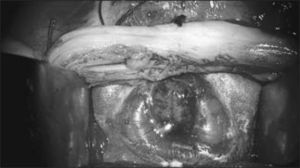
El equipo materno-fetal estará encargado de la exteriorización del útero, realizar la histerotomía, apertura y fijación de las membranas amnio-coriales, extracción y almacenamiento del líquido amniótico y exposición del defecto a través de la histerotomía. La histerotomía se hará en la pared contraria a la placenta, en la zona cercana al fondo uterino, en sentido longitudinal, siguiendo la técnica de una cesárea clásica con hemostasia del miometrio en forma prolija. Figura 3.
Segunda etapa quirúrgica
La neurorrafia será realizada por el equipo neuro-quirúrgico con técnica micro-quirúrgica utilizando microscopio de amplificación.
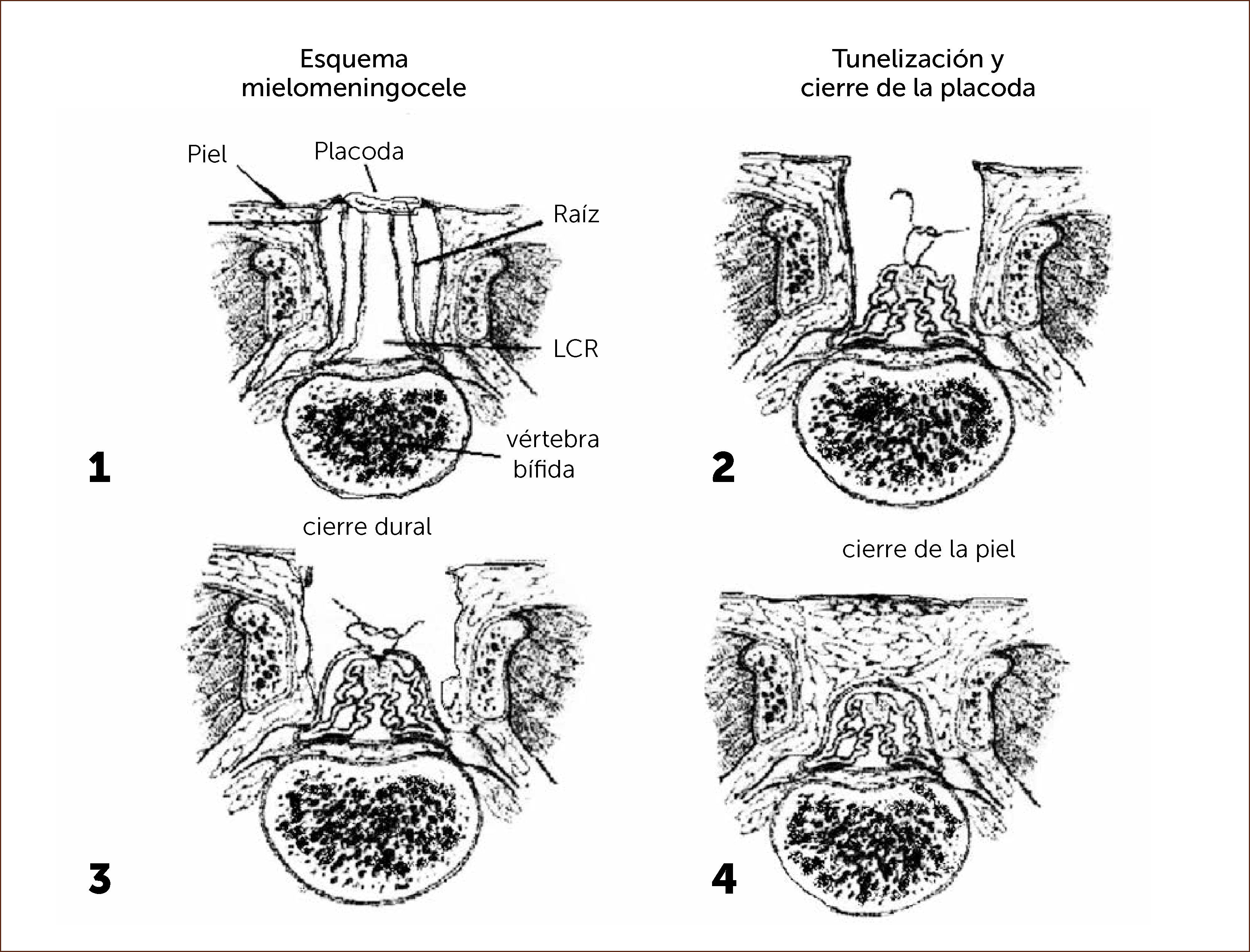
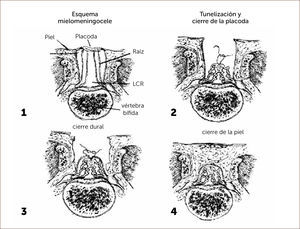
El objetivo principal de la cirugía de espina bífida es lograr el cierre del defecto, reconstituyendo la anatomía normal con el menor daño posible del tejido nervioso viable. Esta cirugía tiene diferentes aspectos a considerar según la anatomía y las características individuales de la lesión.
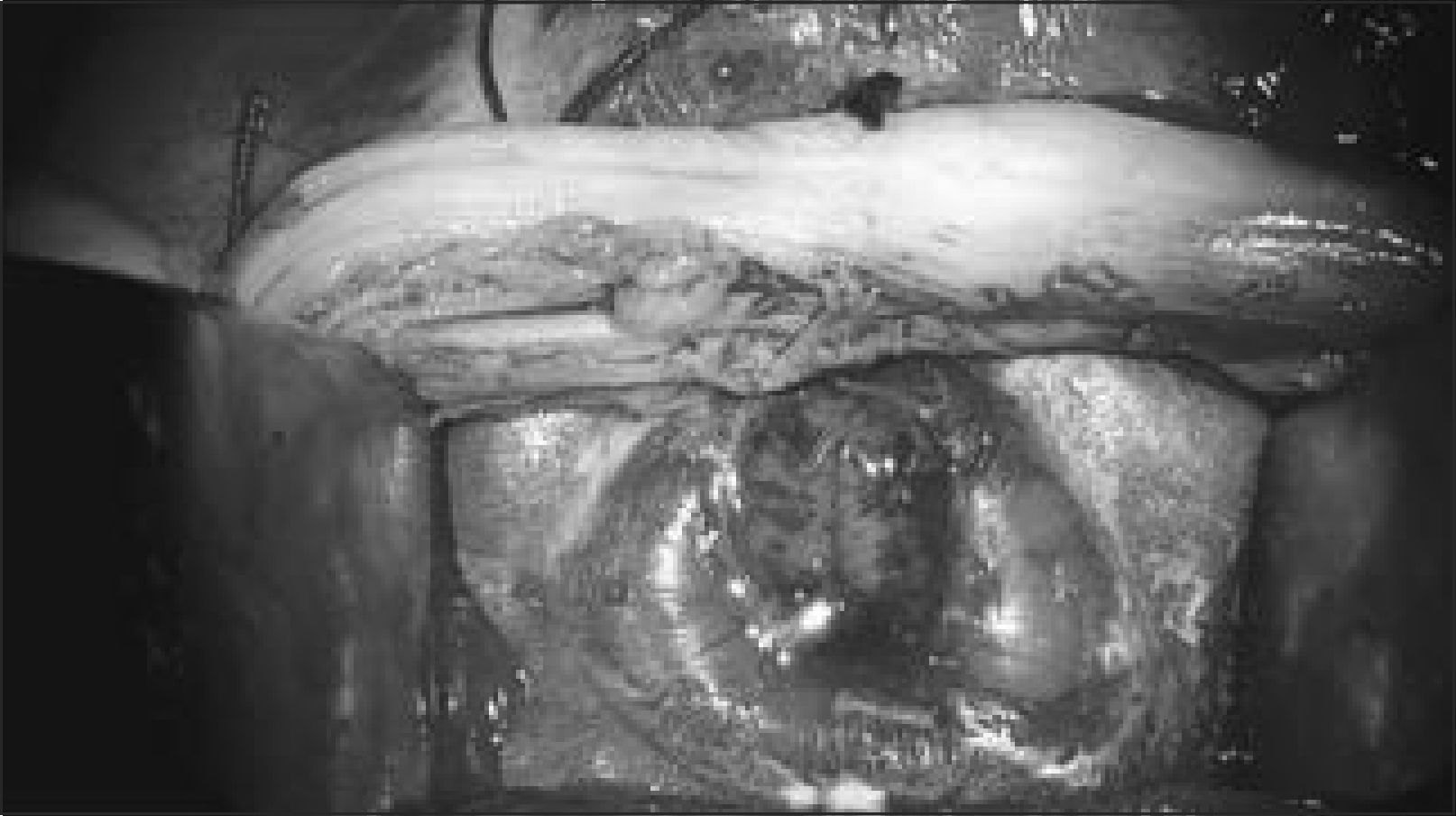
El primer paso quirúrgico es la disección de la placoda, la que debe realizarse en forma circunferencial preservando todo el tejido neural. Las meninges y el epitelio transicional deben ser separados de la placoda. Hay que individualizar las raíces nerviosas, la placoda con sus extremos distal y proximal y cualquier otra estructura anómala que pudiera ser corregida en forma precoz. Figura 4.
DIAGRAMA. Esquema pasos quirúrgicos en la cirugía de espina bífida
“MIELOMENINGOCELE”. Aut. F. Otayza, Cirugía Pediátrica 2001, Publicaciones Técnicas Mediterráneo Ltda., 460-469.
El segundo paso es la disección de la duramadre de la zona transicional, la que se realiza en forma circunferencial liberándola de toda adherencia a la piel, luego debe suturarse con material reabsorbible 7/0. (Diagrama).
El tercer paso y más importante es el cierre de la aponeurosis con vicryl 5/0.
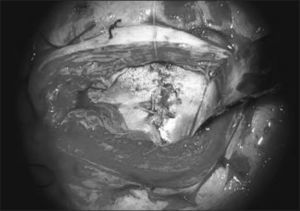
Cuarto paso, el cierre de la piel se inicia liberando la piel y el tejido subcutáneo de la fascia para-espinal, luego se moviliza el flap cutáneo hacia medial resecando la piel en exceso. Figura 5.
En ciertos casos la reparación del defecto cutáneo no se puede realizar en forma directa debido a su gran tamaño. En estos se recomienda la cobertura cutánea con material sintético, como el Duragen®.
Tercera etapa quirúrgica
El equipo materno-fetal realizará la sutura de las membranas, la histerorrafia, la reinstalación del líquido amniótico, la restitución del útero a la cavidad abdominal y el cierre de la pared abdominal materna. Figura 6.
5. Manejo post-operatorio inmediato
La paciente será manejada durante su post-operatorio en CEVIM (Centro de Vigilancia Materno-Fetal) de CLC. Será vigilada en forma constante por el equipo de residentes del CEVIM y recibirá útero-inhibidores vía endovenosa al menos por 48 horas, posterior a lo cual se continuará con medicación oral y transvaginal. También recibirá terapia anticoagulante durante las primeras 48 horas para prevenir trombo-embolismo debido a la necesidad de mantener reposo absoluto durante ese período. Se vigilará en forma específica y activa la aparición de complicaciones como parto prematuro, infección y edema pulmonar materno. Se estima que la hospitalización será por un mínimo de siete días.
6. El alta
Se permitirá en ausencia de contracciones uterinas, membranas intactas y ausencia de signos de corioamnionitis.
7. Controles posterior al alta
Los controles se realizarán de acuerdo a la situación clínica en particular, idealmente por el equipo materno-fetal que realizó la intervención o por su médico tratante de desearlo la paciente. El parto actual y los sucesivos se realizarán vía operación cesárea, en el lugar que los padres y el equipo perinatológico determinen, de acuerdo a factores financieros y geográficos.
Recién nacido:
Hospitalizado en unidad de cuidados intensivos neonatales, será evaluado por neurocirujano, fisiatra, urólogo y neurólogo infantil. Además se realizarán los siguientes exámenes: ecografía cerebral, medular y renal.
Controles del RN operado
- –
40 semanas corregidas: evaluación neuro-quirúrgica, test Amiel Thyson.
- –
1 mes: neurocirujano, eco cerebral.
- –
2 meses: neurocirujano.
- –
3 meses: ecografía cerebral, neurólogo, EEG pps, fisiatra, urólogo, ecografía renal.
- –
6 meses: TAC de cerebro, neurocirujano, fisiatra, urólogo, ecografía renal, urodinamia, uretrocistografía.
- –
9 meses: fisiatra, ecografía renal, urólogo.
- –
1 año: neurocirujano, RM de médula, Rx de columna, neurólogo, test Denver, definición nivel anatómico y funcional.
- –
2 años: neurocirujano, RM cerebro, neurólogo, evaluación weeFIM Tepsi
- –
2,5 años: fisiatra, evaluación Bayley
- –
4 años: neurocirujano, neurólogo, Bayley
- –
5 años: Bayley
En caso necesario se solicitarán evaluaciones extraordinarias o interconsultas a otros especialistas.
8. Evaluación del protocolo
Los resultados de este protocolo serán evaluados siguiendo el esquema propuesto por el grupo MOMS, es decir al parto y recién nacido, a los 12 y a los 30 meses de vida del feto operado, de manera de poder comparar nuestros resultados con los de la serie original.
Nuestra experienciaEl desarrollo de esta innovadora cirugía -al igual que en el resto del mundo- nos ha permitido conformar un valioso equipo de trabajo multidisciplinario sin el cual esta iniciativa no habría sido posible. No cabe duda que el camino no ha estado exento de complicaciones, siendo sin duda la más relevante el alto porcentaje de parto prematuro con la consiguiente morbimortalidad. En 26 casos operados hubo un 31% de partos prematuros menores de 28 semanas y mortalidad en 5 casos, 1 intraoperatorio, 1 a las 24 horas de cirugía in útero y 3 por prematurez extrema. Por otra parte los resultados han sido muy auspiciosos en la resolución de la hidrocefalia. De los 21 casos nacidos en control, solo uno requirió de una derivativa ventrículo peritoneal y a dos se les realizó una tercer ventrículo cisternostomia endoscópica. La resolución de la malformación de Chiari ha sido significativa con cifras comparables a las del MOMS. Los resultados a los 30 meses de vida están en evaluación ya que la mayoría de nuestra serie aún no cumple esa edad.
CONCLUSIONESEn resumen, la cirugía fetal se ha desarrollado con seguridad y con riesgos maternos y fetales aceptables; sin embargo, estos riesgos deben balancearse con los beneficios para un niño al cual le seguirán largos años de seguimiento. Sin duda, es en el largo plazo donde finalmente se podrán objetivar las ventajas de la cirugía fetal versus la cirugía post natal inmediata. Los efectos que tendrá la cirugía fetal en el síndrome de médula anclada son aún inciertos y solo el seguimiento a largo plazo permitirá sacar conclusiones definitivas.
El desarrollo de la cirugía fetal del MMC ha significado un gran paso en la medicina materno fetal al ofrecer una terapia intrauterina para una patología no letal. Esto es mirado con gran interés por otros grupos quirúrgicos que ven en esta técnica posibles alternativas para patologías del feto que podrían ser abordadas en etapa prenatal como la uropatía obstructiva bilateral extrema, el teratoma sacrococcígeo gigante, la malformación adenomatoidea quística congénita pulmonar y la hernia diafragmática congénita.
Finalmente, hay que recalcar la existencia de varias líneas de desarrollo en cirugía fetal en el mundo y sin duda que el gran desafío es cómo lograr una cirugía menos invasiva y con eso disminuir los riesgos de parto prematuro. El grupo del Dr. Thomas Kohl de la Universidad de Giessen-Marburg, Alemania, ha presentado resultados preliminares interesantes de cirugía laparoscópica fetal 31, así como también hay trabajo experimental con uso de células madres para la creación de parches que puedan ser colocados de manera endoscópica 32. Estas experiencias innovadoras están en fase de validación y deberán compararse con el estándar actual que es la cirugía abierta.
El autor declara no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas por el paciente o sus padres para su publicación.