Las nuevas tecnologías de imagen con endoscopios de alta resolución y el uso de la cromoscopia asociado al entrenamiento de los endoscopistas han permitido detectar lesiones neoplásicas de esófago en estadios iniciales. Estos avances resultaron en la expansión de las indicaciones del tratamiento endoscópico curativo en pacientes con carcinoma de células escamosas de esófago. En los últimos años se han desarrollado técnicas para la resección endoluminal en bloque de los tumores gastrointestinales precoces, procedimiento denominado disección endoscópica de la submucosa (DES). Inicialmente la DES fue utilizada para tratamiento de tumores gástricos, y posteriormente esta técnica pasó a ser aplicada para tumores de esófago y colorectales. El presente artículo de revisión presenta una descripción de la DES en el manejo de las neoplasias superficiales de esófago, a fin de contribuir para la difusión de este concepto y la incorporación de este procedimiento en Latinoamérica.
The development of high-resolution endoscopes with chromoendoscopy and the education of endoscopists have enabled the detection of early stage esophageal squamous-cell carcinoma (ESCC). Moreover, in recent years there has been an important progress in the management of early gastrointestinal neoplastic lesions after the development in Japan of endoluminal techniques for en-block tumor resection, namely endoscopic submucosal dissection (ESD). The combination of these factors facilitated the expansion of indications for endoscopic minimally invasive curative interventions in selected patients with superficial ESCC. This review article presents a comprehensive overview and detailed description of the ESD procedure for treatment of ESCC in order to facilitate the dissemination of this concept and the incorporation of this new technique in Latin-America.
El cáncer esofágico es la tercera causa de muerte por cáncer digestivo1 y presenta una tasa de supervivencia en cinco años de 15%2. El carcinoma de células escamosas (CCE) del esófago predomina en hombres (3,6:1) entre la quinta y séptima década de la vida3. Cuando se diagnostica el CCE de esófago en estadio temprano, el pronóstico es significativamente mejor, con tasas de supervivencia a los 5 años de hasta un 95%4. Esta revisión tiene por objetivo describir la nueva técnica de resección endoluminal por vía endoscópica, llamada disección endoscópica submucosa (DES), recientemente incorporada al tratamiento del CCE precoz de esófago.
CLASIFICACIÓN DE LA NEOPLASIA SUPERFICIAL DE ESÓFAGODe acuerdo con la clasificación endoscópica publicada en el Consenso de París5, neoplasia superficial comprende la lesión cuyo aspecto morfológico sugiere compromiso de las capas mucosa y submucosa, sin infiltración de la muscular propia. En Japón, las lesiones superficiales se denominan de tipo 0, en referencia a la clasificación de Borrmann de los tumores gástricos avanzados6. Existen tres subtipos de lesiones superficiales: protruida (tipo 0-I), plana (tipo 0-II) y excavada (tipo 0-III). Las lesiones que sobresalen se subclasifican en pedunculadas (0-Ip), subpediculada (0-ISP) y sésiles (0-Is). En el esófago predominan las neoplasias superficiales planas que se subdividen en superficialmente elevadas en relación a la mucosa adyacente (IIA), planas (IIB) y deprimidas (IIC), siendo raras las formas protruidas y excavadas5. Las neoplasias superficiales son además subdivididas de acuerdo al grado de penetración transmural. M1 corresponde al epitelio y la capa basal, M2 a la lámina propia o corion y M3 a la muscular de la mucosa. El compromiso de la submucosa también se subdivide en SM1 (tercio superior), SM2 (promedio) y SM3 (tercio inferior).
En cuanto a la descripción histopatológica de los tumores superficiales, la recomendación actual es utilizar la clasificación de Viena7, según la cual el cáncer se clasifica de acuerdo a la clasificación TNM-p (“p” de la patología). En ausencia de invasión de la lámina propia, la lesión se llama neoplasia intra-epitelial de grado bajo o alto, y también se puede utilizar el término carcinoma in situ (pTis). Cuando existe invasión de la lámina propia esofágica, la neoplasia es llamada carcinoma intramucosal o micro-invasivo (pT1m). Cuando hay infiltración de la submucosa, la neoplasia se considera invasiva (pT1sm).
La importancia de estas subdivisiones se debe al hecho de que el riesgo de metástasis en ganglios linfáticos tiene estrecha relación con la profundidad de invasión tumoral vertical en la pared del órgano. Este dato es un criterio fundamental para la selección de candidatos para terapia endoscópica con fines curativos. Cuando el compromiso neoplásico se limita a la porción epitelial superficial (M1 y M2), el riesgo de compromiso linfonodal es cercano a cero y el realizar la resección por vía endoscópica es suficiente para obtener cura5,6. Cuando el cáncer invade la muscularis mucosa (M3) y la porción proximal de la submucosa a una profundidad de 200μ (SM1) conceptualmente este riesgo puede llegar del 9% al 19%, respectivamente. En estos casos, que se sitúan en el límite del tratamiento endoscópico curativo, una mayor evaluación es esencial que observe cuidadosamente los siguientes parámetros: tamaño del tumor, presencia de invasión linfática-vascular y la extensión horizontal (ancho) de la invasión de la lámina muscularis de la mucosa. En el estudio de análisis multivariada de Choi et al.8, en el que se evaluaron 190 piezas de esofagectomía, los autores observaron que en los tumores que afectaban de manera focal M3/SM1, cuando el tamaño de la lesión neoplásica es inferior a 3cm, no hay invasión linfático-vascular; y si el compromiso de la lámina muscularis mucosa tiene una anchura inferior a 3mm, el riesgo de metástasis en los ganglios linfáticos es muy bajo (1 de cada 63 casos o 1,5%). En presencia de infiltración masiva de la submucosa (SM2 y SM3) se encuentran metástasis de ganglios linfáticos en aproximadamente el 40% de los casos.
INDICACIONES PARA EL TRATAMIENTO ENDOSCÓPICO DE LA NEOPLASIA SUPERFICIAL DE ESÓFAGOLos criterios clásicamente aceptados para la resección endoscópica con fines curativos del cáncer superficial de esófago9 incluyen: profundidad del compromiso restringida a las capas M1 y M2 (epitelio y lámina propia), longitud máxima de 3cm y extensión lateral de menos de ¾ de la circunferencia, máximo de 4 lesiones. Con técnicas mejoradas para la resección endoscópica, especialmente después de la llegada de la DES, estos criterios se amplificaron, aceptándose el tratamiento endoscópico de las lesiones mayores de 3cm, aun que ocupen toda la circunferencia del esófago y sin límite en el número de lesiones, siempre que sean intramucosal. La Tabla 1 sintetiza las recomendaciones de la Sociedad Japonesa de Esófago en cuanto a las indicaciones de resección endoscópica para los CCE de esófago9.
DIRECTRICES PARA MANEJO ENDOSCÓPICO DE CÁNCER PRECOZ DE ESÓFAGO SEGUN LA SOCIEDAD JAPONESA DEL ESÓFAGO
| ABSOLUTA | Invasión de M1 y M2 < 2/3 circunferencia | DES |
| RELATIVA | Invasión de M3 o SM1 sin metástasis linfática Invasión de M1 o M2 > 2/3 circunferencia | DES + CRT |
| EN INVESTIGACIÓN | Invasión de SM2 | DES para control local + CRT |
Ref. 9.
La pared del tubo digestivo está formada por dos componentes principales: la mucosa y la muscularis propia. Estos elementos están unidos por una capa de tejido conectivo (submucosa). La pared del esófago tiene un espesor entre 3,5 y 4mm, así que para extirpar una lesión neoplásica superficial se corre el riesgo de lesión involuntaria de la capa muscular y de la consiguiente perforación visceral. Para evitar estas complicaciones, es necesaria la inyección de la submucosa para separarse la lesión a tratar de la capa muscular propia. La solución más utilizada es la solución salina al 0,9%. La desventaja de la solución salina es su rápida disipación en la pared gastrointestinal que hace que la eliminación de las lesiones mayores de 1cm no sea posible, solo con esta sustancia. Para estos casos se han desarrollado soluciones viscosas que promueven el efecto de la “burbuja” por un período más prolongado10. Las soluciones viscosas más utilizadas son el hialuronato de sodio, la glicerina y la hidroxipropilemetilcelulose10. La elevación de la lesión neoplásica después de la infiltración de la submucosa indica que no hay invasión de la profundidad por el cáncer. Tras la inyección de un volumen suficiente de solución en la submucosa, la lesión elevada puede ser captada por el asa de diatermia y posibilita la resección con adecuado margen de seguridad; este procedimiento es reconocido como mucosectomia (o EMR - Endoscopic Mucosal Resection).
Hay variaciones en las técnicas descritas de mucosectomía: inyección y lazo; inyección, cap de mucosectomía y lazo con la ayuda de la succión; mucosectomía después de la aplicación de bandas elásticas. La resección endoscópica de la mucosa con la ayuda del cap es el método recomendado para su aplicación en el CCE de esófago11–13.
DISECCIÓN ENDOSCÓPICA DE LA SUBMUCOSA (DES)La técnica de DES fue desarrollada en el Japón con el objetivo de permitir la resección en bloque de lesiones neoplásicas mayores de 2cm14–16. La DES tiene beneficios secundarios, como la producción de una muestra adecuada para el estudio histológico, y desde el punto de vista clínico, para lograr una resección local con mayor potencial de curación y menor tasa de recurrencia local17. Esta técnica se diseñó originalmente para su aplicación en el estómago. Su uso en el esófago se desarrolló más lentamente, porque en este órgano es un procedimiento de mayor complejidad y dificultad técnica, debido al reducido espacio luminal del esófago, en comparación con el estómago. El refinamiento y la estandarización de la DES, así como el desarrollo de nuevos dispositivos, ha hecho posible extender la aplicación de esta modalidad en el manejo del CCE de esófago. Además de estos factores, el aumento en la detección de los tumores en una etapa temprana por el creciente uso de la endoscopia de alta resolución y de la cromoendoscopia. A esto se suma la alta morbilidad y mortalidad asociadas con la esofagectomia, han estimulado el desarrollo y la mejora de las intervenciones terapéuticas endoluminal, las cuales permitan conservar el órgano y mantener la calidad de vida de los pacientes. En la actualidad, la DES es el método preferido para la resección endoscópica del cáncer esofágico temprano.
TÉCNICA DE DESEn Japón, los procedimientos de DES se realizan bajo sedación. Sin embargo, para los principiantes en la técnica, o cuando el tiempo de ejecución estimado es superior a dos horas, se recomienda la asistencia de un anestesiólogo y el uso de anestesia general con intubación oro-traqueal18. Aunque no hay evidencia científica para justificar el uso de antibioticoprofilaxis para la DES de esófago, esta práctica está muy extendida en los centros japoneses con el uso de cefalosporinas de segunda generación mantenido durante tres días por vía intravenosa.
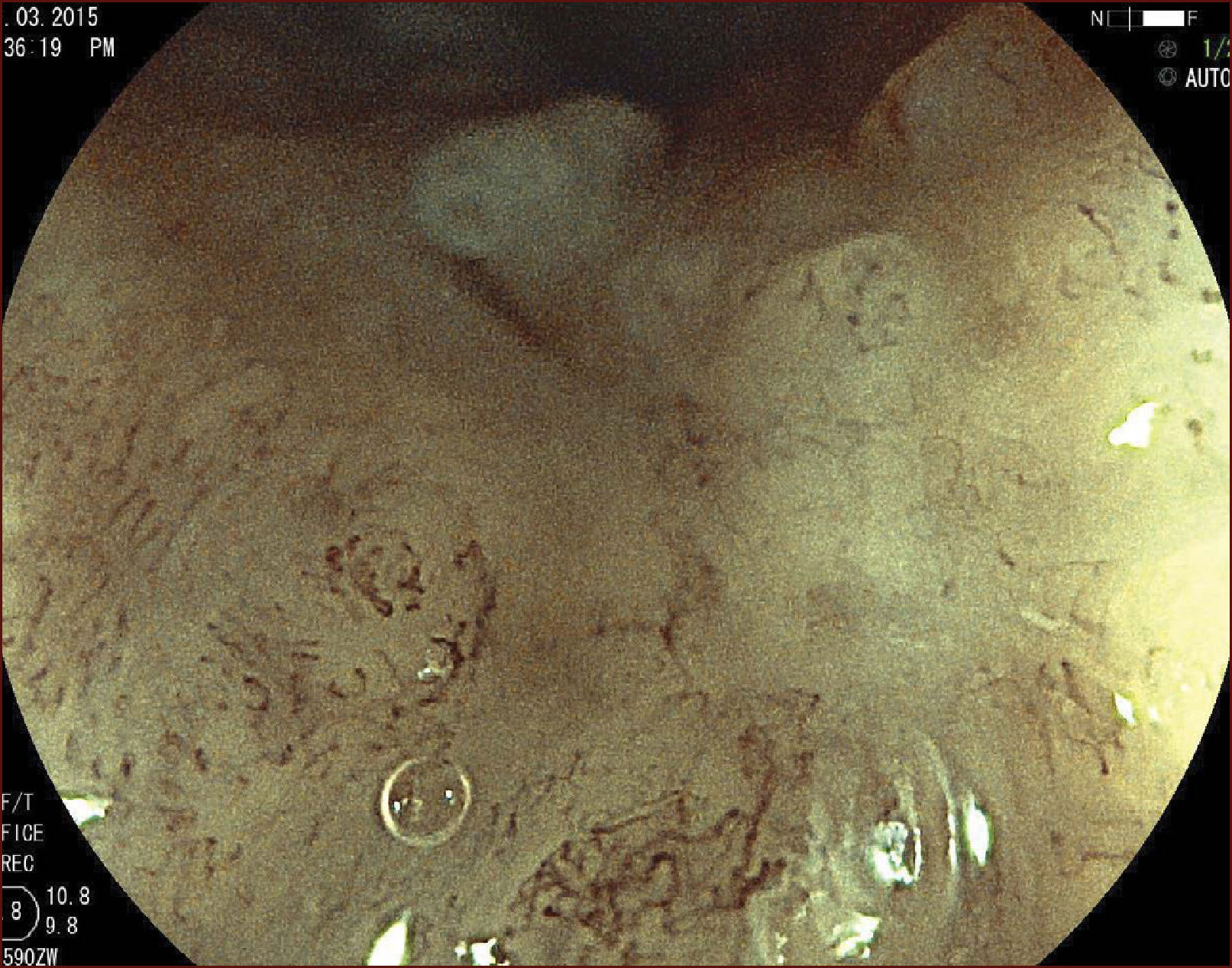
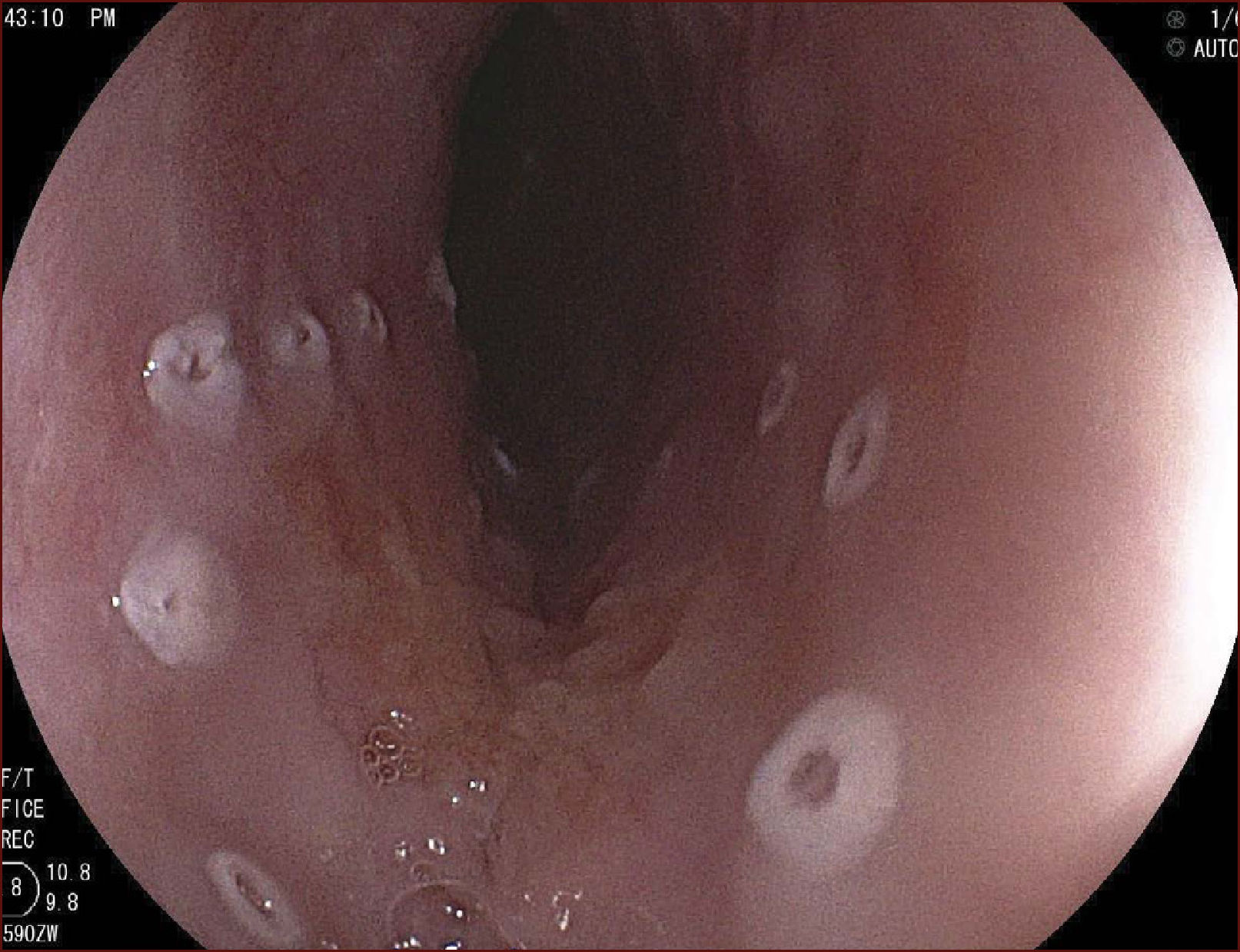
Inicialmente se debe inspeccionar a fondo la extensión de la lesión utilizando endoscopios con magnificación óptica y cromoscopia digital. En seguida se debe proceder a cromoscopia con lugol al 0,8% para el trazado preciso de los límites de la lesión. En el esófago, el autor realiza el procedimiento con estilete de aguja corta de 1,5mm de largo con punta redondeada (Flush Knife-Ball-tiped 1.5, Fujifilm Co., Japón), que permite realizar todos los pasos de la DES: marcas, incisión, disección de la submucosa, inyección simultánea de solución salina y hemostasia de los vasos sanguíneos19,20. Se recomienda emplear la unidad de electrocirugía ERBE VIO 200D o 300D (ERBE Elektromedizin, Turbingen, Alemania). Después de la cromoendoscopia, se procede a marcar los límites de resección con el Flush Knife (FK), respetando los márgenes mínimos de 2-5mm (parámetros: Soft coagulation, Efecto 5, 100 vatios). Los márgenes proximal y distal deben ser amplios en el esófago (5 mm), mientras que los márgenes laterales necesitan ser más conservadores (2 mm) para minimizar el riesgo de estenosis esofágicas secundarias a las resecciones circunferenciales. Después se procede a la inyección submucosa con agujas de calibre 25 Gauge. Inicialmente se realiza una primera burbuja submucosa con solución salina 0.9% y luego se inyecta una solución viscosa de ácido hialurónico (Muco-Up ®, Seikagaku, Japón) que mantiene elevada la submucosa por un período más largo. La inyección submucosa se debe iniciar en el margen oral de la lesión, desde un extremo al otro; antes se debe observar una elevación satisfactoria de la lesión (signo del levantamiento). Se deben evitar inyecciones que traspasen en el centro de la lesión neoplásica para minimizar el riesgo de siembras del tumor en la capa muscular propia. Luego se procede a la incisión transversal y lateral de la mucosa con el FK (Endocut I Efecto 4, duración de corte 2, intervalo de corte 3). La incisión debe ser suficientemente profunda para atingir el plan submucoso profundo junto a la muscular propia. En seguida se utiliza el cap para exponer el tejido submucoso y se realiza la disección submucosa en sentido oral-anal. Durante la disección con el FK (coagulación forzada efecto 2, 40 vatios), siempre se precede a la aplicación de corte eléctrico de más inyecciones de solución salina en la submucosa. El movimiento del FK debe ser siempre paralelo al eje de la pared esofágica y nunca perpendicular a la capa muscular propia. La disección se debe realizar en capa submucosa profunda, para que sea más eficiente, y optimice el control vascular. La hemostasia perfecta de los vasos submucosos es esencial para un procedimiento seguro y un campo exangüe, como ya se ha descrito21,22. Los vasos perforantes del esófago se deben identificar y aislar rente a la muscular propia, y se les debe realizar hemostasia con la aplicación de Soft Coagulation, efecto 5, 100 vatios por 3 a 5 segundos en cada lado del vaso, seguidos por la sección del vaso con coagulación forzada. Si la maniobra hemostática con el FK no es eficaz, después de tres intentos, se debe proceder a la hemostasia con una pinza fórceps (COAG grasper, Olympus Co. Japón).
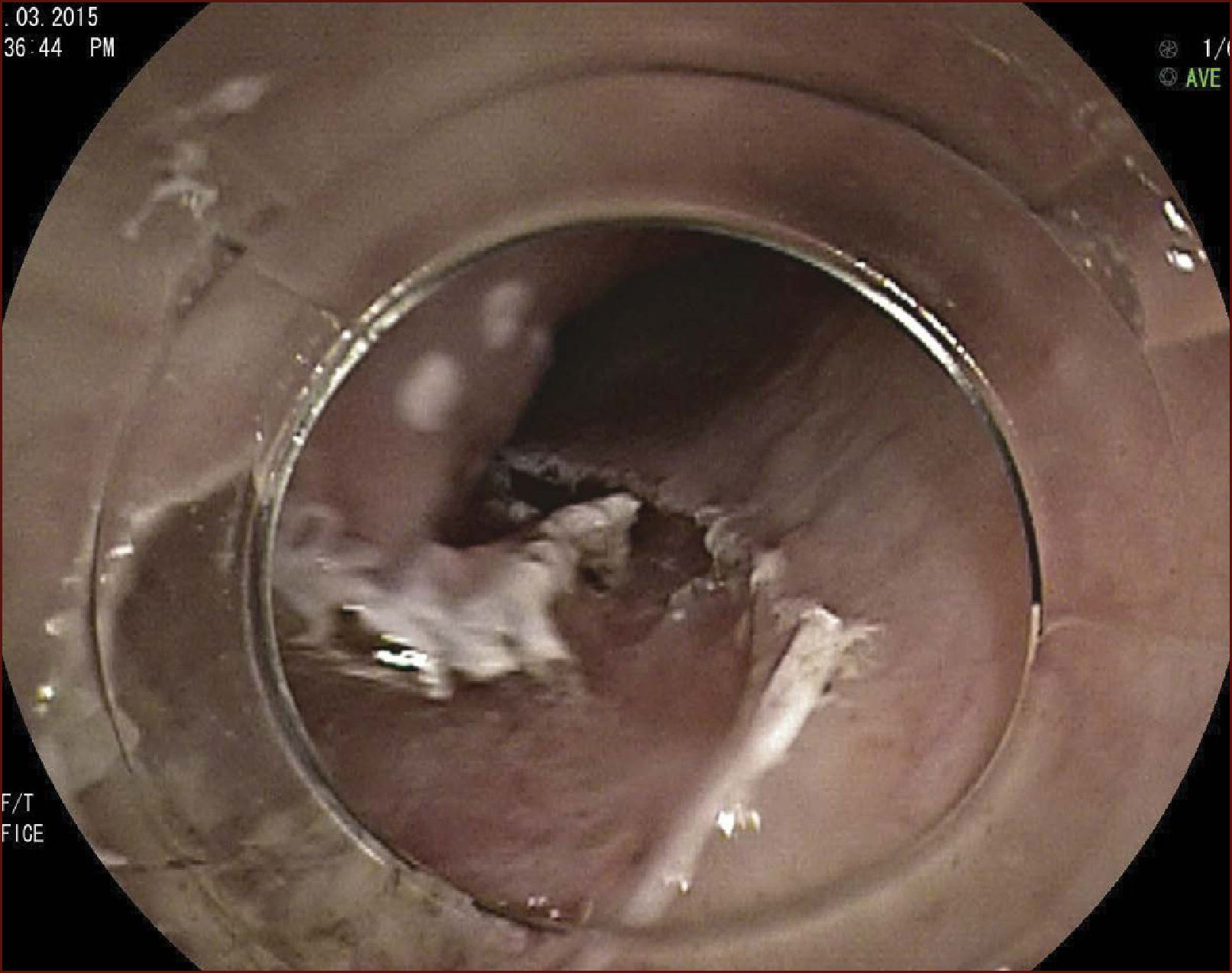
Después de la terminación de la resección, la muestra debe ser recuperada con pinzas de cuerpo extraño, teniendo cuidado de captar la muestra por su lado submucoso, a fin de no dañar la porción mucosa de la muestra. El sitio de la resección debe ser reexaminado, los vasos que sobresalen deben ser coagulados y las laceraciones de la capa muscular deben ser aproximadas con clips. Si el sitio de resección presenta una extensión superior a 75% de la circunferencia, se puede agregar la inyección de 4ml de acetato de triamcinolona de 10 mg/ml, a través de un catéter inyector, lo que representa 20 punciones con alícuotas de 0,2ml por punción, dirigidas tanto al borde como al centro del sitio de resección teniendo cuidado para inyectar solo en la porción superficial de la capa muscular. Esta medida tiene como objetivo minimizar el riesgo de estenosis esofágica. Otra opción es administrarle al paciente terapia con corticoides por vía oral por tres semanas.
RECUPERACIÓN Y PREPARACIÓN DEL ESPÉCIMEN RESECADOEste es un paso fundamental en el tratamiento endoscópico de los tumores superficiales que a menudo es pasado por alto por los endoscopistas occidentales y que es llevado a cabo de forma sistemática por los japoneses. La muestra recuperada se fija con alfileres en icopor o goma y se coloca en formol. El patólogo debe cortar la muestra en fragmentos paralelos de 2mm de ancho, y la debe evaluar de acuerdo a la clasificación Viena7, que indica el grado de diferenciación tumoral, la profundidad de la invasión y si la resección fue completa o no. En todo caso, deben ser evaluados cuidadosamente todos los márgenes proximal, distal, lateral y vertical. Cuando hay invasión de la submucosa, se adopta una medida cuantitativa midiendo en micras (μ) la profundidad de esta invasión, a partir de la última capa de la muscularis mucosa. El punto de corte a partir del cual se considera existe un mayor riesgo de metástasis en los ganglios linfáticos (SM2) en el que esófago se sitúa por debajo de 200μ5.
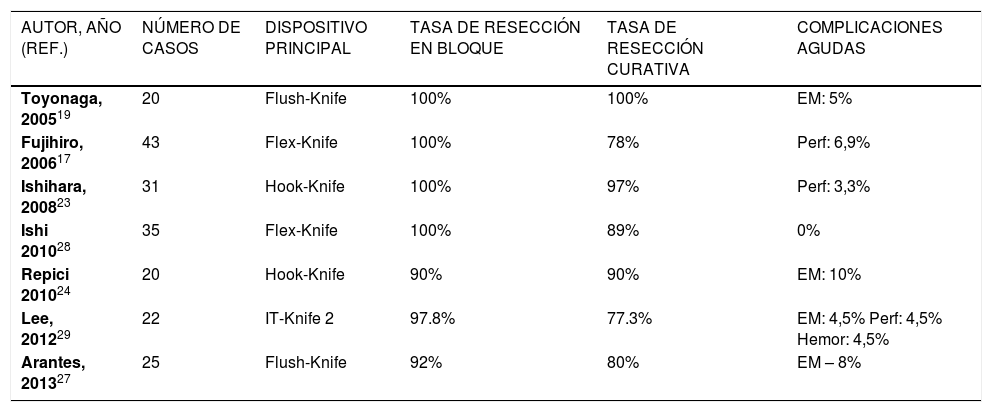
RESULTADOS DE DES EN CÁNCER TEMPRANO DE ESÓFAGOExisten algunos estudios publicados en la literatura sobre el uso de DES en los tumores del esófago y el resumen de los resultados de las principales publicaciones se describen en la Tabla 2. Toyonaga et al.19 reportaron 20 pacientes con CCE del esófago, que se sometieron a la DES con el FK, con la obtención de la resección en bloque y con márgenes libres en el 100% de los casos, con un diámetro medio de la muestra de 47mm y con un tiempo promedio de 65 minutos. En esta serie sólo hubo una complicación, enfisema mediastinal, que se manejó clínicamente. Fujishiro et al.18 mostraron resultados similares en 43 pacientes, obteniéndose 100% de la resección en bloque, pero en el 22% de los casos la resección endoscópica no fue curativa, debido a compromiso de los márgenes verticales o laterales. Hubo cuatro casos de perforación tratados de forma conservadora. Ishihara et el.23 publicó un análisis comparativo de los resultados de la DES en comparación con la mucosectomia en pacientes con cáncer esofágico inferior a 20mm. Las tasas de resección en bloque y la resección curativa de los casos de DES fueron superiores a los de las técnicas de resección mucosa endoscópica con cap y con strip biopsy (respectivamente 100% y 97%, 87% y 71%, 71% y 46%). No hubo diferencias en las tasas de complicación entre las tres técnicas, señalando que cuando el endoscopista tiene la suficiente formación, la tasa de complicación de la DES es similar a la mucosectomia.
RESULTADOS DE LA DES EN NEOPLASIA SUPERFICIAL DE ESÓFAGO
| AUTOR, AÑO (REF.) | NÚMERO DE CASOS | DISPOSITIVO PRINCIPAL | TASA DE RESECCIÓN EN BLOQUE | TASA DE RESECCIÓN CURATIVA | COMPLICACIONES AGUDAS |
|---|---|---|---|---|---|
| Toyonaga, 200519 | 20 | Flush-Knife | 100% | 100% | EM: 5% |
| Fujihiro, 200617 | 43 | Flex-Knife | 100% | 78% | Perf: 6,9% |
| Ishihara, 200823 | 31 | Hook-Knife | 100% | 97% | Perf: 3,3% |
| Ishi 201028 | 35 | Flex-Knife | 100% | 89% | 0% |
| Repici 201024 | 20 | Hook-Knife | 90% | 90% | EM: 10% |
| Lee, 201229 | 22 | IT-Knife 2 | 97.8% | 77.3% | EM: 4,5% Perf: 4,5% Hemor: 4,5% |
| Arantes, 201327 | 25 | Flush-Knife | 92% | 80% | EM – 8% |
Ref: referencia, EM: enfisema mediastinal, Perf: perforación, Hemor: hemorragia.
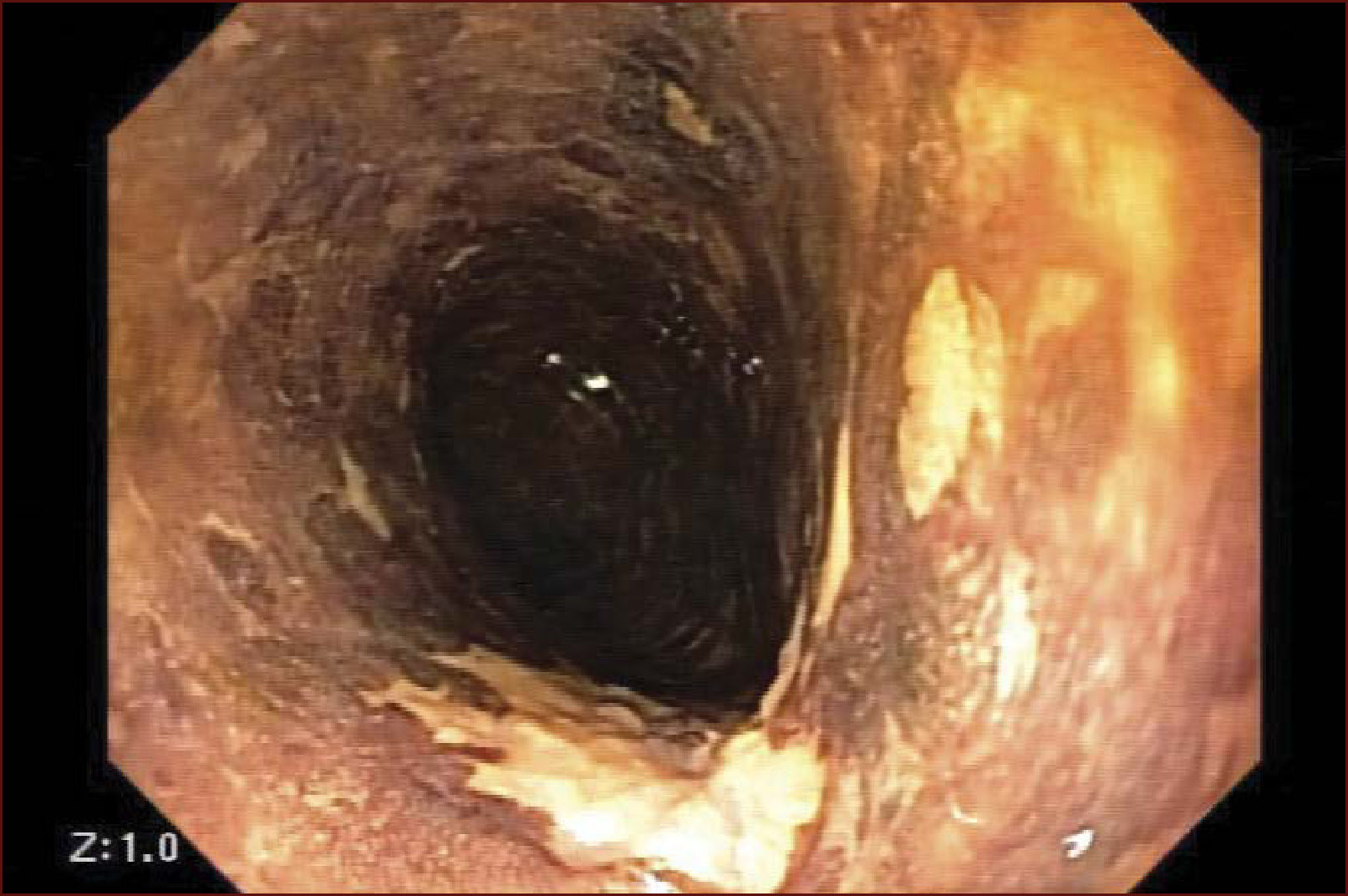
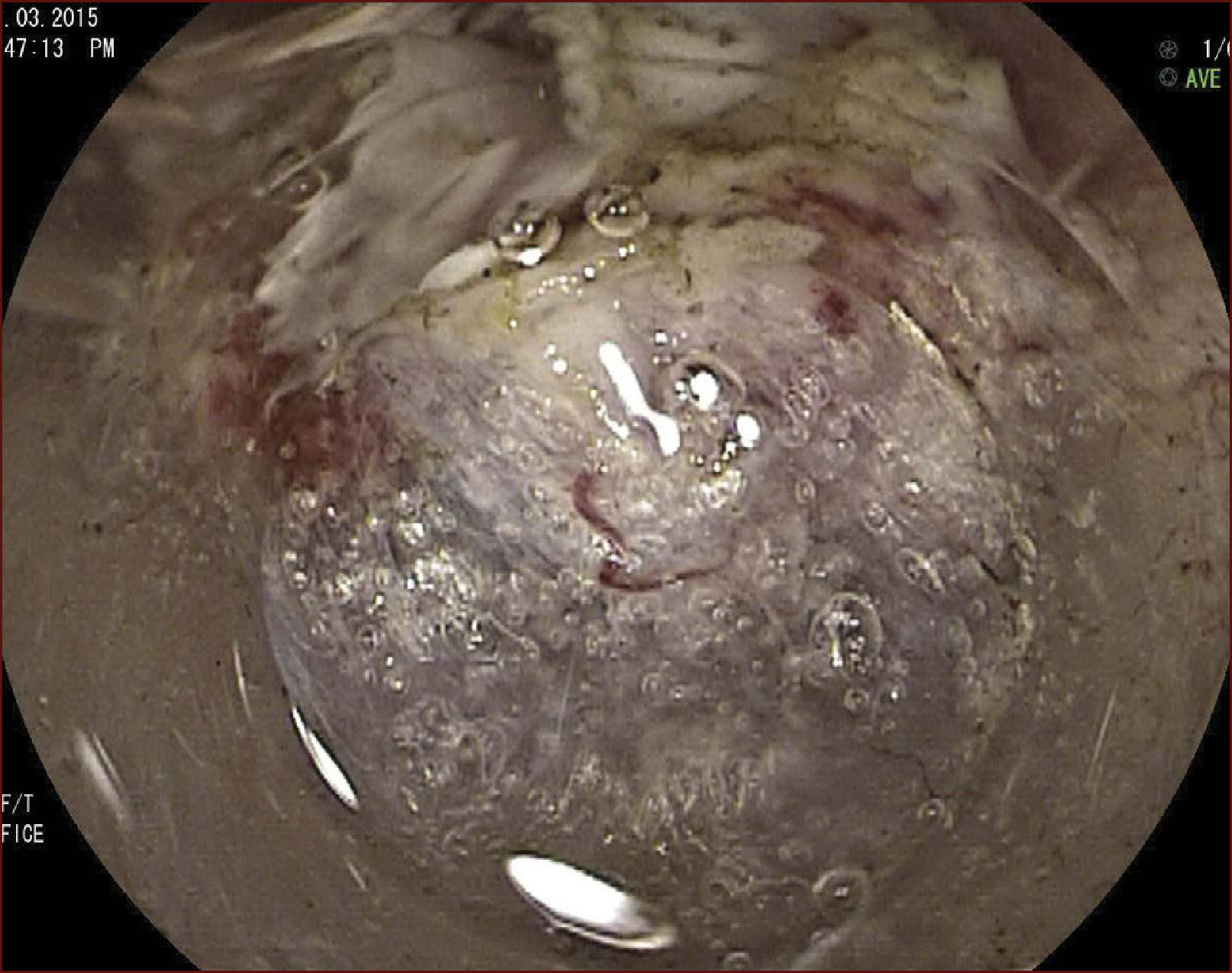
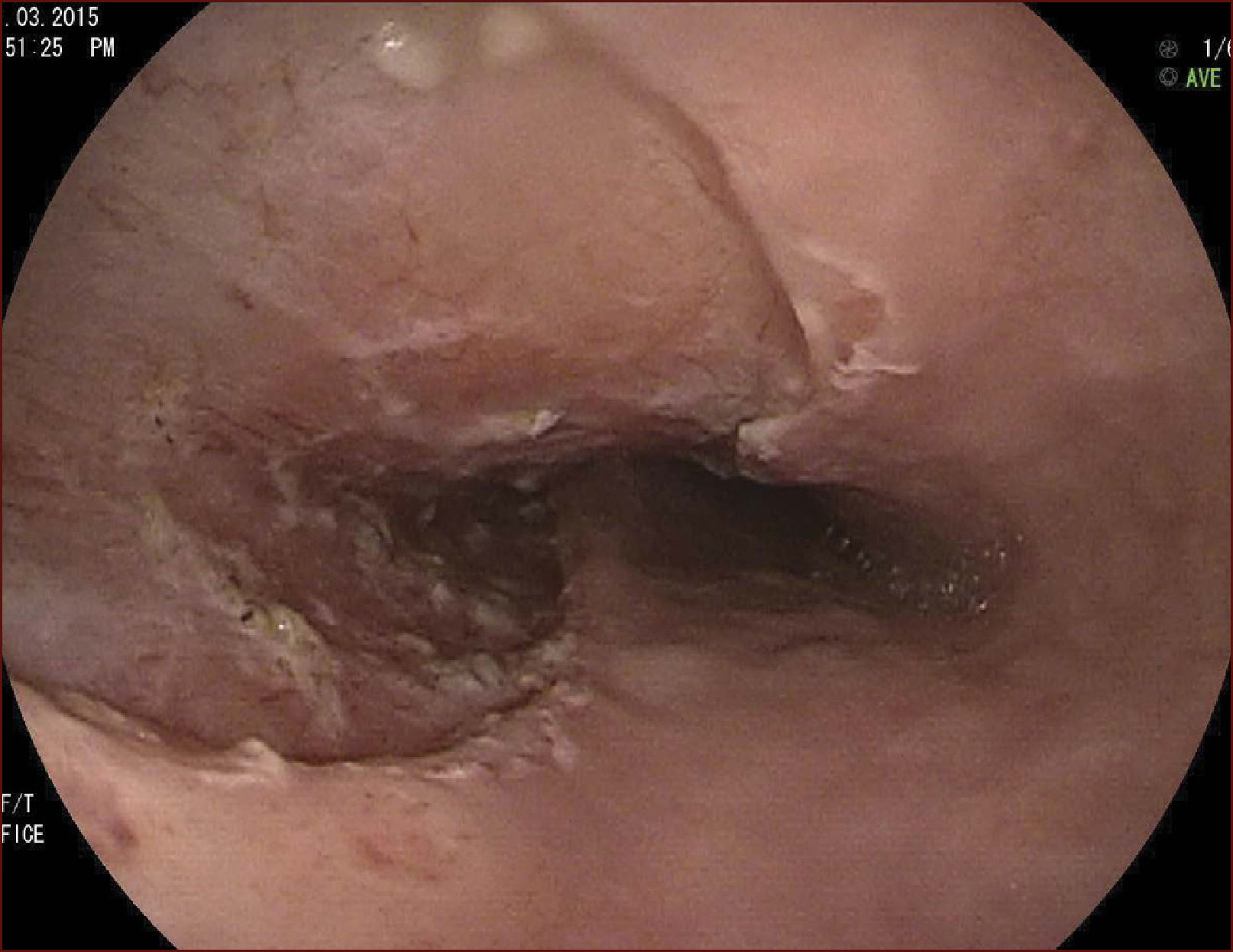
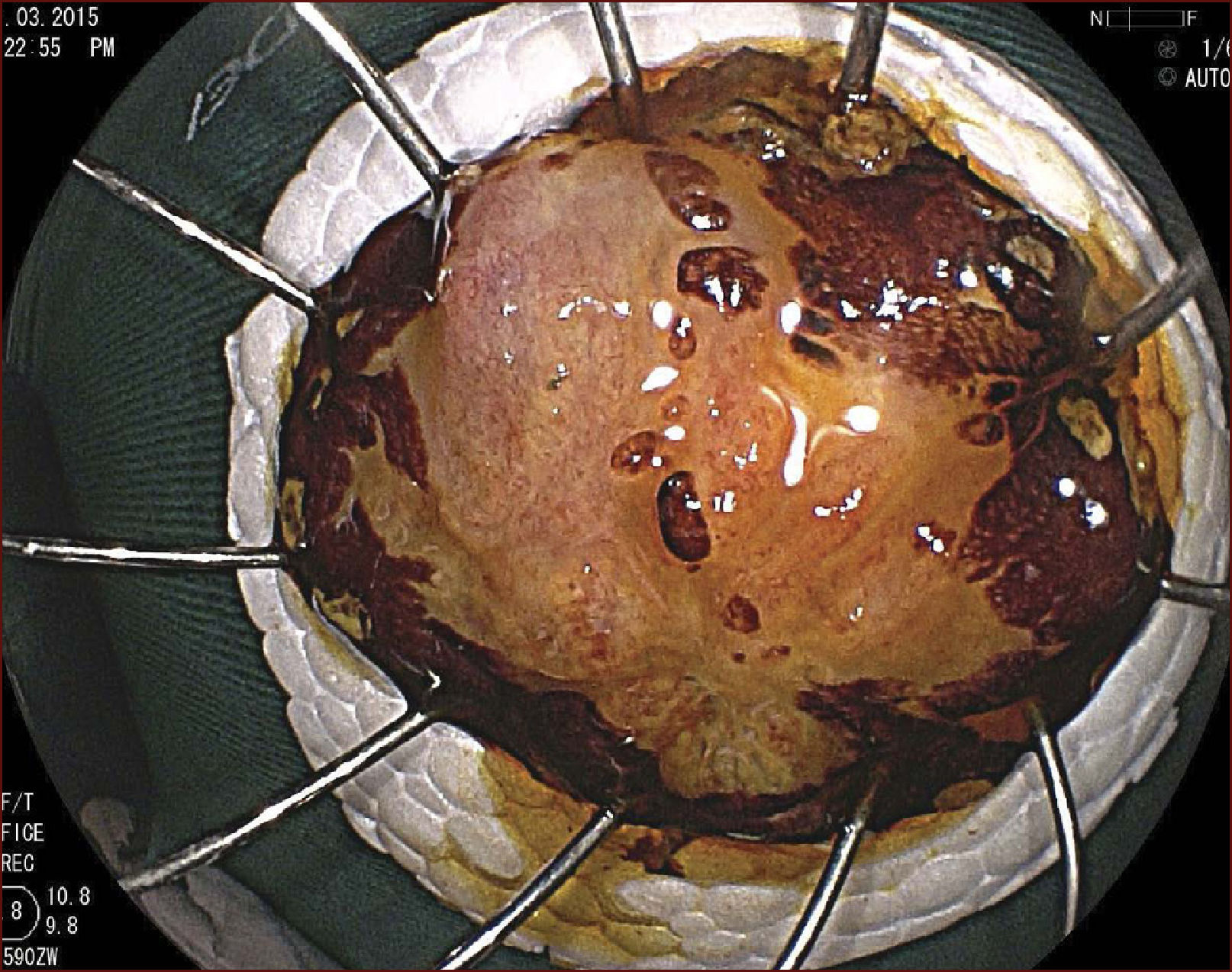
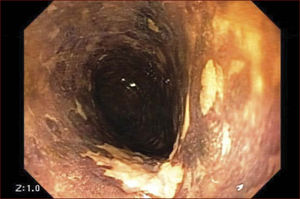
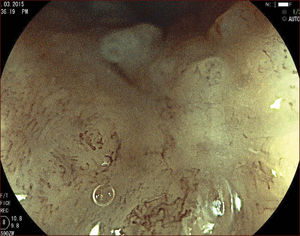
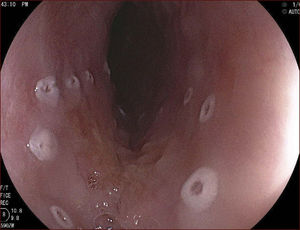
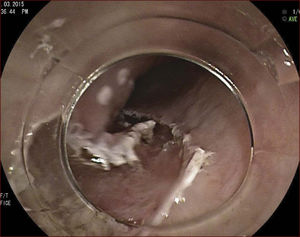
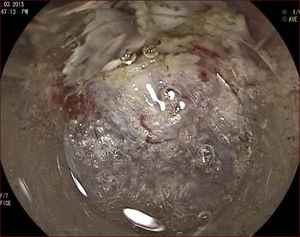
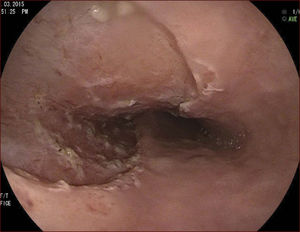
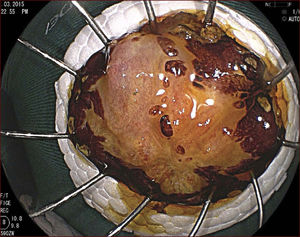
En el Instituto Alfa de Gastroenterología (Belo Horizonte, Brasil) los procedimientos de DES en el esófago comenzaron a ser realizados de forma rutinaria a partir de 2009. La mayor parte de los pacientes tratados eran portadores de cáncer de cabeza y cuello, y tuvieron su neoplasia esofágica detectada a través del programa de tamizaje del CCE de esófago por endoscopia transnasal que fue llevado a cabo en este centro a partir de 200926. En 2013 publicamos una serie de casos con 25 DES por cáncer de esófago utilizándose el método de tunelización en un total de 23 pacientes (19 hombres – 82%; 4 mujeres – 18%; promedio de edad de 68 años, intervalo: 44 – 86 años)27. Todos los procedimientos fueron realizados bajo anestesia general y administración de cefalosporina de segunda generación por 24 horas. El tamaño promedio de los tumores fue de 25mm (10-60mm), y el tiempo de resección estuvo entre 60 y 210 minutos, promedio de 85 minutos. La tasa de resección en bloque del tumor fue de 92% (23 procedimientos). En dos casos fue necesario fragmentar la lesión en dos piezas. La tasa de resección curativa fue de 80%, en consonancia con los resultados de la literatura mundial17,24,28,29. Todos los pacientes con resección no-curativa fueron manejados agregándose quimioterapia y radioterapia complementaria. Hubo tres complicaciones en esta serie: dos pacientes con enfisema mediastínico y subcutáneo sin perforación visible aparente tratados de forma conservadora y una perforación de esófago tratada mediante la aplicación de clips y con manejo clínico. En estos tres pacientes el esquema antibiótico fue cambiado por cefalosporina de tercera generación y clindamicina por cinco días. La estadía hospitalaria fue de dos a cinco días, promedio de tres días. Los informes de la histología revelaron carcinoma de células escamosas/displasia de alto grado en 23 especímenes y adenocarcinoma en el esófago de Barrett en dos casos. En tres casos las resecciones fueron superiores a 75% de la circunferencia del esófago. Se hizo inyección de triamcinolona en el sitio de resección de uno de los enfermos y todos fueron controlados con endoscopia precoz cada 15 días. Ninguno de los tres pacientes presentó estenosis esofágica sintomática que haya necesitado dilatación endoscópica. En el follow-up tardío, hubo dos casos de recurrencia local (8%). Ambos casos eran a pacientes con esófago de Barrett largo (más de 8 cm) y fueron tratados con esofagectomía (1 caso) y nueva resección endoscópica (1 caso). No hubo mortalidad. Actualmente nuestra serie se ha ampliado a 45 casos y estamos actualizando nuestros datos para una futura publicación. Las figuras 1 a 7 son ilustrativas de un caso de DES llevado a cabo en el Hospital Mater Dei Contorno en Belo Horizonte.
LAS FIGURAS 1 A 7 SON ILUSTRATIVAS DE LA TÉCNICA DE DES PARA TRATAMIENTO DEL CCE DE ESÓFAGO REALIZADA EN EL HOSPITAL MATER DEI CONTORNO EN BELO HORIZONTE, BRASIL.Se considera la DES el tratamiento de elección del CCE temprano. En los países occidentales, especialmente en Latinoamérica, el mayor reto sigue siendo promover el diagnóstico precoz de la neoplasia de esófago a través de la adecuada formación de los endoscopistas y del establecimiento de programas de escrutinio en los pacientes de alto riesgo. Además, es esencial formar centros de referencia con recursos humanos especializados y entrenados, y apoyados de una infraestructura completa, para que pueda ocurrir una expansión de la DES en estos países, con sus beneficios evidentes en la calidad de vida de estos pacientes y en la reducción de la morbilidad y mortalidad.
El autor declara no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas por el paciente para su publicación.