Los trastornos de la función tiroidea afectan profundamente al sistema cardiovascular. En esta revisión se presentan algunos aspectos fisiológicos de la interrelación entre tiroides y corazón, como tambièc)n las consecuencias de la tirotoxicosis e hipotiroidismo sobre el aparato cardiovascular. Se analiza la influencia del hipertiroidismo en la gèc)nesis de la fibrilación auricular y del hipotiroidismo en el metabolismo de las lipoproteínas. Adicionalmente, el artículo se referirá a los potenciales efectos adversos del antiarrítmico amiodarona sobre la función tiroidea y cómo se investigan y tratan. Finalmente, se expone un caso clínico real para ilustrar con mayor claridad la enorme importancia que pueden alcanzar las relaciones fisiopatológicas entre el corazón y las afecciones de esta glándula endocrina.
Disorders of thyroid function profoundly affect the cardiovascular system. Inthisreviewsomephysiologicalaspectsoftherelationship between thyroid and the heart as well as the consequences of thyrotoxicosis and hypothyroidism on the cardiovascular system are presented. The influence of hyperthyroidism is analyzed in the genesis of atrial fibrillation and of hypothyroidism on lipoprotein metabolism. Furthermore, we refer to the potential adverse effects of the antiarrhythmic amiodarone on thyroid function and how they are investigated and treated. Finally, a real clinical case is exposed to more clearly illustrate the enormous importance that can reach the pathophysiological relationships between the heart and the diseases of the thyroid gland.
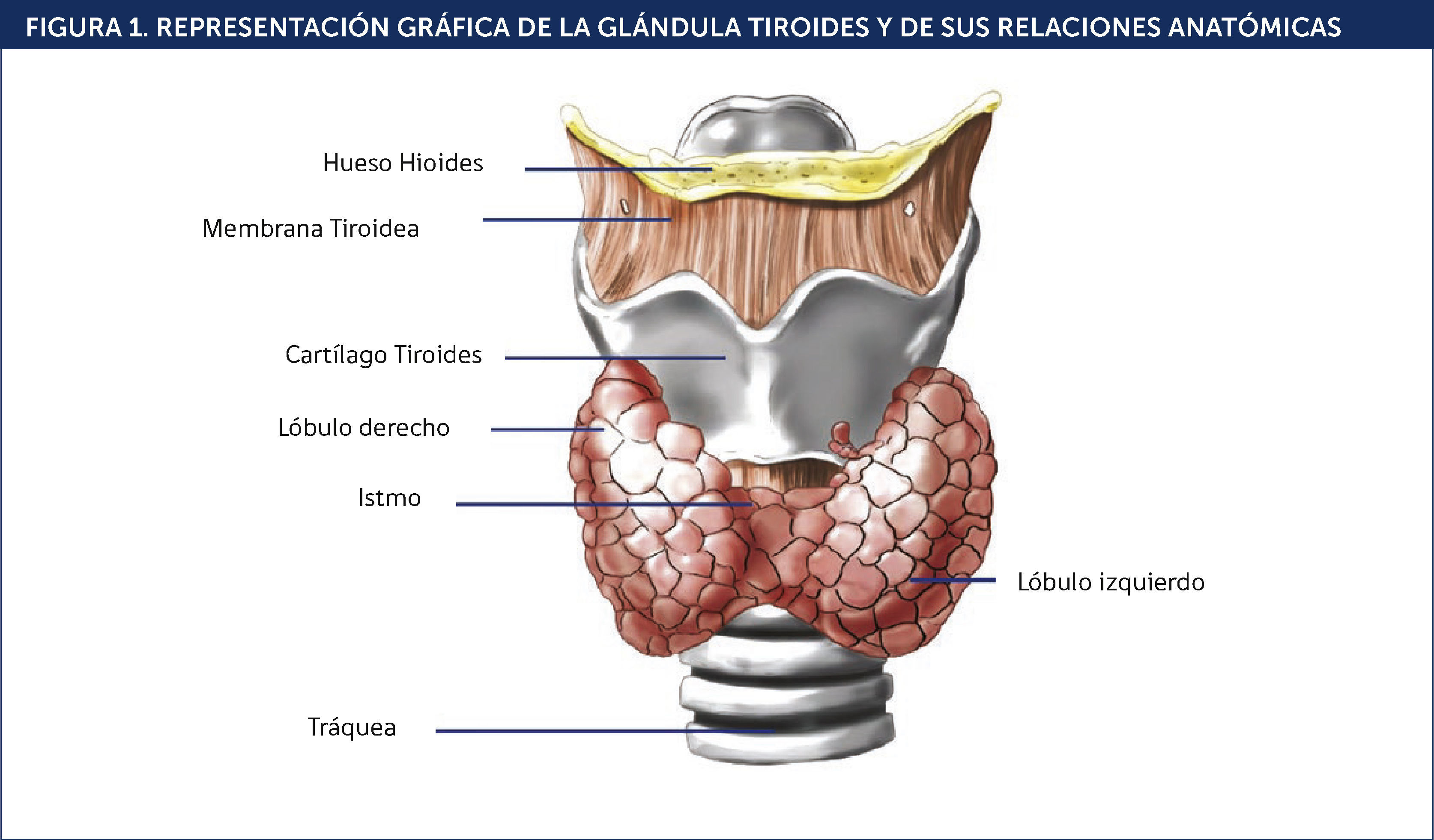
En 1656 el anatomista inglèc)s Thomas Warthon le da el nombre de “tiroides” (palabra de origen griego ∧thyreoeidèc)s∧ que significa “en forma de escudo”) a una glándula bilobulada que se ubicaba justo debajo de la laringe y a ambos lados y por delante de la tráquea (Figura 1). Posteriormente se descubrieron las hormonas que esta glándula secretaba y a la cual se les atribuían curiosas funciones, tales como la lubricación de la laringe, ser reservorio de sangre para el cerebro y de órgano estèc)tico para el embellecimiento del cuello femenino. Hoy sabemos que el tiroides secreta importantes hormonas tales como tiroxina (T4), triyodotironina (T3) y calcitonina, consideradas fundamentales en el desarrollo, el crecimiento y el metabolismo del organismo. La falta o exceso de producción de dichas hormonas y los múltiples factores involucrados en estos trastornos originan patologías complejas capaces de afectar de forma multiorgánica al paciente. Sin embargo, a pesar de que el conocimiento de las asociaciones entre el sistema cardiovascular y la disfunción tiroidea fue precoz, solo recientemente se ha considerado a la hormona tiroidea como agente causal y/o terapia potencial en las enfermedades cardiovasculares 1,2.
La síntesis de las hormonas tiroideas se regula a travèc)s de un mecanismo de retroalimentación negativa (conocido como “feedback negativo”) en el que interviene el eje hipotálamo-hipófisis-glándula tiroides. El hipotálamo libera hormona liberadora de tirotropina (TRH) la que estimula a la hipófisis a secretar tirotropina, más conocida como TSH. A su vez, la TSH estimula a la tiroides para la producción y liberación a la circulación de hormonas tiroideas (HT). Los cambios en los niveles de HT son detectados por la hipófisis: si detecta niveles bajos libera TSH; por el contrario cuando detecta niveles altos de HT disminuye la secreción de TSH. Esto nos conduce a concluir que es la TSH la que activa o inhibe a la tiroides, por lo que el rol de la TSH es crítico para la producción de HT.
Es importante destacar que el yodo interviene en la regulación de las HT tambièc)n a travèc)s de un feedback negativo (efecto de Wolff-Choikoff) con efecto bifásico: con la ingesta de yodo, aumenta la síntesis de hormonas tiroideas, pero con la ingesta excesiva, disminuye1.
TIROIDES Y CORAZÓNLa glándula tiroides y el corazón están estrechamente relacionados desde el punto de vista embriológico y, por ende, fisiológico. Concepto que se ve reforzado por los predecibles cambios de la función cardiovascular en los distintos trastornos tiroideos.
Las hormonas tiroideas (HT) ejercen acciones importantes sobre el corazón y los vasos, lo que induce diversas modificaciones que incluyen alteraciones hemodinámicas y efectos mediados sobre las cèc)lulas miocárdicas a travèc)s de la expresión de varios genes.
Sin embargo, para entender, diagnosticar y tratar las afecciones cardiovasculares que acompañan al hipo e hipertiroidismo, es necesario conocer los mecanismos celulares de la acción de HT sobre el corazón (miocito) y sobre las cèc)lulas del músculo liso vascular.
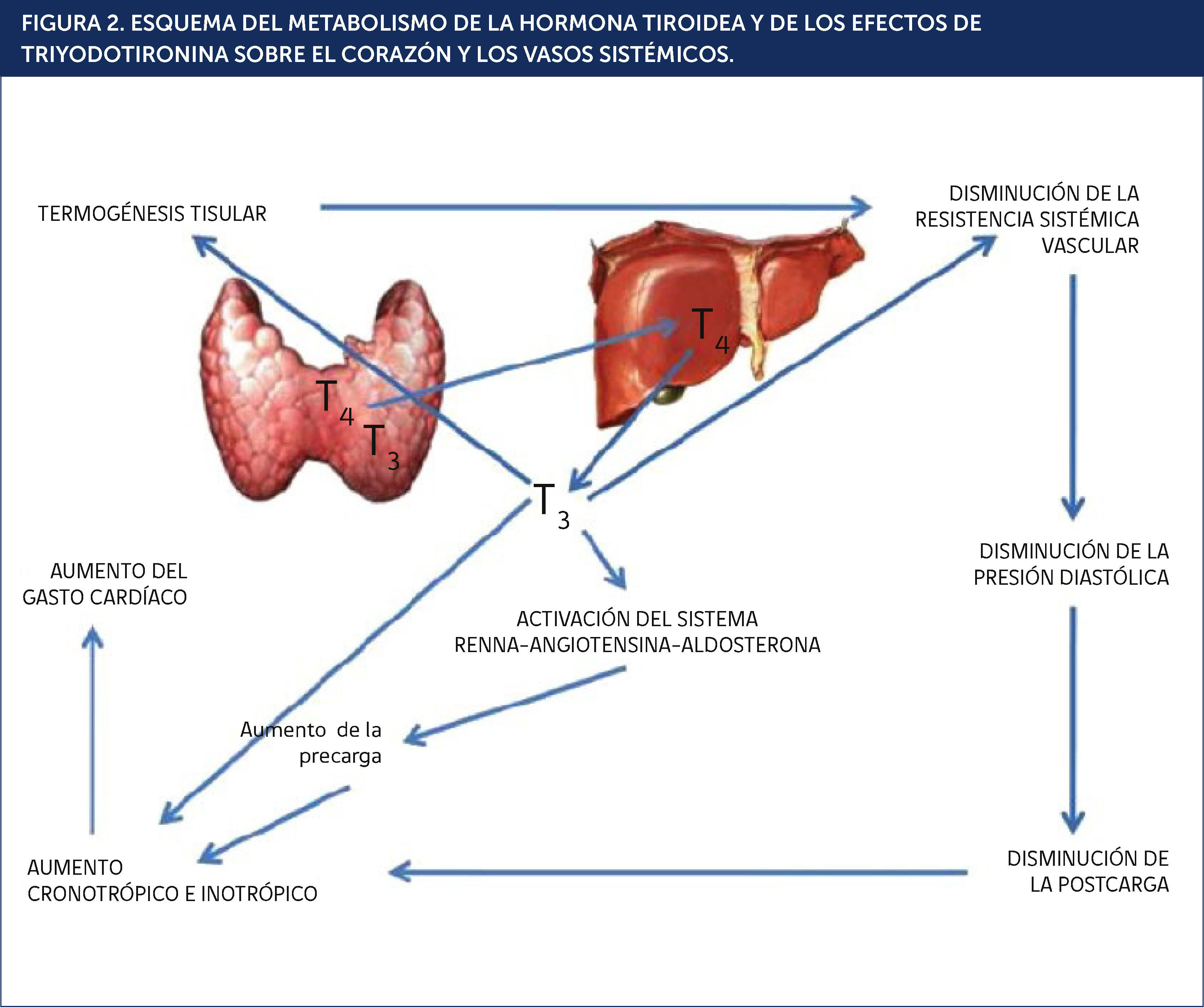
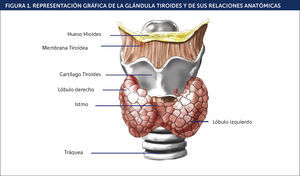
La síntesis de T4 y, en menor proporción de T3, se produce dentro de la glándula tiroides. La T4 es el producto principal mayoritariamente inactivo, mientras que T3 es la forma activa de la hormona a nivel celular. El 85% de T3, la hormona biológicamente activa, deriva de la conversión perifèc)rica de T4 por la enzima 5 tm)monodeiodinasa y ocurre principalmente en el hígado, riñón y músculo esquelèc)tico (Figura 2)3,4. Es importante destacar que si bien la conversión de T4 a T3 no ocurre en el miocito cardíaco, esta última es la HT biológicamente relevante para esta cèc)lula cardíaca, y hay evidencias de que las membranas celulares contienen proteínas transportadoras específicas para la hormona activa. Diversos estudios han confirmado que T3 es el efector de la mayoría de las acciones biológicas tiroídeas, entre ellas: la estimulación de la termogèc)nesis tisular, las alteraciones en la expresión de diversas proteínas celulares y los efectos sobre el corazón y las cèc)lulas musculares lisas de los vasos sanguíneos. La T3 libre sèc)rica ingresa en las cèc)lulas mediante un proceso de difusión facilitada y parece penetrar directamente al núcleo sin unirse a otra proteína dentro de la cèc)lula (Figura 3). La mayoría de las observaciones indican que los miocitos cardíacos no pueden metabolizar T4 ni T3 y, por lo tanto, todos los efectos nucleares y los cambios de expresión gèc)nica se deben a modificaciones en las concentraciones sanguíneas de T3 y sus efectos se llevan a cabo a travèc)s de la transcripción gèc)nica y extragèc)nica.
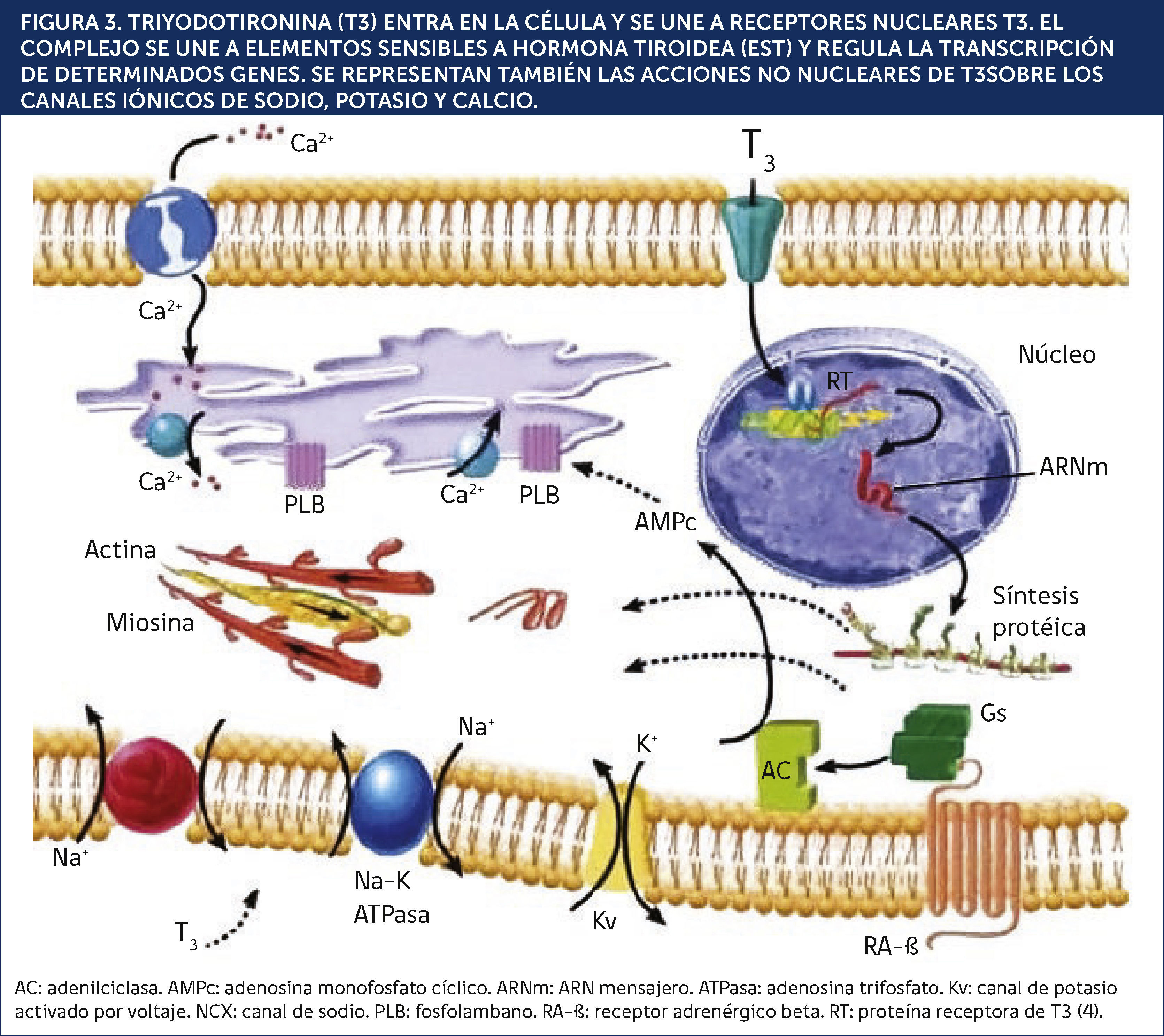
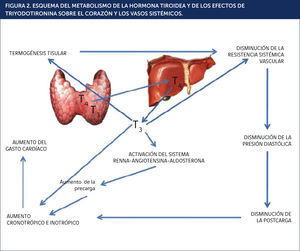
TRIYODOTIRONINA (T3) ENTRA EN LA CÉLULA Y SE UNE A RECEPTORES NUCLEARES T3. EL COMPLEJO SE UNE A ELEMENTOS SENSIBLES A HORMONA TIROIDEA (EST) Y REGULA LA TRANSCRIPCIÓN DE DETERMINADOS GENES. SE REPRESENTAN TAMBIÉN LAS ACCIONES NO NUCLEARES DE T3SOBRE LOS CANALES IÓNICOS DE SODIO, POTASIO Y CALCIO.
AC: adenilciclasa. AMPc: adenosina monofosfato cíclico. ARNm: ARN mensajero. ATPasa: adenosina trifosfato. Kv: canal de potasio activado por voltaje. NCX: canal de sodio. PLB: fosfolambano. RA-ß: receptor adrenèc)rgico beta. RT: proteína receptora de T34.
Cuando T3 ingresa al miocito, èc)sta interactúa con los receptores nucleares de hormonas tiroideas (RT3), los cuales pertenecen a la “superfamilia de receptores nucleares”. La unión de estos receptores a la T3 conduce a la transcripción óptima de secuencias específicas de ácido desoxirribonucleico (ADN); estos genes codifican tanto proteínas regulatorias como estructurales relacionadas con la función contráctil. En algunos casos la regulación es positiva, y en otros, negativa4,5. La Tabla 1 muestra los principales productos de regulación positiva y negativa por T36-8.
TIROTOXICOSIS Y CORAZÓNLos pacientes con tirotoxicosis se presentan, clínicamente, con síntomas y signos característicos, muchos de ellos referidos al corazón y al sistema cardiovascular.
Conceptualmente, se entiende por tirotoxicosis al exceso de HT circulantes, sean estas de origen exógeno (p. ej., dosis exageradamente altas de HT prescritas inadvertidamente por el mèc)dico) o bien de procedencia endógena. En este último caso se habla con propiedad de hipertiroidismo.
Los síntomas cardíacos que pueden descubrirse en la entrevista mèc)dica son palpitaciones precordiales, disnea y fatiga ante el esfuerzo físico y dolor torácico de características anginosas (Tabla 2)3.
MANIFESTACIONES CARDIOVASCULARES DE LA TIROTOXICOSIS
| Palpitaciones | Hipertensión arterial sistólica |
|---|---|
| Taquicardia | Precordio hiperdinámico |
| Fibrilación auricular | Angina de pecho |
| Intoleracia al ejercicio | Hipertrofia cardíaca |
| Disnea de esfuerzo | Edema perifèc)rico |
| Presión de pulso aumentada | Insuficiencia cardíaca congestiva |
Por su parte, el examen físico cardiovascular puede develar taquicardia, pulso irregular (incluso con las características semiológias de la arritmia completa), hipertensión arterial sistólica con presión de pulso o diferencial aumentada, palpación precordial hiperdinámica y, en ocasiones, edema perifèc)rico (Tabla 2).
El gasto cardíaco (GC = volumen sistólico eyectivo x frecuencia cardíaca) se encuentra incrementado, siendo 50 • 300% mayor que en individuos sanos. Este notable aumento del GC obedece a los efectos combinados de diversos factores fisiopatológicos, tales como el aumento de la frecuencia cardíaca de reposo, el aumento de la contractilidad miocárdica, el aumento de la fracción del eyección del ventrículo izquierdo, el aumento de la volemia y, por último, a una disminución de la resistencia vascular sistèc)mica3.
Se considera que la causa de la disminución en la capacidad funcional de los pacientes hipertiroideos puede deberse a una incapacidad de aumentar adicionalmente la frecuencia cardíaca y la fracción de eyección, como ocurre normalmente ante el ejercicio físico, dado que estos enfermos presentan estas variables ya basalmente elevadas. Asimismo, se cree que puede tener influencia la incapacidad para reducir aún más su resistencia vascular sistèc)mica -como acontece en sujetos normales frente al esfuerzo físico-dado que el paciente aquejado de tirotoxicosis ya posee esta variable fisiológica acentuadamente reducida.
En pacientes con tirotoxicosis de evolución prolongada o bien en aquellos de edad avanzada, se presenta una miopatía esquelèc)tica que puede contribuir tambièc)n a la intolerancia al esfuerzo físico.
Infrecuentemente, los pacientes hipertiroideos pueden manifestar síntomas como angina de pecho, en ocasiones asociada a electrocardiogramas que revelan isquemia miocárdica. En pacientes de edad avanzada puede existir enfermedad coronaria obstructiva que se expresa en el contexto del cuadro tirotóxico debido al aumento del consumo de oxígeno miocárdico provocado por esta condición ya que todos los factores determinantes del consumo de oxígeno miocárdico concurren:
- 1.
Aumento de la frecuencia cardíaca.
- 2.
Aumento de la contractilidad ventricular.
- 3.
Aumento de la tensión de la pared ventricular.
Es interesante mencionar que, en ocasiones, estos cuadros anginosos pueden manifestarse tambièc)n en pacientes tirotóxicos relativamente jóvenes. En estos, la anatomía coronaria estudiada mediante coronariografía convencional o tomografía computada cardíaca, demuestra arterias coronarias libres de lesiones obstructivas. En estos casos los síntomas anginosos se han atribuido a espasmos coronarios.
Fibrilación AuricularEn el hipertiroidismo la alteración del ritmo más frecuente es la taquicardia sinusal, la cual se encuentra en la mayoría de los pacientes afectados por una tirotoxicosis.
Sin embargo, la fibrilación auricular (FA) tambièc)n se asocia significativamente al hipertiroidismo. Si se considera una población control, eutiroidea, el 2,3% de sus miembros presentan FA versus el 13,8% de quienes sufren un hipertiroidismo clínico.
Entre los factores de riesgo para desarrollar FA en el contexto de una tirotoxicosis se cuentan la edad avanzada (> 70 años), el gèc)nero masculino, la hipertensión arterial, diabetes mellitus, la presencia de una cardiopatía de base (coronaria, valvular o insuficiencia cardíaca) y la intensidad / duración del estado tirotóxico3,4.
Por otra parte, si bien en pacientes no seleccionados con FA la prevalencia de hipertiroidismo es relativamente baja, se justifica la medición de TSH debido a la posibilidad de restablecer el estado eutiroideo lo cual facilita a su vez la conversión a ritmo sinusal. Esto último puede ser muy difícil si se ignora la condición tiroidea del paciente.
Desde un punto de vista terapèc)utico el objetivo inicial es el control de la respuesta ventricular mientras el paciente aún permanece en FA. Los fármacos de primera elección para lograrlo son los β•bloqueadores asociados a medicamentos antitiroídeos. La digoxina tiene claramente una menor utilidad para el control de la frecuencia cardíaca; lo mismo puede establecerse para los calcio antagonistas no dihidropiridínicos (diltiazem y verapamilo) los que utilizados por vía endovenosa conllevan un significativo riesgo de hipotensión aguda en este escenario9,10.
Respecto al uso de anticoagulantes en la FA asociada a hipertiroidismo debe emplearse el mismo criterio que se utiliza para la FA en otros contextos. Es decir, pacientes jóvenes, sin cardiopatía estructural, sin hipertensión arterial ni diabetes mellitus, sin antecedentes de eventos tromboembólicos previos no deberían ser anticoagulados ya que su riesgo de tromboembolismo sistèc)mico es muy bajo, de forma tal que el riesgo de sangrado supera la eventual protección que puede conferir el anticoagulante. A la inversa, pacientes que acumulan factores de riesgo para tromboembolismo sistèc)mico deben ser anticoagulados de acuerdo a las guías de práctica clínica existentes. Están disponibles sistemas de puntaje que ayudan a estratificar el riesgo de tromboembolismo sistèc)mico; uno de ellos es el CHA2DS2 • VASc.
Con el tratamiento de la tirotoxicosis con fármacos antitiroideos o yodo radioactivo (131I) la mayoría de los pacientes convertirán a ritmo sinusal dentro de dos o tres meses. Sin embargo, pacientes de mayor edad (p. ej., >60 años) con FA de larga duración pueden persistir en FA. En estos casos, una vez que el enfermo se encuentra eutiroideo, debe intentarse una cardioversión elèc)ctrica o farmacológica bajo anticoagulación apropiada. Con esta terapia la mayor parte de ellos obtendrá y se mantendrá en ritmo sinusal, eventualmente con el uso asociado de un antiarrítmico como sotalol o, en ausencia de cardiopatía estructural, flecainida o propafenona más una pequeña dosis de β•bloqueador.
Cabe mencionar que en pacientes de edad avanzada en ocasiones se presenta una forma de tirotoxicosis que se conoce como hipertiroidismo apático, descrito por primera vez por FH Lahey en 1931. Este cuadro carece de las manifestaciones clínicas típicas de la tirotoxicosis, tales como temblor, inquietud o ansiedad. Por el contrario, los pacientes con hipertiroidismo apático expresan más bien somnolencia, letargo y, en ocasiones, delirio11. Ante la sospecha clínica, que podría estar dada por una fibrilación auricular sin motivo aparente, la evaluación de laboratorio evidenciará T4 y T3 elevadas y una TSH suprimida12.
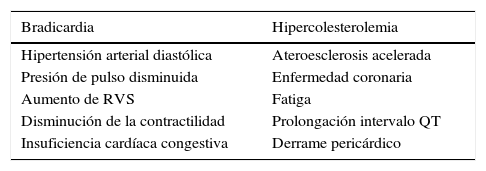
HIPOTIROIDISMO Y CORAZÓNComo es sabido, los síntomas y signos cardiovasculares del hipotiroidismo son, en general, opuestos a los del hipertiroidismo (Tabla 3).
MANIFESTACIONES CARDIOVASCULARES DEL HIPOTIROIDISMO
| Bradicardia | Hipercolesterolemia |
|---|---|
| Hipertensión arterial diastólica | Ateroesclerosis acelerada |
| Presión de pulso disminuida | Enfermedad coronaria |
| Aumento de RVS | Fatiga |
| Disminución de la contractilidad | Prolongación intervalo QT |
| Insuficiencia cardíaca congestiva | Derrame pericárdico |
Así, cuando la función tiroidea está disminuida es posible encontrar bradicardia sinusal, hipertensión arterial leve de predominio diastólico, una presión de pulso o diferencial reducida (debido a un incremento de la resistencia vascular sistèc)mica), fatigabilidad e intolerancia al frío.
Adicionalmente, la contractilidad cardíaca disminuye y el gasto cardíaco se encuentra reducido. La disminución de la contractilidad miocárdica se explica, al menos en parte, por modificaciones en la expresión gèc)nica causadas por el dèc)ficit de HT. Estas alteraciones se traducen en una menor actividad de la enzima Ca2+ - ATPasa del retículo sarcoplásmico y un aumento del inhibidor de esta última enzima, una proteína cuyo nombre es fosfolamban. Ambas proteínas participan en los flujos de calcio intracelular. El calcio, como sabemos, es vital para el proceso contráctil del corazón, teniendo influencia tanto en la función sistólica como diastólica13.
Las alteraciones en el metabolismo de las lipoproteínas sanguíneas inducidas por el hipotiroidismo conducen a grados importantes de hipercolesterolemia (aumento de colesterol LDL y de apolipoproteína B), lo que a su vez determina un proceso de ateroesclerosis acelerada y desarrollo de enfermedad coronaria. El mecanismo subyacente obedece a una disminución de los receptores hepáticos de LDL, como tambièc)n de su actividad, lo que determina una disminución de la depuración sanguínea del colesterol LDL.
La condición hipotiroidea puede prolongar el intervalo QT del electrocardiograma; esto es relevante porque hace a estos pacientes susceptibles a arritmias ventriculares, como es, por ejemplo, un tipo de taquicardia ventricular polimorfa potencialmente fatal denominada torsade de pointes (en español, torsión de puntas)14.
Por último, los enfermos hipotiroideos pueden desarrollar un derrame pericárdico rico en proteínas de lenta acumulación. La gradualidad de su generación explica que el derrame pueda ser de un volumen muy considerable sin provocar taponamiento cardíaco.
Prácticamente todas las alteraciones estructurales y funcionales cardiovasculares que hemos descrito responden al tratamiento de sustitución con L•tiroxina.
TRATAMIENTOEn pacientes jóvenes, sanos a excepción del hipotiroidismo, se puede iniciar la terapia de sustitución con L•tiroxina con dosis plenas ya desde el inicio (esto suele ser 1,6α/4g/kg/día).
Sin embargo, en pacientes de edad avanzada que pueden tener cardiopatía coronaria o de otro tipo, es prudente iniciar el tratamiento de reemplazo con dosis bajas, digamos 25α/4g/día. De ahí en adelante, se sugiere ir titulando la dosis en forma ascendente con lentitud, con incrementos adicionales de dosis cada 4 • 6 semanas hasta obtener el estado eutiroideo.
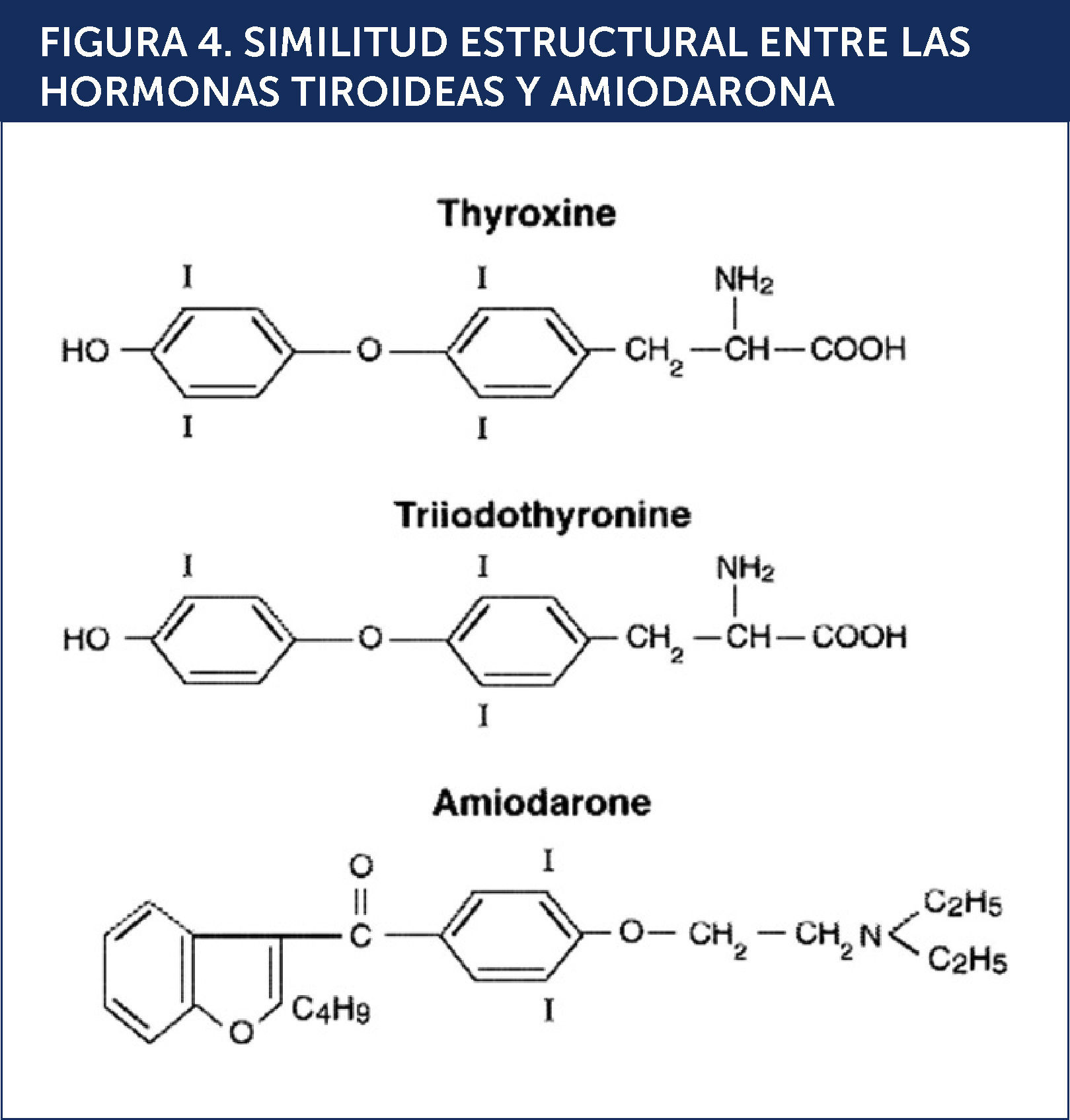
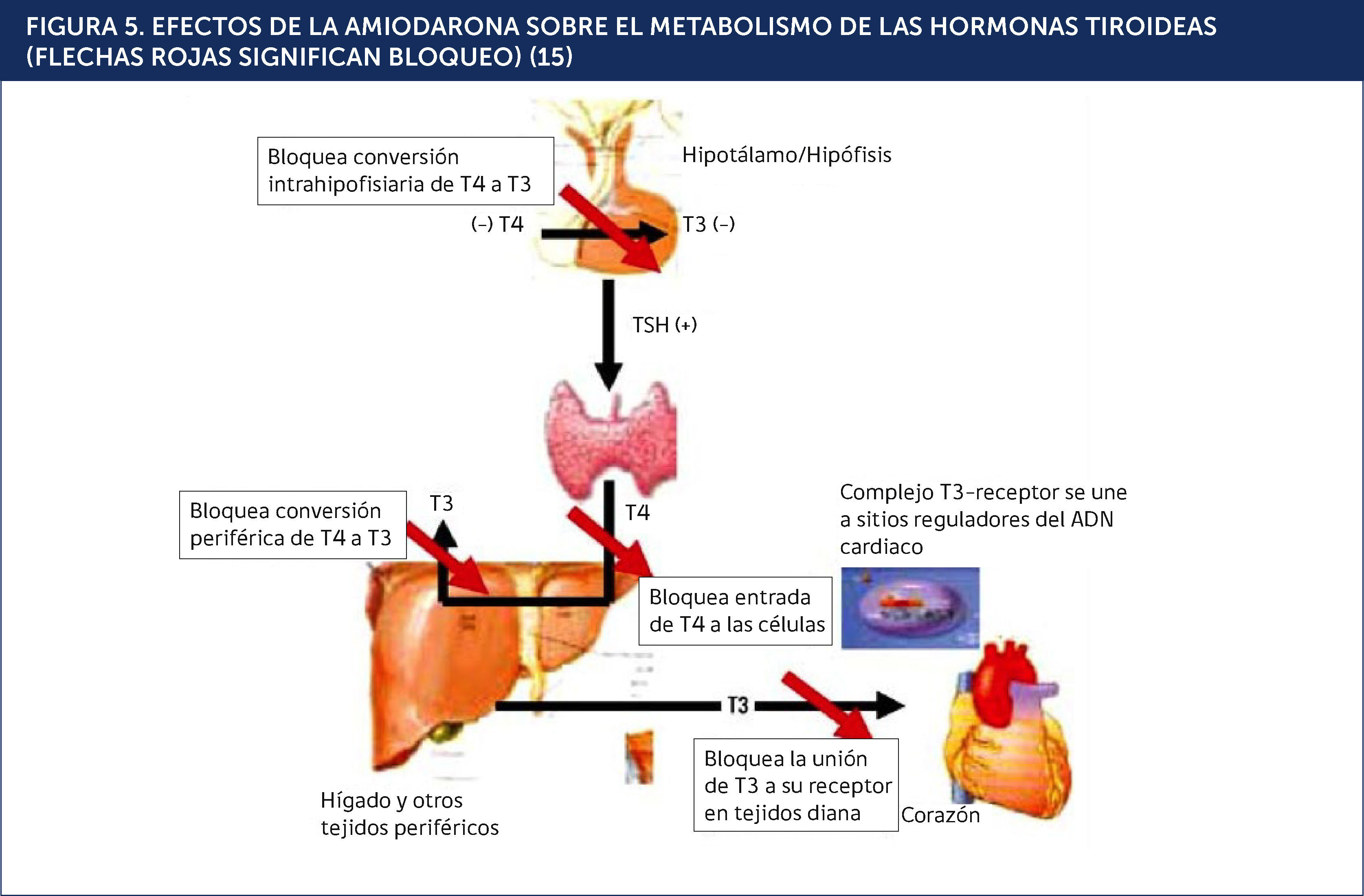
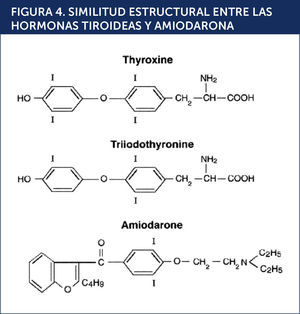
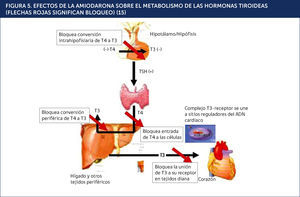
DISFUNCIÓN TIROÍDEA PRODUCIDA POR AMIODARONALa amiodarona (AMD) es un fármaco antiarrítmico del tipo III de la clasificación de Vaughan Williams utilizado en la profilaxis y tratamiento de trastornos del ritmo cardíaco tales como fibrilación auricular y taquiarritmias ventriculares. Su mecanismo de acción consiste en bloquear los canales de potasio, poseyendo además, propiedades betabloqueantes. Estructuralmente posee una semejanza significativa con las hormonas tiroideas. Cada molèc)cula de AMD contiene dos átomos de yodo, pudiendo inhibir la función de la 5¿deiodinasa y provocando una disminución en la síntesis de T3 a partir de T4 (Figuras 4 y 5)15,16.
EFECTOS DE LA AMIODARONA SOBRE EL METABOLISMO DE LAS HORMONAS TIROIDEAS (FLECHAS ROJAS SIGNIFICAN BLOQUEO)15.
Si bien la mayoría de los pacientes a quienes se administra este fármaco logran adaptar su metabolismo y permanecen eutiroideos, entre un 5 y 25% de los pacientes tratados con AMD manifiestan alteraciones en las pruebas funcionales del tiroides y sufren una disfunción tiroidea, más frecuentemente hipotiroidismo o, menos a menudo, hipertiroidismo, estados que se conocen como disfunción tiroidea inducida por AMD (DTIA). Esto último es provocado por los efectos inducidos por el exceso de yodo farmacológico (sobrecarga de yodo) en casos en que hay una falla de base, tales como pacientes con tiroiditis crónica de Hashimoto subyacente o potenciación de la autoinmunidad tiroidea acelerando el curso natural del hipotiroidismo, o en pacientes con nódulos o Enfermedad de Graves latente conduciendo a un hipertiroidismo17.
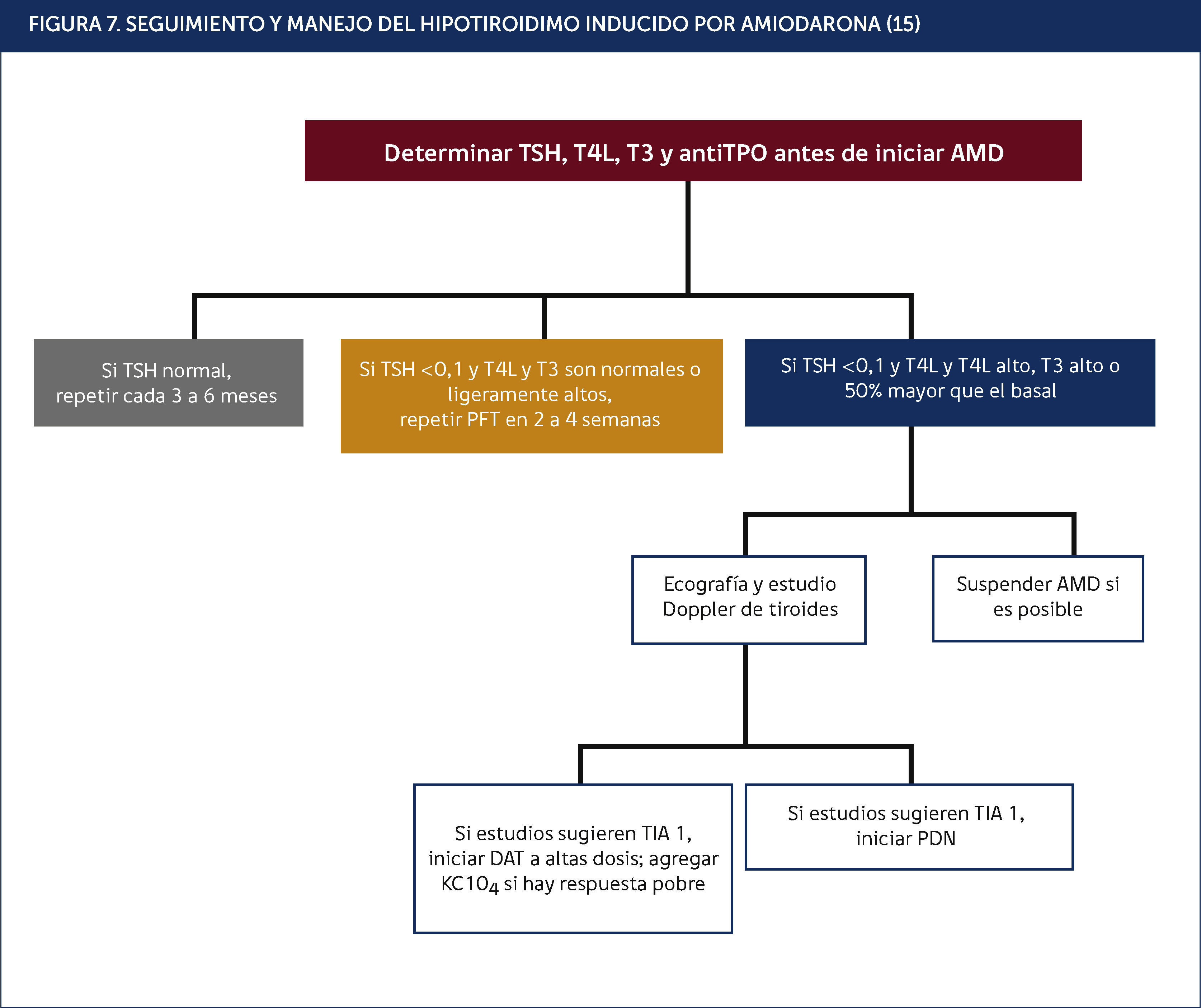
Hipotiroidismo inducido por AMDLa tiroiditis crónica autoinmune es el factor de riesgo más frecuente para el desarrollo de hipotiroidismo inducido por AMD (HIA), el que se manifiesta entre los 6 y 12 meses de instaurado el fármaco. La mayoría de estos pacientes presentan TSH elevada y anticuerpos antiperoxidasa (TPO) positivos antes de iniciar el tratamiento con el fármaco en cuestión16.
Es importante recalcar que no hay diferencias en las manifestaciones clínicas y los hallazgos de laboratorio entre los pacientes que presentan hipotiroidismo espontáneo y los con HIA. En estos casos no es necesario suspender la AMD, bastando el reemplazo con L • tiroxina en dosis inicialmente bajas (25 a 50α/4g/día), dosis que se va titulando lentamente hasta lograr nuevamente niveles normales de TSH, aunque teniendo presente que las dosis necesarias podrían ser mayores a las utilizadas en el hipotiroidismo espontáneo.
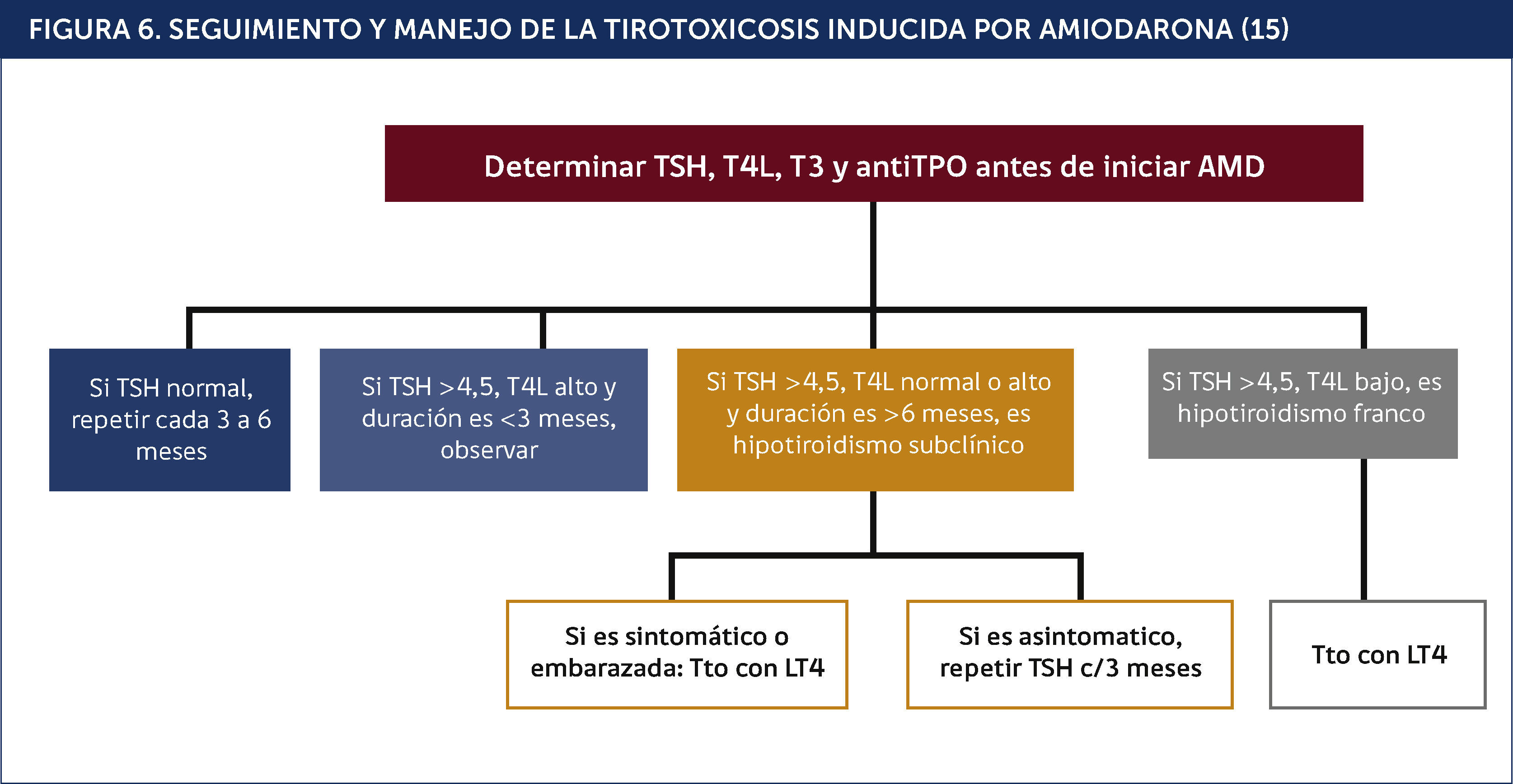
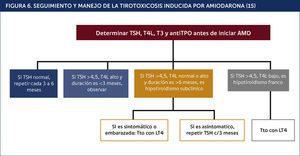
El algoritmo de la Figura 6 indica el estudio y tratamiento del HIA.
SEGUIMIENTO Y MANEJO DE LA TIROTOXICOSIS INDUCIDA POR AMIODARONA15.
Si bien el hipertiroidismo inducido por AMD es menos frecuente que HIA, es una causa bien establecida de tirotoxicosis, siendo su manejo clínico más complejo que el del HIA.
Existen dos tipos de tirotoxicosis inducida por AMD (TIA)18.
TIA tipo 1
Es el hipertiroidismo inducido por yodo en pacientes quienes presentan una enfermedad tiroidea subyacente, como un bocio multinodular no tóxico o una enfermedad de Graves latente. En estos casos, el aporte exógeno de yodo en la molèc)cula de AMD, desencadena un hipertiroidismo por síntesis aumentada de HT.
TIA tipo 2
Este tipo de hipertiroidismo se produce por destrucción de los folículos tiroideos con liberación pasiva de HT preformada, sin que exista enfermedad tiroidea subyacente. Es decir, corresponde a una tiroiditis debido a que en algunos individuos la AMD y sus metabolitos son tóxicos para las cèc)lulas tiroideas humanas. Como en otras tiroiditis, la tirotoxicosis puede ser seguida por una fase de hipotiroidismo transitorio que precede la recuperación total de la función tiroidea.
El tipo 1 se observa más frecuentemente durante cursos relativamente cortos de terapia con AMD, entendièc)ndose por “corto” 1 a 2 años. En contraposición, el tipo 2 suele presentarse más a menudo en relación a períodos prolongados de tratamiento con AMD (mayor a dos años).
En la Tabla 4 se pueden apreciar otras diferencias que caracterizan los tipos 1 y 2 de TIA15.
CARACTERÍSTICAS DE LOS TIPOS DE TIROTOXICOSIS INDUCIDOS POR AMIODARONA
| CARACTERÍSTICA | TIA 1 | TIA 2 |
|---|---|---|
| Enfermedad tiroides preexistente | Si (ya sea BMN o EG latente) | No |
| Examen físico | Bocio; uno o más nódulos | Normal o levemente firme, ocasionalmente doloroso |
| Duración de la terapia con AMD | Corto (1 a 2 años) | Largo (2 años) |
| Pruebas de función tiroidea | T4L alto; T3 normal o alto | T4L alto; T3 normal o alto |
| AutoAc tiroideos (ACAT) | Ausente (a menos que EG estèc) presente) | Ausente |
| Captación de 131 I | Bajo | Muy bajo |
| Ecografía tiroídea | Enfemedad tiroídea subyacente (BMN, EG) | Normal o mínimamente crecido, patrón heterogèc)neo |
| Doppler tiroideo | Flujo sanguíneo parenquimatoso incrementado | Flujo sanguíneo parenquimatoso normal o disminuido |
| IL-6 sèc)rica | Normal o bajo | Elevado (sólo en partes del mundo yodo-deficientes) |
| Terapia | Suspender AMD si es posible, dosis altas de DAT, perclorato, litio | Descontinuación de AMD puede no ser escencial, prednisona, litio |
| Hipotiroidismo subsecuente | No | Frecuente |
BMN: bocio multinodular; EG: enfermedad de Graves; DAT: drogas antitiroídeas
El cuadro clínico de la TIA es similar en ambos tipos. Debido a los efectos betabloqueadores de AMD, la taquicardia y las palpitaciones precordiales, tan característicos de otras variedades de hipertiroidismo, pueden estar ausentes. Excepcionalmente, la TIA tipo 2 puede manifestarse con dolor tiroideo y fiebre. La tiroides puede estar aumentado de tamaño y ser nodular en el tipo 1, mientras en que la TIA tipo 2 la glándula suele exhibir un tamaño normal.
En la TIA tipo 1 se recomienda la discontinuación de la AMD. Sin embargo, en algunos casos esto puede no ser posible (p. ej.: cuando AMD está siendo utilizada en el tratamiento de arritmias ventriculares graves. Este escenario es menos frecuente hoy en día debido al advenimiento de los desfibriladores automáticos implantables). Por otra parte, la suspensión de la AMD debe sopesarse debido a sus efectos inhibitorios sobre la conversión de T4 a T3 y a sus efectos betabloqueadores, los cuales pueden ser clínicamente útiles. Debe considerarse, además, que una vez suspendida la AMD, èc)sta se suele mantener en circulación durante meses debido a su naturaleza lipofílica persistiendo depósitos en el tejido adiposo por períodos prolongados.
Por esto, se suelen emplear fármacos antitiroídeos tales como tiamazol o propiltiouracilo en dosis altas. Si no hay respuesta a ellos, puede se apropiado adicionar perclorato de potasio (KClO4). Este último es un inhibidor competitivo de la captación tiroidea de yodo19,20.
El tratamiento de la TIA tipo 2 se basa en el uso de glucocorticoides como prednisona en dosis de 40 - 60mg/día durante varios meses. Con esta aproximación terapèc)utica se logra una rápida resolución del cuadro en la mayoría de los pacientes. En este tipo de TIA es menos relevante la suspensión de la AMD.
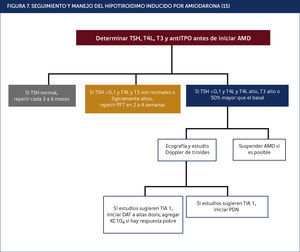
La Figura 7 muestra un algoritmo referente al seguimiento y tratamiento de ambas variedades de TIA.
SEGUIMIENTO Y MANEJO DEL HIPOTIROIDIMO INDUCIDO POR AMIODARONA15.
Un excelente ejemplo que permitirá aplicar los conceptos que hemos expuesto en esta revisión es el caso clínico que presentan Desai et al.21 donde tal como lo indican “el pasado puede ser el prólogo”. En este caso un paciente varón, de 36 años de edad, consulta en el servicio de urgencia por edema, fatiga y disnea de esfuerzos progresiva desde hace dos semanas. Se constata una insuficiencia cardíaca CF III, NYHA (Clase Funcional definida por la New York Heart Association), es decir, con síntomas causados por mínima actividad. Durante la anamnesis refiere haber sufrido una caída desde el techo de su casa hace 10 meses, con fractura de la base del cráneo. Previo a esta consulta, hace 8 meses, había presentado una dislipidemia con un colesterol total de 383mg/dL, colesterol LDL de 236mg/dL, colesterol HDL de 56mg/dL y triglicèc)ridos de 461mg/dL. Se le prescribe atorvastatina, sin embargo, esta debe suspenderse por mialgias y CK total de 794 U/L. Un mes despuèc)s las mialgias pasaron, pero la CK total aumentó a 1200 U/L. Se determinó la tirotropina (TSH) que resultó normal: 0,32 mIU/L (VN: 0,30 • 5 mIU/L). Este paciente no refirió antecedentes familiares relevantes, como tampoco de tabaquismo, consumo de alcohol o drogas ilícitas.
Al examen físico se observó pulso de 80/min regular, presión arterial de 80/60mmHg, leve dificultad respiratoria, distensión venosa yugular, crepitaciones pulmonares en las bases, corazón con tonos apagados, R3 (+), ventrículo izquierdo no palpable. Las extremidades impresionaban frías, con importante edema pretibial (+++).
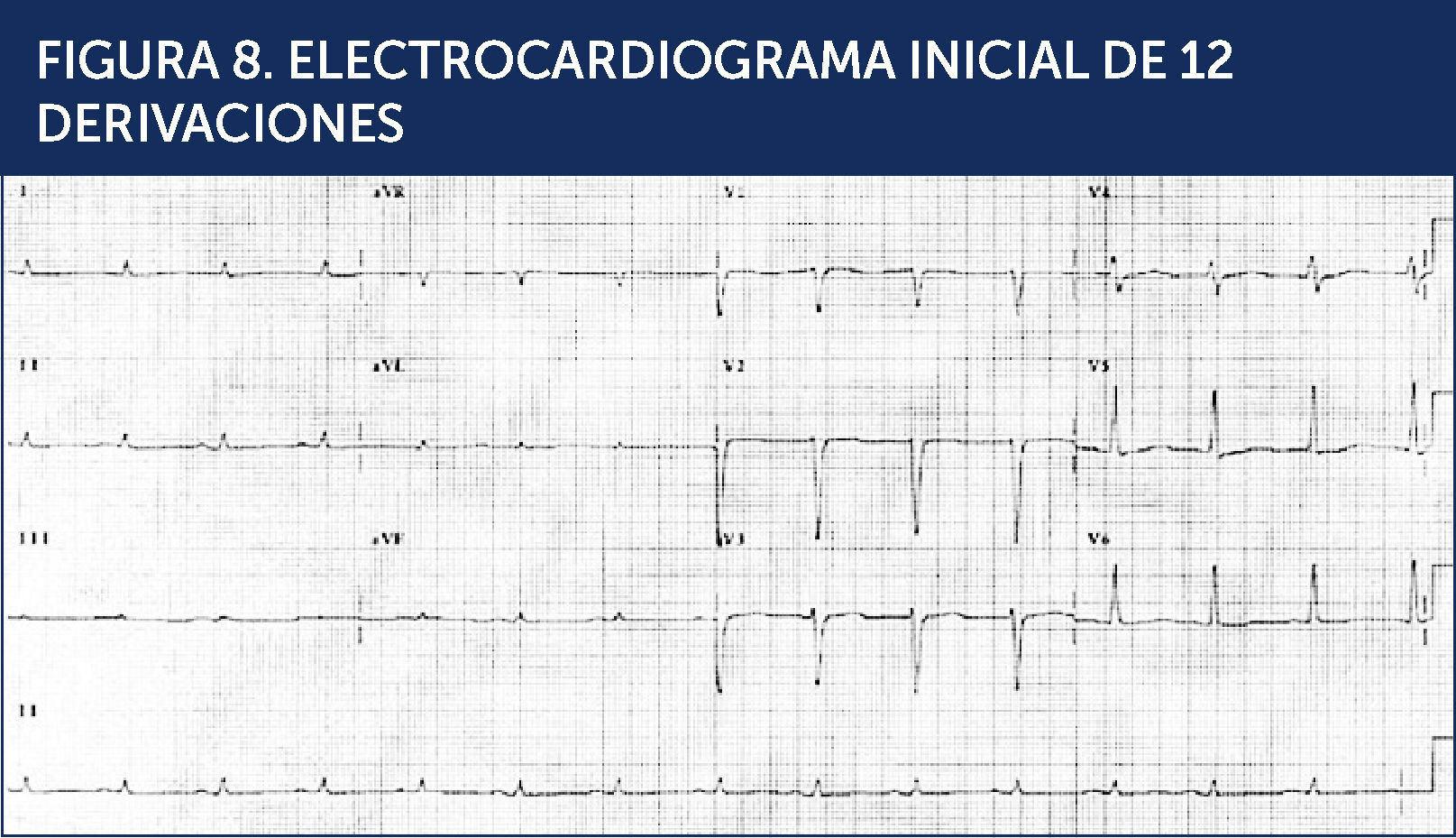
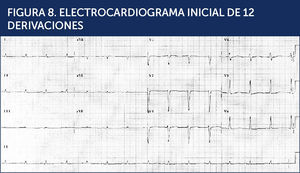
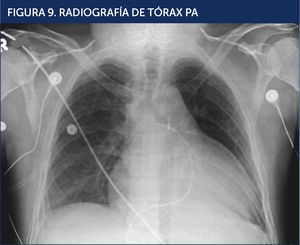
Se realizó un electrocardiograma (Figura 8) y una radiografía de tórax PA (Figura 9).
Se determina que el paciente se encuentra en shock cardiogèc)nico, con CK total de 1100 U/L, una CK-MB de 12 y troponina I indetectable lo que parecía excluir un síndrome coronario agudo en este punto de su evolución.
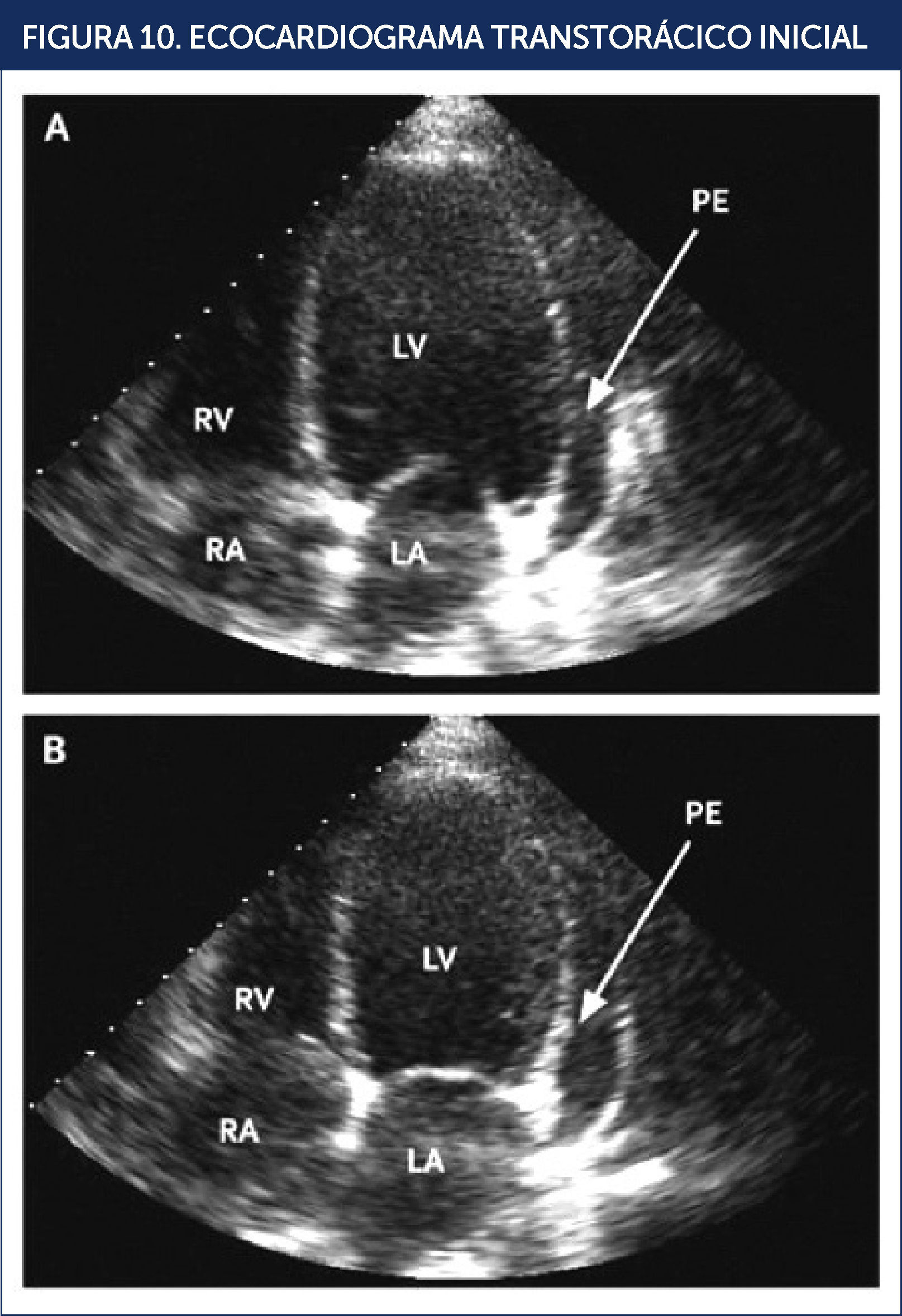
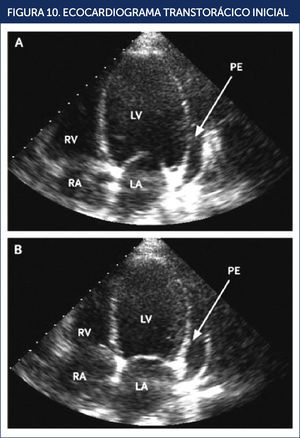
El ecocardiograma reveló un ventrículo izquierdo dilatado, con hipocinesia difusa, fracción de eyección (FE) entre 10 a 15% y se observó un derrame pericárdico moderado (Figura 10). Dada la presencia de una miocardiopatía dilatada de causa no precisada, se consideró apropiado descartar la presencia de una etiología isquèc)mica, motivo por el cual se procedió a efectuar una coronariografía la que mostró arterias coronarias normales.
ECOCARDIOGRAMA TRANSTORÁCICO INICIAL
Dilatación biventricular, función sistólica severamente disminuida con fracción de eyección estimada en 15% y derrame pericárdico moderado. Imagen apical de cuatro cámaras que muestra en diástole (A) y en sístole (B). LA: aurícula izquierda; LV: ventrículo izquierdo; PE: derrame pericárdico; RA: aurícula derecha; RV: ventrículo derecho. REF.21.
Debido a que el enfermo se encontraba en shock cardiogèc)nico, se inició terapia con dobutamina y dopamina, y se insertó un balón de contrapulsación intra-aórtico (BCIA). El paciente presentó taquicardias ventriculares, por lo que se le prescribió amiodarona; aun así, requirió cardioversión elèc)ctrica externa en múltiples ocasiones.
En busca de la etiología se realizaron adicionales exámenes de laboratorio para HIV, Lyme, virus de las hepatitis, Epstein Barr, Citomegalovirus, Coxsackie, electroforesis e inmunofijación, anticuerpos contra antígenos nucleares extraíbles (ENA), siendo todos ellos negativos.
Para completar el estudio se solicitan nuevas mediciones de hormonas tiroideas que evidencian en esta ocasión una TSH disminuida (0,21 mIU/L), T4 libre baja y T3 indetectable. Debido a estos hallazgos se plantea un hipotiroidismo 2° o 3° por destrucción de la hipófisis y/o del hipotálamo debido, en este caso, a trauma.
Se procedió a la exploración de los otros ejes endocrinos: suprarrenal, gonadal, somatotropo (con medición del insulin like growth factor-I) resultando todos ellos con hallazgos anormales.
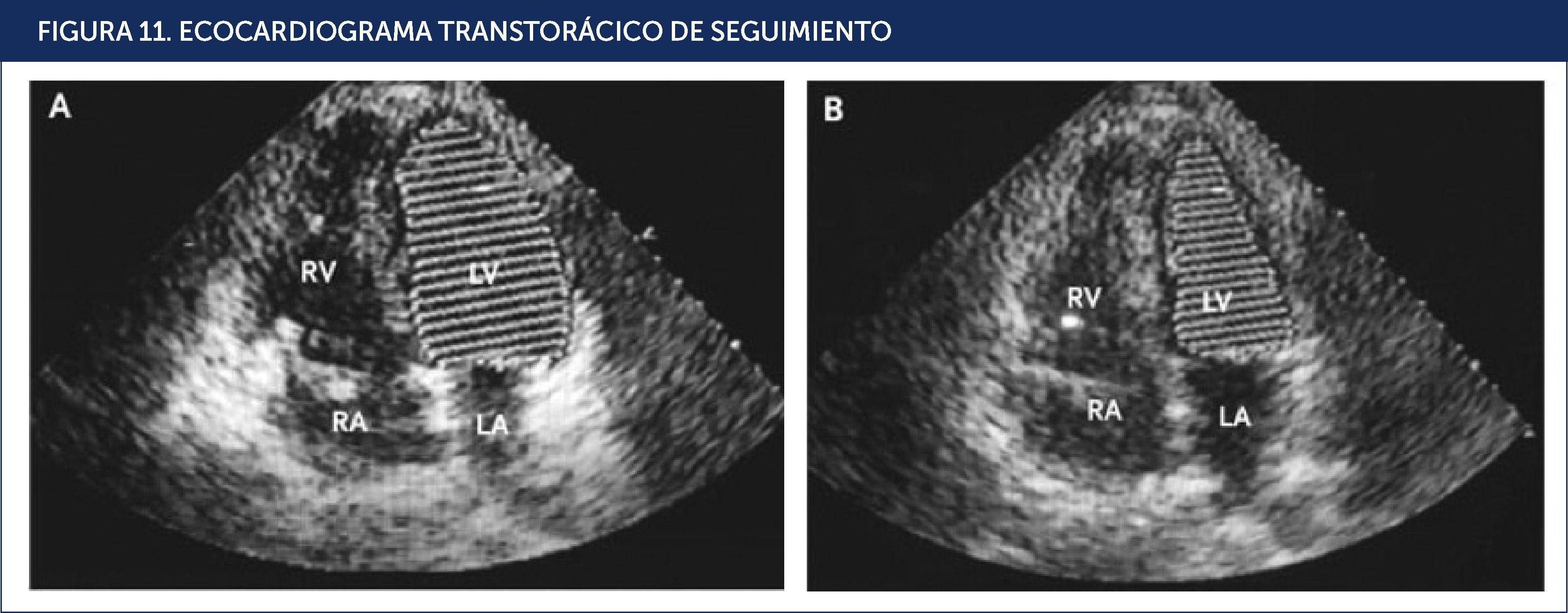
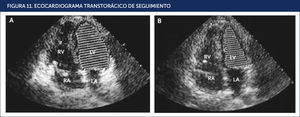
Se solicitó entonces una resonancia magnèc)tica cuyas imágenes evidenciaron una silla turca parcialmente vacía. El paciente se trató con hidrocortisona, L-tiroxina y testosterona. A las dos semanas se logró retirar el BCIA y los fármacos vasoactivos. Al cabo de nueve meses se le controló, ya asintomático, con perfil de lípidos y CK total que resultaron normales, ventrículo izquierdo con FE solo ligeramente disminuida (52%), Holter de ritmo normal. A los 20 meses en el ecocardiograma de control ya presentaba una FE de 64%, es decir, completamente normalizada (Figura 11).
ECOCARDIOGRAMA TRANSTORÁCICO DE SEGUIMIENTO
Marcada mejoría de la función sistólica con fracción de eyección estimada de 64% y regresión de la dilatación biventricular. Imagen apical de cuatro cámaras que muestra en diástole (A) y en sístole (B). LA: aurícula izquierda; LV: ventrículo izquierdo; RA: aurícula derecha; RV: ventrículo derecho. REF21.
Despuèc)sdeanalizarestecasovemoscuánimportantees, cuando se enfrenta a un paciente con una afección cardíaca, considerar la posibilidad de una disfunción tiroidea. Destaca, asimismo, la reversibilidad potencial de cardiopatías graves con la simple terapia de sustitución endocrinológica apropiada.
Al inicio, en casos de hipotiroidismo secundario o terciario, es decir, de origen hipofisiario o hipotalámico, la TSH puede ser normal confundiendo al clínico y conducièc)ndolo a descartar esta asociación patológica; sin embargo, es importante tener en cuenta la miopatía esquelèc)tica sumada al compromiso miocárdico para seguir sospechándola.
Este caso clínico, como tambièc)n otros aspectos expuestos en este artículo, subrayan la importancia de la anamnesis y de que “en ocasiones el instrumento más importante de la Medicina es la silla que permite recoger una historia tranquila” (Gregorio Marañón).
Los autores declaran no tener conflictos de interés, en relación a este artículo.