Las imágenes médicas han representado un importante avance en el estudio de las enfermedades del sistema nervio cerebral. Sin embargo existe un importante grupo de enfermedades que se caracterizan por la ausencia o una muy leve alteración de la estructura cerebral que son muy difíciles de detectar utilizando imágenes convencionales, como las enfermedades psiquiátricas, algunos tipos de epilepsia y las alteraciones del sueño.
Las alteraciones de la estructura se pueden estudiar más detalladamente utilizando imágenes de resonancia magnética volumétricas que permiten la cuantificación del volumen de las distintas estructuras cerebrales. Es posible estudiar el cerebro desde el punto de vista metabólico mediante espectroscopia, que cuantifica diversos metabolitos cerebrales normales y anormales.
Las técnicas de resonancia magnética funcional corresponden a pruebas similares a los test clínicos pero realizados al interior del resonador que permiten una evaluación de las áreas funcionales cerebrales. El PET-CT que utiliza principalmente glucosa radiactiva (18 FDG) para visualizar el metabolismo cerebral. Este artículo revisa los principales hallazgos demostrados mediante imágenes estructurales y funcionales en los pacientes con Síndrome de Apnea Obstructiva del Sueño (SAOS), Narcolepsia e Insomnio idiopático.
Medical Images have represented an important advance in the study of central nervous system diseases. Nevertheless there is an important group of illness that is characterized for absence or a subtle alteration of cerebral structures that are difficult to detect utilizing conventional images, as psychiatric diseases, some types of epilepsy and sleep disorders. Structural alterations can be studied, in more detail, utilizing volumetric magnetic resonance imaging that permit the quantification of volume of different cerebral structures. It is possible to study the brain from the metabolic point of view using spectroscopy that quantifies diverse normal and abnormal brain metabolites. The technique of functional magnetic resonance corresponds to a clinical test inside MRI scanner that allows the evaluation of cerebral functional areas. PET-CT utilizes radioactive glucose (18 FDG) to visualize the cerebral metabolism. This article revises the main findings utilizing functional and structural imaging in the patients with Obstructive Sleep Apnea Syndrome, Narcolepsy and Idiopathic Insomnia.
Las imágenes médicas han representado un importante avance en el estudio de las enfermedades del sistema nervio cerebral, especialmente desde la introducción de la tomografía computada y más aún desde la llegada de la resonancia magnética. Sin embargo existe un importante grupo de enfermedades que se caracterizan por la ausencia o una muy leve alteración de la estructura cerebral que son muy difíciles de detectar utilizando imágenes convencionales, como es el caso de las enfermedades psiquiátricas, algunos tipos de epilepsia y las alteraciones del sueño.
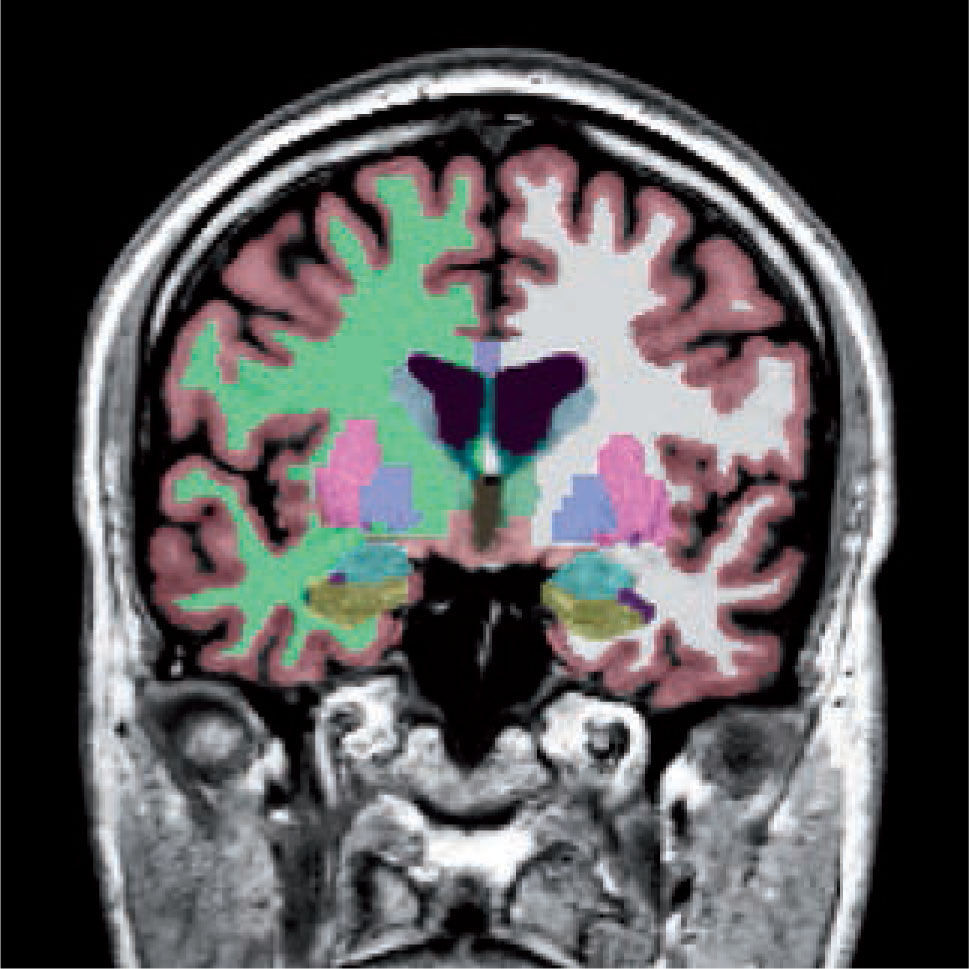
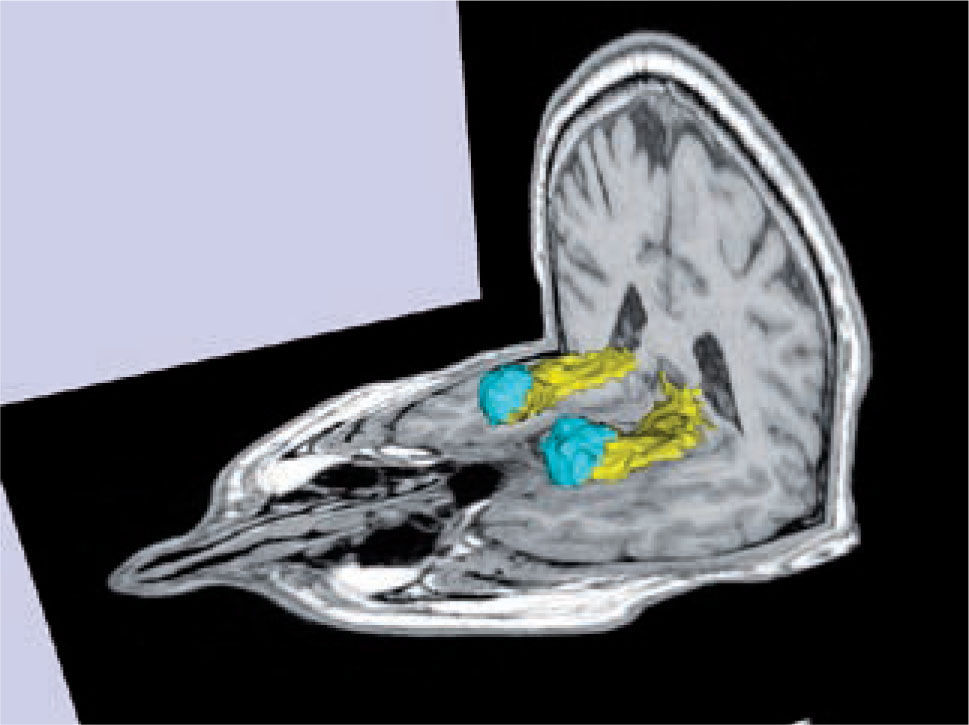
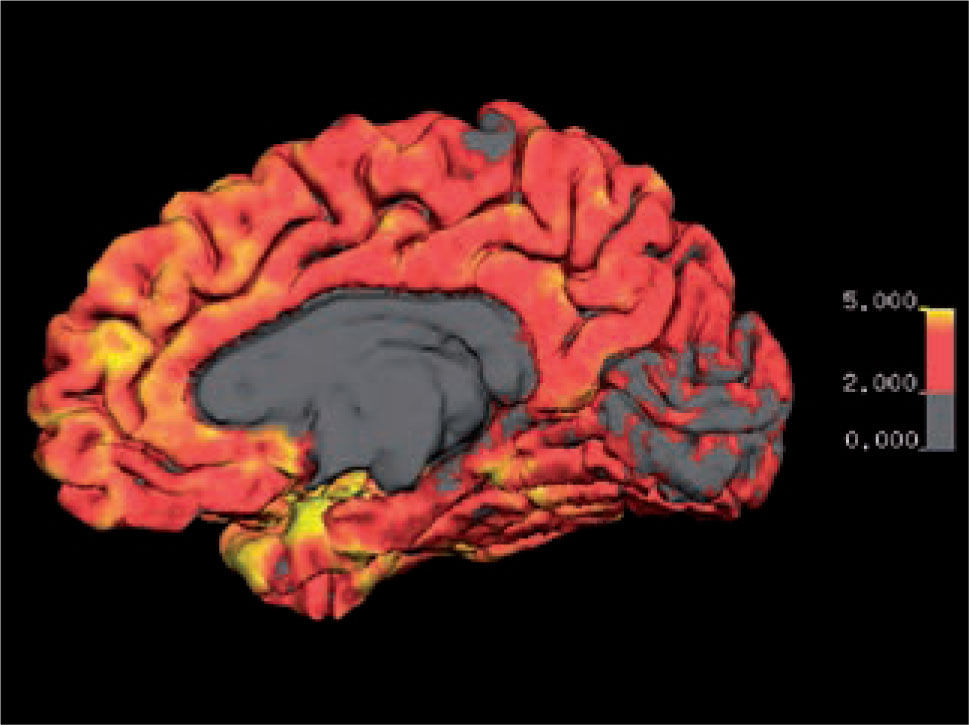
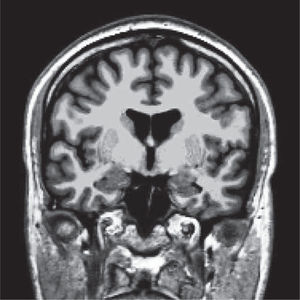
Las alteraciones de la estructura se pueden estudiar más detalladamente utilizando imágenes de resonancia magnética que cubren cada milímetro del cerebro (volumétricas) (Figura 1), desde las cuales es posible separar artificialmente mediante software, las distintas estructuras del cerebro (segmentación) (Figura 2) y poder comparar el tamaño de estas estructuras con una población de sujetos normales de la misma edad. Actualmente es posible obtener volúmenes de cada una de las estructuras como hipocampos, ganglios basales, cerebelo, etc. de nuestro paciente (Figura 3). Además, utilizando esta misma información es posible realizar imágenes tridimensionales del espesor de la corteza cerebral en cada hemisferio (Figura 4).
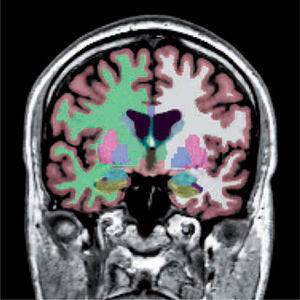
Segmentación de las distintas estructuras cerebrales de un sujeto normal. Corteza (rojizo), sustancia blanca (derecha: verde, izquierda: blanca), ganglios basales, hipocampos (verde) y amígdalas (celeste).
Software Freesurfer (http://ftp.nmr.mgh.harvard.edu/).
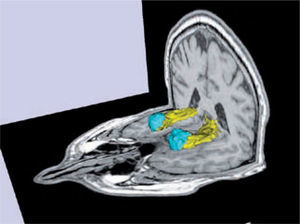
Volumetría y segmentación de los hipocampos (amarillo) y las amígdalas (celeste) de un sujeto normal.
Software Freesurfer (http://ftp.nmr.mgh.harvard.edu/).
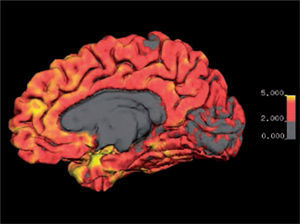
Imagen de espesor cortical de la cara medial del hemisferio derecho. Se visualiza espesor cortical mediante codificación por color entre los 0 y 5 mm. El espesor normal se encuentra entre los 2 y 5 mm., excepto en los lóbulos occipitales mediales en que el espesor puede ser menor a 2 mm.
Software Freesurfer (http://ftp.nmr.mgh.harvard.edu/).
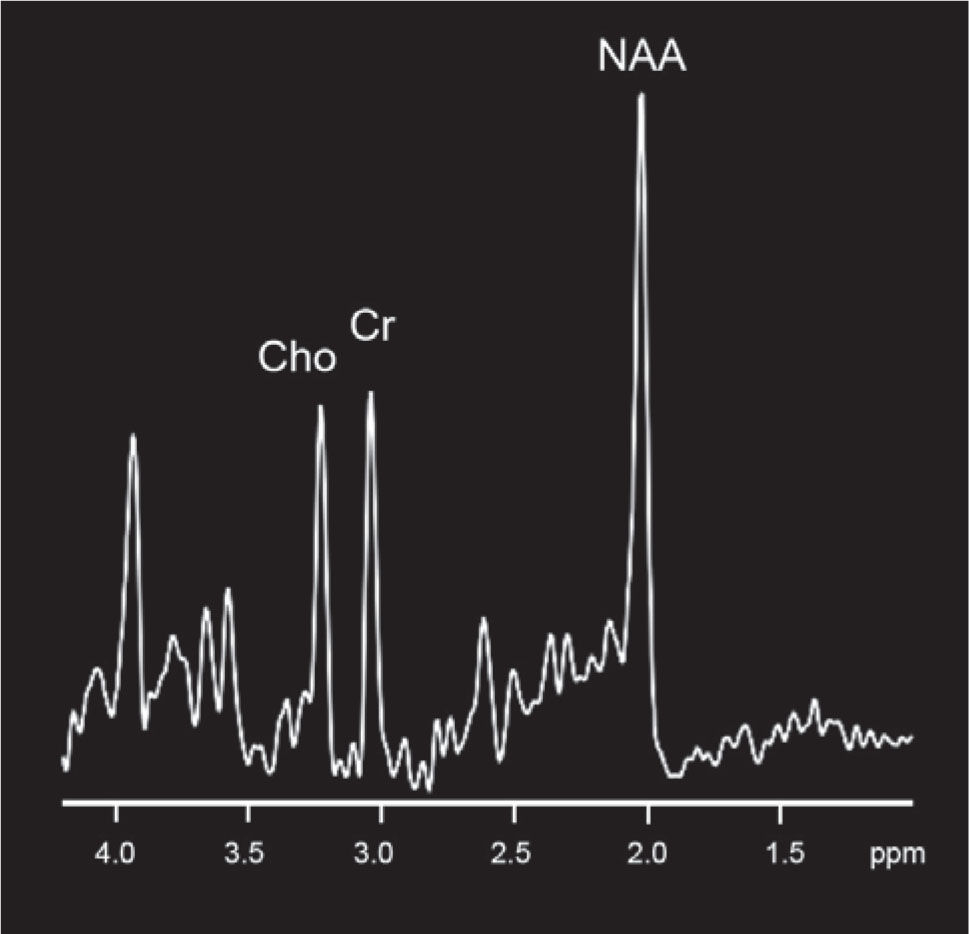
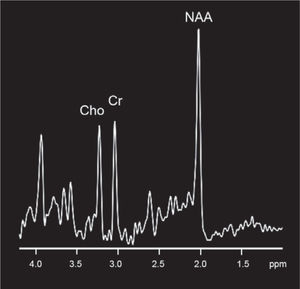
También es posible estudiar el parénquima cerebral desde el punto de vista metabólico mediante espectroscopia, que es una técnica que permite cuantificar los metabolitos cerebrales normales y anormales, así como las distintas relaciones que existen entre ellos. Los metabolitos estudiados son el N-acetil aspartato (NAA) que es un marcador de replicación neuronal, Colina (Cho) que corresponde a un marcador de sustancia blanca y la Creatina (Cr), el cual es un componente del metabolismo basal y permite comparar distintas áreas dentro del paciente y distintos pacientes (Figura 5).
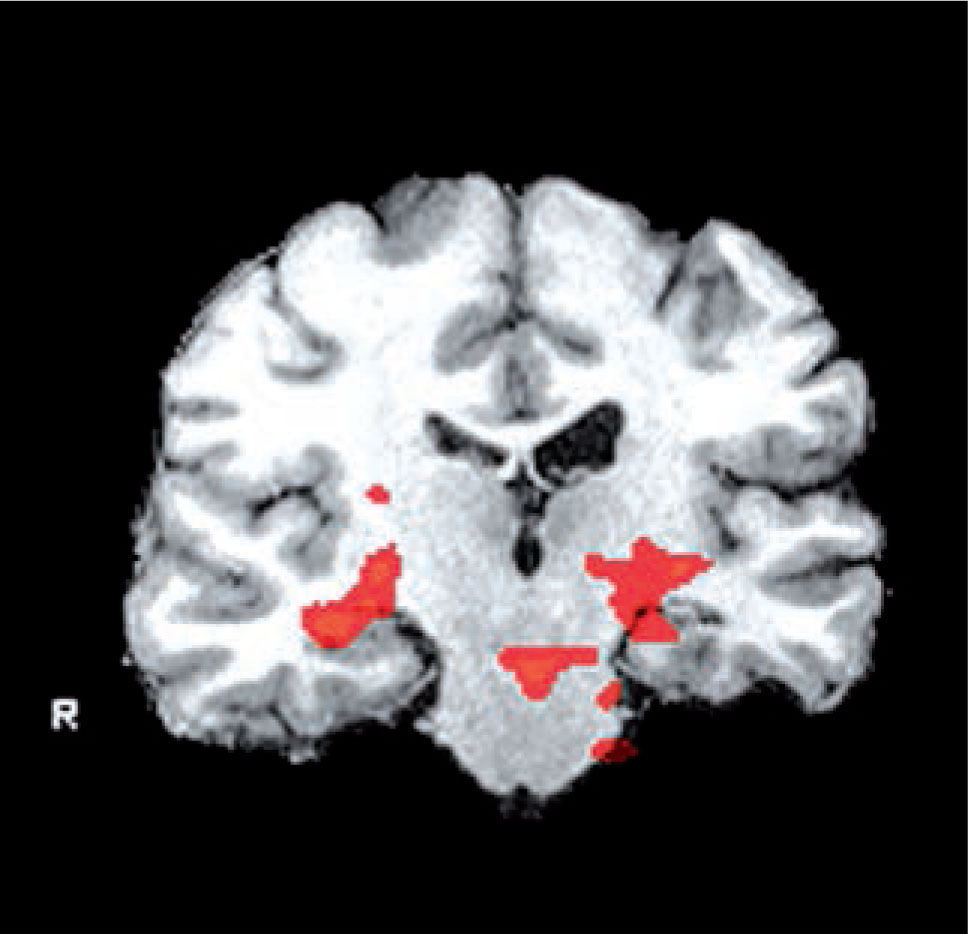
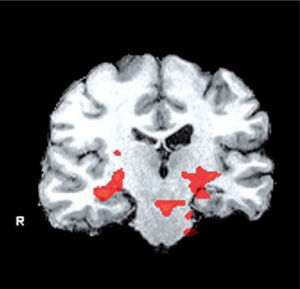
Por último, se han desarrollado técnicas de resonancia magnética funcional (fMRI) que corresponden a pruebas similares a los test clínicos pero realizados al interior del resonador que permiten una evaluación de las áreas funcionales, especialmente en relación a la memoria y funciones cognitivas muy útiles en los pacientes con alteraciones del sueño (Figura 6).
Sin duda otra de las imágenes que han aportado significativamente al conocimiento de las alteraciones del sueño corresponde a la tomografía por emisión de positrones (PET) que actualmente se encuentra acoplada a la tomografía computada (CT) en un examen conocido como PET-CT, que utiliza principalmente glucosa radiactiva (18 FDG) para visualizar el metabolismo cerebral.
Sin duda estas nuevas imágenes han permitido una mejor aproximación a la fisiopatología de las alteraciones del sueño.
Este artículo revisa los principales hallazgos mostrados mediante imágenes estructurales y funcionales de los pacientes con Síndrome de Apnea Obstructiva del Sueño (SAOS), narcolepsia e insomnio idiopático.
Apnea obstructiva del sueño (SAOS)El SAOS se caracteriza por episodios repetidos de obstrucción de la vía aérea que se presentan durante el sueño asociados a una reducción de la oxigenación de la sangre. Estos episodios producen periodos cortos de despertar que resultan en una fragmentación y una considerable alteración de la estructura del sueño. Esta condición se caracteriza por ausencia de sueño REM y de las etapas 3 y 4 del sueño No-REM.
El síntoma más común corresponde a la somnolencia durante el día producido principalmente por la alteración del sueño y la hipoxemia. Son frecuentes además las alteraciones de la atención, las alteraciones cognitivas y problemas interpersonales. El SAOS se asocia a hipertensión arterial, enfermedades cardiovasculares y stroke.
Su fisiopatología es compleja, pero posiblemente el SAOS corresponde a una mezcla de obstrucción de la vía aérea, alteración del tono muscular y una respuesta anormalmente exagerada a los episodios de hipoxia.
Las alteraciones neuropsicológicas del SAOS son atribuidas a alteraciones funcionales en las cortezas prefrontal, giro cingulado anterior, hipocampos y lóbulos parietales.
Las alteraciones estructurales del SAOS son en general sutiles por lo que requieren de estudios volumétricos que cuantifican el tamaño de las estructuras vóxel por vóxel. Se han realizado numerosos estudios utilizando esta técnica cuyos resultados han sido algo disimiles.
Se ha mostrado una pérdida del volumen de la sustancia gris en los pacientes con SAOS en múltiples áreas relacionadas con las funciones cognitivas y la regulación motora de la vía aérea, como en la corteza frontal, temporal parietal, circunvolución cingulada anterior, hipocampo y cerebelo (1). Sin embargo hay otros estudios que no muestran alteraciones del volumen de la sustancia gris en este tipo de pacientes (2). Existe una relación entre el volumen del hipocampo y las pruebas clínicas de memoria, por lo que el hallazgo radiológico más aceptado es la disminución de volumen de los hipocampos que traduciría una alteración estructural, posiblemente irreversible, sin embargo esta posible irreversibilidad es todavía discutida.
Las imágenes espectroscópicas han mostrado una disminución de los índices NAA/Creatina y Colina/Creatina que representan alteraciones metabólicas de las neuronas y de la sustancia blanca respectivamente, especialmente en las cortezas prefrontal y parieto occipital, así también como en la sustancia blanca periventricular frontal (3).
Las imágenes de funciones cognitivas utilizando pruebas de memoria verbal han mostrado disminución de la actividad de la corteza prefrontal dorso lateral en los pacientes con SAOS en comparación a sujetos normales (4).
Además las pruebas de resonancia magnética funcional han mostrado una respuesta cerebral anormal al estrés respiratorio y cardiovascular especialmente a nivel del cerebelo, ínsula, cingulado y cortezas motoras (5). El desempeño cognitivo puede mejorar significativamente con el uso del CPAP, pero la evidencia ha reportado que algunas alteraciones cognitivas pueden ser permanentes.
NarcolepsiaLa narcolepsia es un desorden del sueño caracterizado por sueño aumentado durante el día, pérdida súbita del tono muscular (cataplexia), parálisis del sueño y alucinaciones hipnagógicas. Ha sido asociada a la pérdida de neuronas productoras de hipocretina un neuropéptido del hipotálamo implicado en el despertar.
Las alteraciones estructurales no pueden ser identificadas mediante la simple visualización de imágenes convencionales, se requiere de estudios volumétricos, los cuales no han sido concluyentes en el diagnóstico de narcolepsia. Esto posiblemente se debe a que las alteraciones son microscópicas y no necesariamente en la escala de las imágenes radiológicas.
Teóricamente las alteraciones estructurales de la narcolepsia se pueden encontrar en el tegmento protuberancial, debido a que ésta es el área que controla las transiciones entre los estados del sueño. Sin embargo la protuberancia generalmente presenta alteraciones de la intensidad de señal por cambios microangiopáticos secundarios a la edad, por lo que dichas alteraciones no son fáciles de interpretar (6).
Los estudios cuantitativos de sustancia gris y sustancia blanca han reportado disminución del volumen de la sustancia gris cortical en las regiones frontales y temporales inferiores (7, 8). La pérdida de la sustancia gris es independiente de la duración de la enfermedad y del tratamiento farmacológico.
Se ha mostrado también disminución del volumen del hipotálamo, cerebelo, giro temporal superior y núcleo acumbens derecho en pacientes con narcolepsia comparados con los sujetos normales (9). La disminución del tamaño del núcleo acumbens y de la corteza temporal puede reflejar alteración de las conexiones del hipotálamo.
Aunque la narcolepsia ha sido asociada a una disfunción hipotalámica, no todos los estudios evidencian una clara anormalidad en el hipotálamo a partir de las imágenes estructurales.
Se han reportado algunas alteraciones espectroscópicas en los pacientes con narcolepsia, como la reducción de la relación NAA/Creatina en el hipotálamo sugerentes de pérdida neuronal (10). Sin embargo se requiere un mayor número de pacientes para tener resultados más definitivos.
Se ha estudiado además la activación visual y auditiva en pacientes narcolépticos usando fMRI, sin que sea posible demostrar diferencias significativas de activación cortical en comparación a sujetos normales (11).
Las imágenes con PET 18 FDG han mostrado que los pacientes con narcolepsia tienen metabolismo reducido de la glucosa en el precuneo, hipotálamo posterior y núcleos talámicos mediodorsales (12).
Las imágenes funcionales de resonancia funcional en reposo que permiten evaluar los circuitos neuronales son muy promisorias en el estudio de este tipo de patologías.
Insomnio idiopáticoEl insomnio idiopático está caracterizado por dificultad en iniciar o mantener el sueño y por un sueño no restaurador que causa estrés, alteraciones sociales, ocupacionales y en otras áreas importantes del individuo.
El insomnio se presenta con síntomas subjetivos y se puede originar de una disfunción regulatoria del ciclo sueno vigilia, por comorbilidades, alteraciones psiquiátricas o neurológicas. Es una enfermedad de la noche pero que afecta al individuo todo el día. Se estima que entre un 10 al 20% de la población tiene algún tipo de insomnio. La depresión es una de las enfermedades que más frecuentemente se asocia al insomnio.
El insomnio idiopático es una alteración del control neurológico de sistema sueno vigilia. Se cree que refleja un desbalance entre el despertar y los sistemas que promueven el sueño, el cuál es el resultado de una hiperactividad cortical global.
Además de la hiperactividad durante el sueño se ha observado un aumento del nivel de alerta, aumento de la tensión y ansiedad durante el día, asociado a la disminución del tiempo total de sueño. La falta de sueño puede tener importantes consecuencias durante el día, tales como la alteración del ánimo y de la motivación, disminución de la atención y pobre concentración, así como cansancio crónico. Adicionalmente el insomnio aumenta el riesgo de depresión mayor.
Aún no se han demostrado alteraciones estructurales significativas en este grupo de pacientes.
Usando PET (18 FDG) se ha observado un aumento global del consumo de glucosa durante la transición entre la vigilia y el sueño, comparado con los controles normales, sugiriendo que existe un estado crónico de sobre alerta en los pacientes con insomnio (13).
En contraste, durante la vigilia se encuentra una disminución del metabolismo en las áreas subcorticales (tálamo, hipotálamo y formación reticular del tronco cerebral), así como también las regiones corticales prefrontales, temporal superior izquierdo y cortezas occipitales, sugiriendo que el insomnio se asocia además a un metabolismo cerebral reducido durante el día. El compromiso de la corteza frontal produce una reducción de las habilidades atencionales y compromiso de la cognición. Existe una clara asociación entre la depresión y el insomnio. De hecho la depresión es el diagnóstico primario más frecuente en los pacientes con insomnio. Los pacientes presentan fatiga durante el día y tienden a compensarlo con una siesta.
Se ha observado que los pacientes con insomnio y depresión muestran una significativa reducción relativa del consumo de glucosa medida con PET durante el sueño no REM a nivel de la corteza medial órbito frontal, cingulada anterior, así como en los núcleos caudado y tálamo medial. Presentan además un mayor consumo de glucosa a nivel de la protuberancia, giro cinglado posterior, amígdala, hipocampo y cortezas témporo-occipitales.
Estos hallazgos sugieren que la depresión afecta las redes del sistema límbico y corteza de las regiones posteriores, pero también presentan una disminución del metabolismo frontal medial y del cuerpo estriado que son característicos de la depresión (14).
ConclusionesLas alteraciones del sueño son patologías que tienen poca representación en las imágenes convencionales.
Se requiere de estudios volumétricos cuantitativos para demostrar alteraciones sutiles del volumen de las distintas estructuras relacionadas con el sueño, en comparación con sujetos normales.
Las neuroimágenes funcionales han aumentado la posibilidad de explorar funciones cerebrales durante el sueño normal y patológico.
Todavía existen muchas dificultades para el estudio por imágenes de estos pacientes, como es el costo de los estudios y los problemas técnicos como la dificultad de conciliar el sueño durante el examen, los movimientos involuntarios durante el sueño y que las alteraciones pueden ser transitorias requiriendo un mayor tiempo de estudio.
Además solo recientemente es posible realizar estudios de EEG al mismo tiempo que la adquisición de las imágenes de resonancia magnética. Sin duda estas técnicas requieren todavía de algunos años más para mejorar el diagnóstico de este tipo de patologías.
El autor declara no tener conflictos de interés, con relación a este artículo.