El glaucoma es la principal causa de ceguera no reversible en el mundo, afectando al 2% de la población. Actualmente se considera una neuropatía óptica, donde la presión intraocular juega un rol fundamental en la patogenia y las características del daño óptico producido. Con el tratamiento actual, se busca prevenir el daño en la estructura del nervio óptico, para preservar el campo visual, persiguiendo mantener la calidad de vida del paciente. Existen nuevos métodos imaginológicos que junto al examen clínico y campo visual, predicen daño y avance de enfermedad. Se incluyen en la comprensión de la patología la apoptosis y el concepto de neuroprotección. Nuevos fármacos buscan mantener una adecuada reducción en la presión intraocular sin fluctuaciones, evitando efectos adversos y mejorando la adherencia al tratamiento. Nuevas herramientas terapéuticas como la trabeculoplastía selectiva láser y nuevas cirugías como el implante de tubos de drenaje, aumentan las posibilidades de evitar la ceguera por glaucoma.
Glaucoma is the main non-reversible blindness cause worldwide, affecting 2% of the population. Nowadays, it is considered an optic neuropathy, and the intraocular pressure doing a fundamental role in its physiopathology and optic disc damage features. Actual treatment seeks to prevent the damage of the optic nerve structure, in order to prevent the visual field to keep the quality of life. New imaging methods exist to predict onset and continuing damaging in the optic head, beside clinical examination and visual fields. It has been included in the comprehension of the glaucomatous pathology, the concept of apoptosis and neuroprotection. New drugs are searching to maintain an adequate intraocular pressure reduction, without fluctuations, avoiding side effects and improving the treatment adherence. New therapeutic tools, such as selective laser trabeculoplasty, and new surgeries like tubes or valves, have increased the odds of avoiding blindness due to glaucoma.
En los últimos años se ha producido un notable cambio en la comprensión, estudio, diagnóstico y tratamiento del glaucoma, enfermedad que afecta según diferentes estudios a un 2% de la población. Por mucho tiempo se definió glaucoma como una enfermedad asociada a un aumento de presión intraocular, la cual no es compatible con la adecuada función visual y con la estabilidad anatómica del ojo.
La Academia Americana de Oftalmología ha definido glaucoma como una neuropatía óptica que se presenta con un daño estructural característico, asociada con la muerte progresiva de células ganglionares retinianas, pérdida de fibras nerviosas y pérdida de campo visual patognomónico. El rol de una presión intraocular (PIO) sobre los 21mmHg como factor de riesgo, ha sido minimizada, debido a que se ha determinado que alrededor de un tercio de los pacientes pueden tener daño glaucomatoso con presión intraocular normal y además, que luego de la cirugía de glaucoma, a pesar de controlar la PIO, puede persistir la pérdida progresiva de campo visual.
Está estudiado que el daño relacionado con la PIO puede ocurrir en todos los niveles de presión intraocular, y se estima que al menos un 50% de los pacientes con glaucoma no se diagnostican (1–4). A pesar de esto, se establece una relación clara entre la presión intraocular y la prevalencia de glaucoma según importantes estudios masivos como el de Baltimore Eye Survey, considerándose 21 mm de Hg como punto de corte.
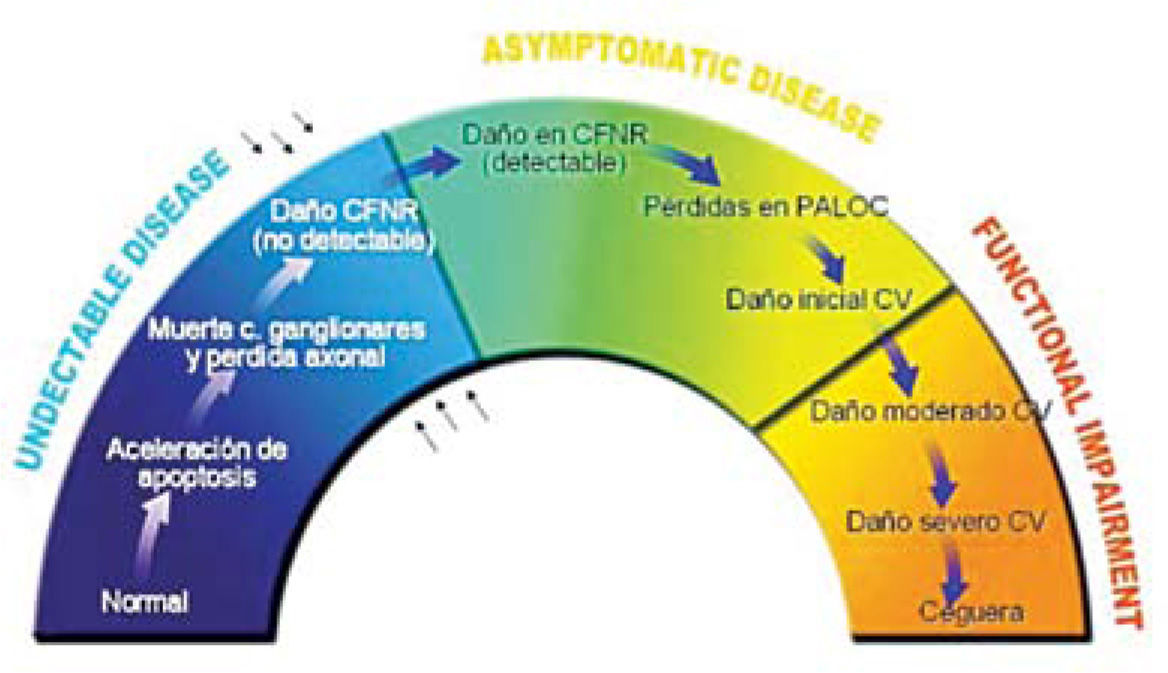
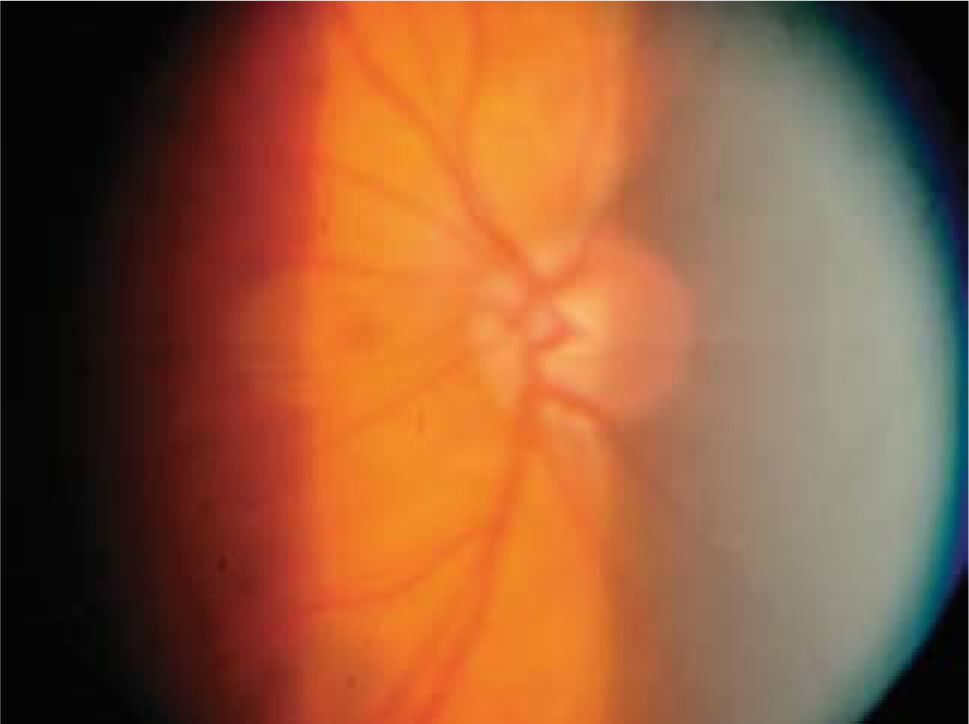
Actualmente la meta en el tratamiento del glaucoma es conservar la función visual del paciente a largo plazo y buscar aquella alternativa que sea la más eficaz. Dicho de otra forma, prevenir la pérdida adicional del campo visual, mantener la estructura y función del nervio óptico (medibles por métodos de imágenes), y mantener la calidad de vida del paciente (Figuras 1 y 2).
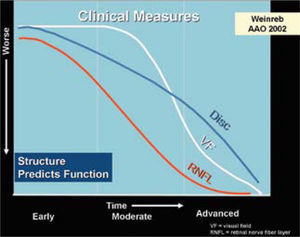
Este esquema muestra el proceso de evolución del glaucoma, se establece con claridad que deberíamos comenzar a tratar los pacientes durante la fase de conversión de enfermedad antes de la aparición de lesiones irreversibles.
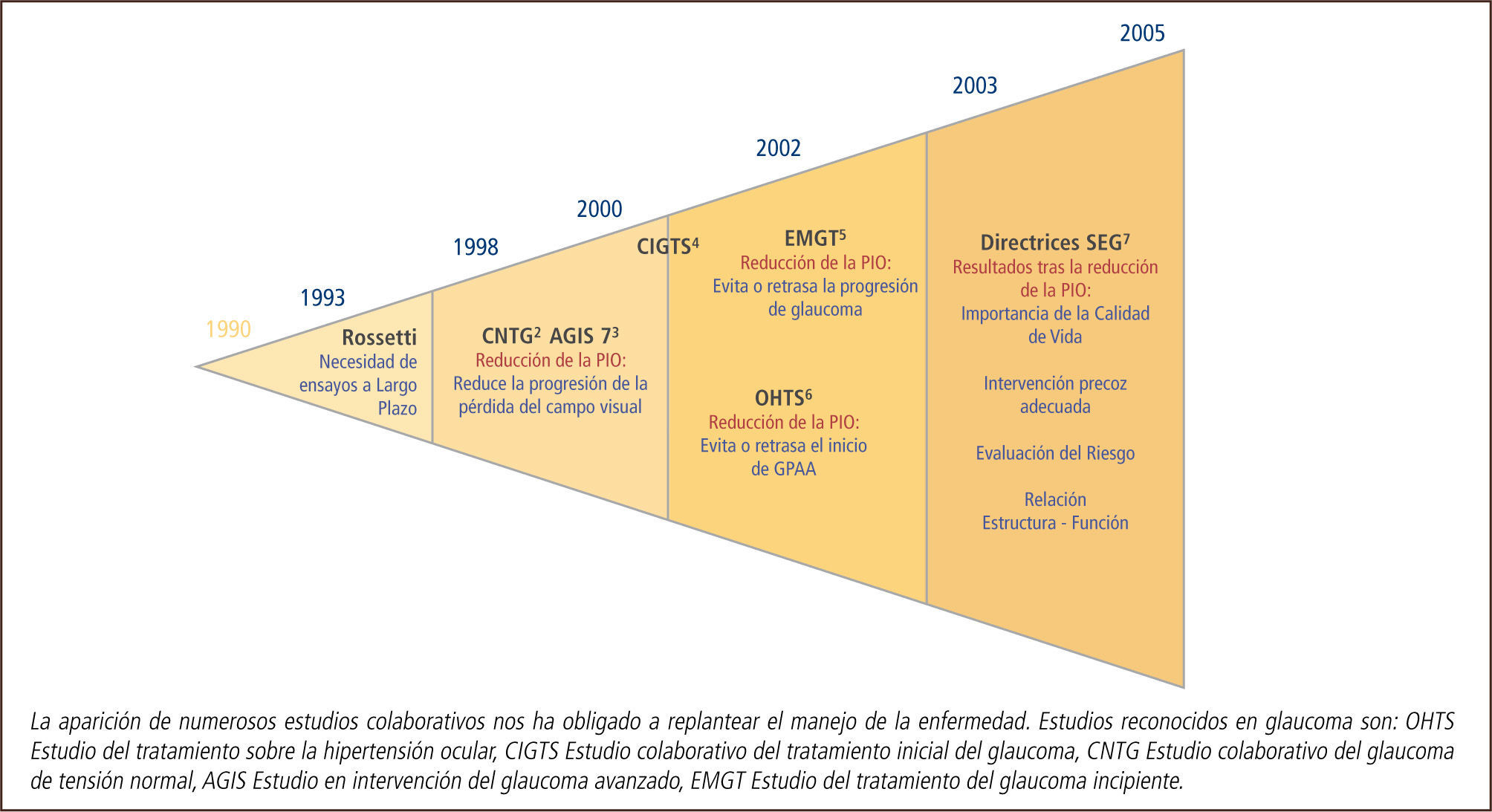
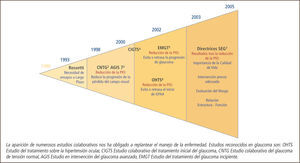
La aparición de numerosos estudios colaborativos nos ha obligado a replantear el manejo de la enfermedad. Estudios reconocidos en glaucoma son: OHTS Estudio del tratamiento sobre la hipertensión ocular, CIGTS Estudio colaborativo del tratamiento inicial del glaucoma, CNTG Estudio colaborativo del glaucoma de tensión normal, AGIS Estudio en intervención del glaucoma avanzado, EMGT Estudio del tratamiento del glaucoma incipiente.
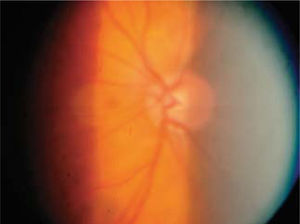
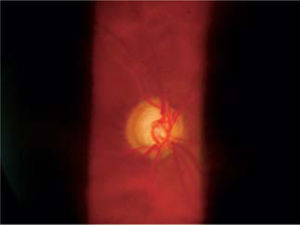
Si bien es cierto, la mejor forma de diagnóstico sigue siendo la oftalmoscopía directa y la indirecta con lámpara de hendidura con lupa de 90 dioptrías, nueva tecnología diagnóstica está actualmente disponible para visualizar con mayor precisión y documentar los cambios en el disco óptico a través del tiempo, incluso leves, tomando en cuenta el reborde de nervio, color, área de excavación y estado del anillo neuroretiniano.
1. Documentación fotográficaA. Fotografía estereoscópica. Permite documentar cambios del avance o no de enfermedad del paciente.
2. Análisis de imágenes computarizadas- A.
Tomografía de Coherencia Óptica (OCT)
- B.
Láser confocal de barrido (CSLT) (HRT y HRTII)
- C.
Exploración por Polarimetría Láser (SLP) (GDX)
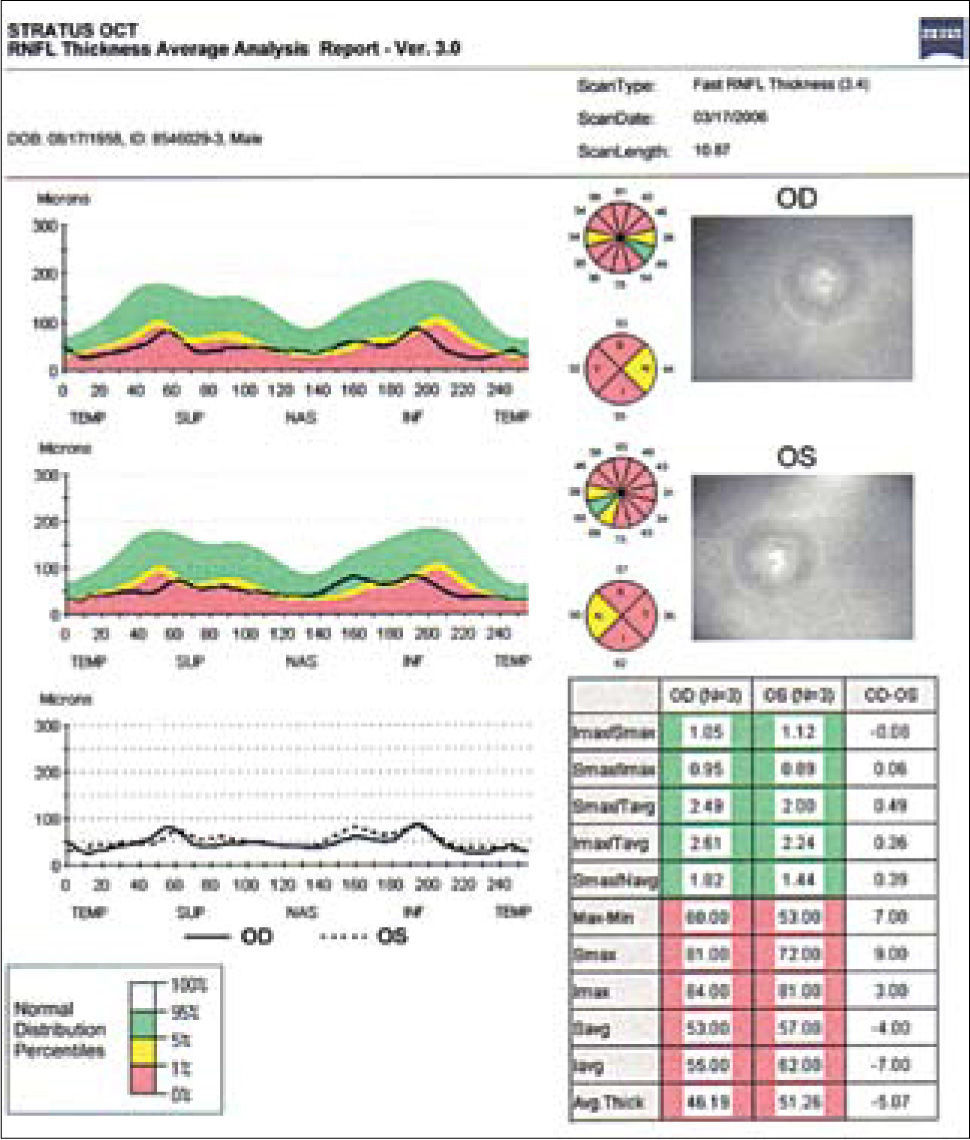
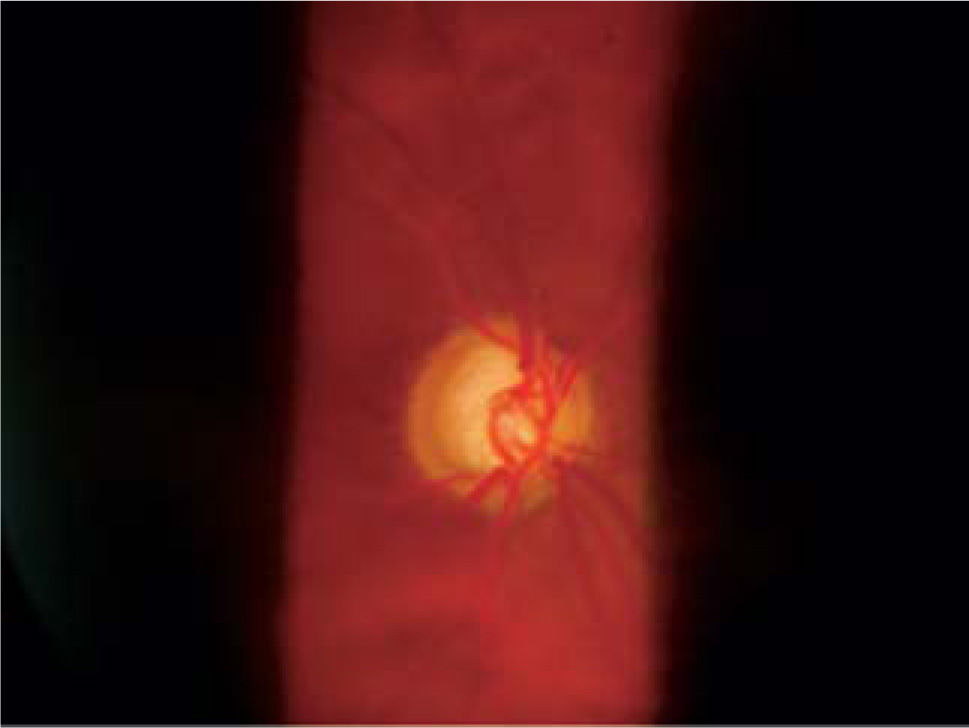
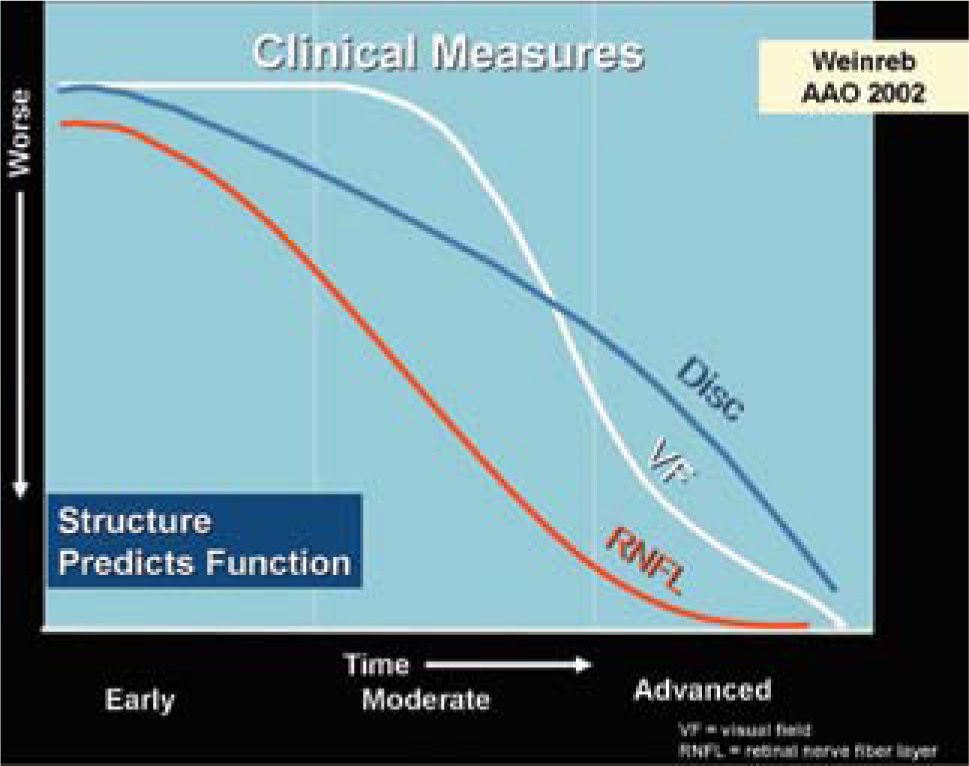
Estas modalidades son útiles para evaluar cuantitativamente la capa de fibras nerviosas retinianas (CFNR) y además los cambios en el disco en los casos sospechosos de glaucoma. Está comprobado que la capa de fibras nerviosas retinianas en el glaucoma, se adelgazan mucho antes que dichos cambios sean detectados en un campo visual (5–8). El HRT (Heidelberg Retinal Tomograph) y HRTII, consiste en un sistema de barrido de láser confocal para la toma y análisis de imágenes en tres dimensiones del nervio óptico. Algunos estudios muestran que el HRT tiene la mayor precisión diagnóstica y reproducibilidad por sobre otros (9), sin embargo otros estudios no demuestran diferencia alguna al respecto al comparar las tres tecnologías disponibles (OCT, HRT y GDX) (10) (Figuras 3 y 4).
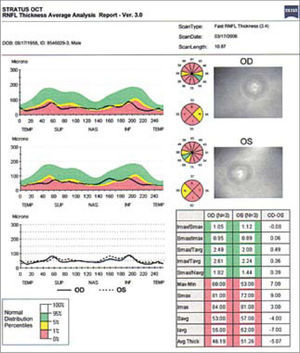
En un OCT se mide la capa de fibras nerviosas (RNFL), estableciendo primero la relación de la capa de fibras del paciente con la curva normal de grosor según sector papilar (I, inferior; S, superior; N, nasal; T, temporal). Cuando esta curva cae por debajo del 1% de la población normal, se considera patológico (zona roja), bajo el 5% es considerado sospechoso (zona amarilla), y sobre 5% normal (zona verde).
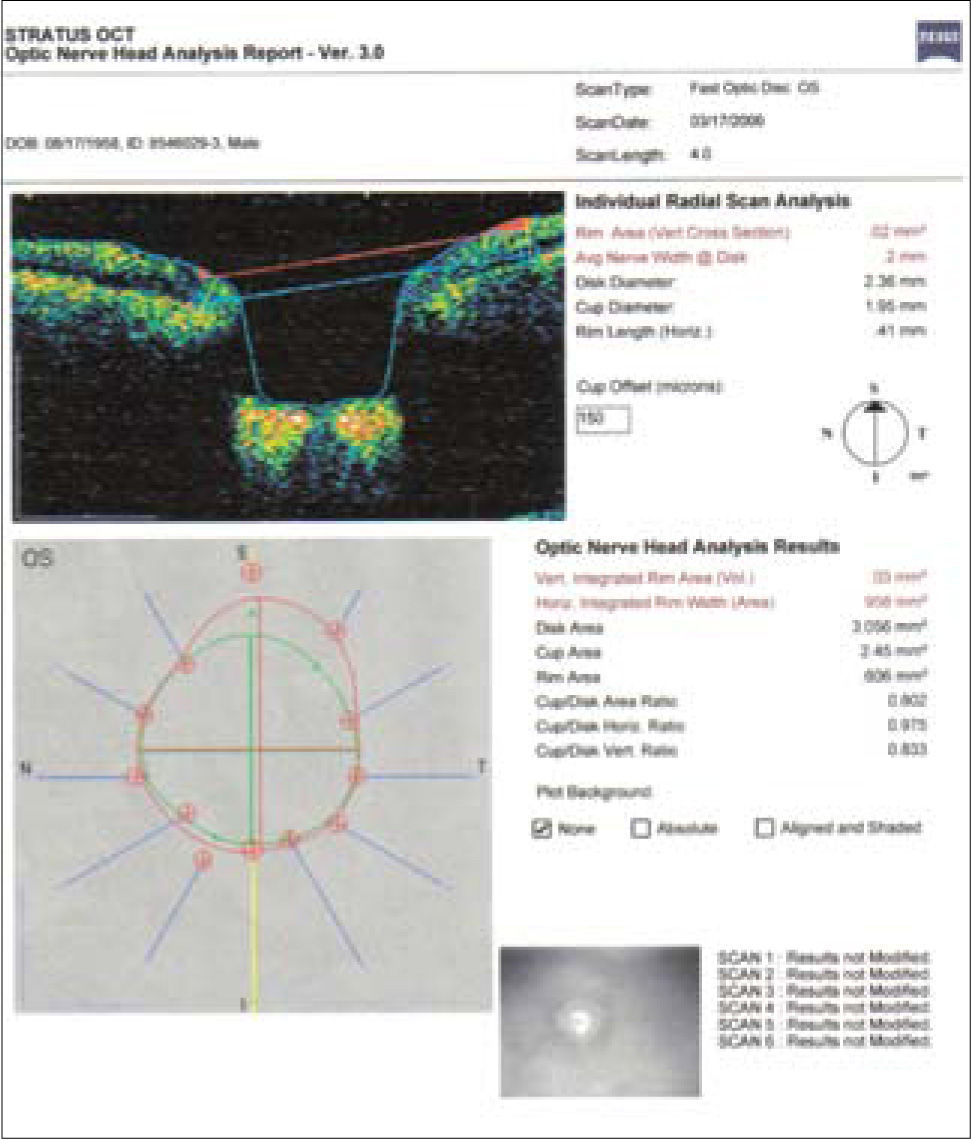
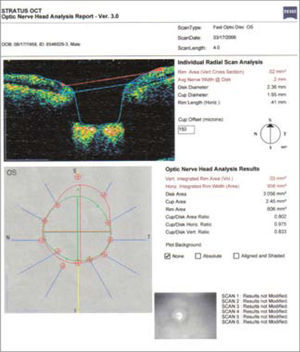
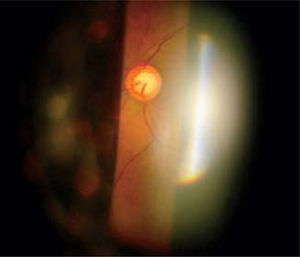
En este ejemplo de método imagenológico (OCT), se ve una toma de nervio óptico en el cual se trazan diámetros en relación al reborde neuroretiniano, con los cuales se determinan distintas proporciones para evaluar compromiso glaucomatoso, en este caso el Area Copa/Disco está muy alterada, con una relación de 0.802, lo cual debería correlacionarse con la observación del clínico.
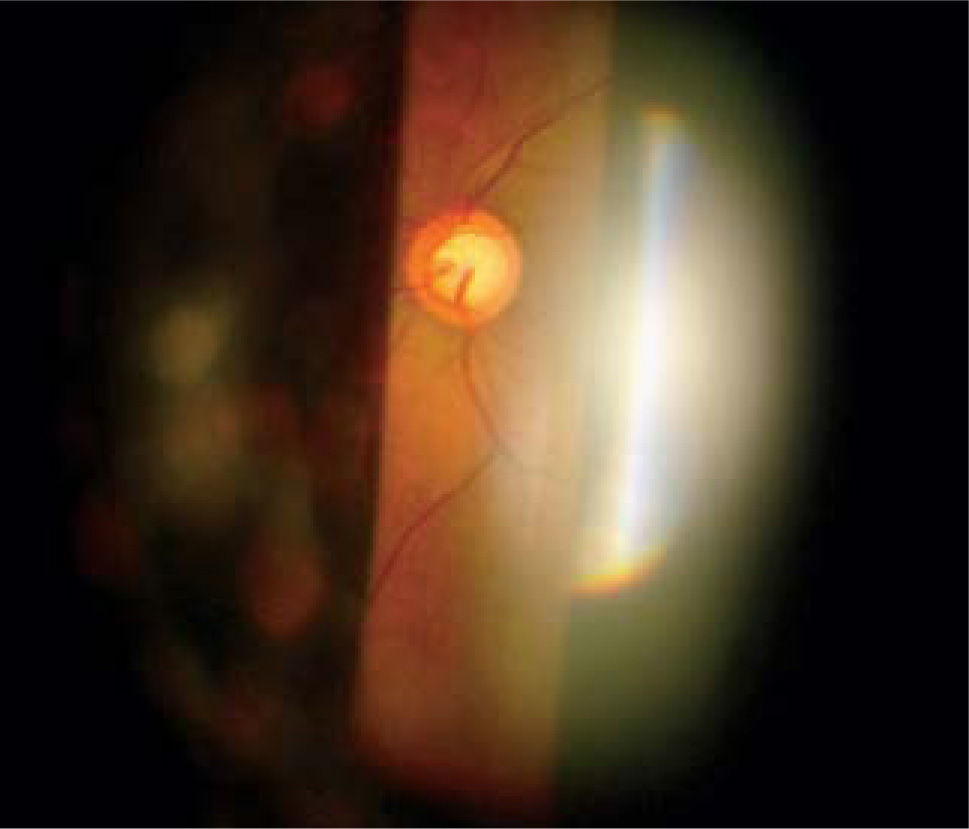
Pese a que son de gran ayuda en casos sospechosos, se ha observado que las técnicas de imagen no son mejores que la evaluación cuantitativa de las fotografías de disco (10, 11) y que la determinación de la progresión de excavación de la papila óptica, la normalidad del anillo o reborde neuroretiniano evidenciado por el ancho y color sigue siendo muy importante (Figuras 5, 6, 7). En este sentido, la escotadura unilteral localizada en el cuadrante infero-temporal o supero-temporal del reborde papilar es un fuerte, si no seguro, indicador de glaucoma. Cuando se agregan otros signos con menos significancia como una asimetría en la relación copa/disco mayor a 0.4, atrofia peripapilar, hemorragia de disco, signo de Herscheler cuando se ven vasos flotantes, excentricidad vertical de la excavación con una relación de más de 3, etc., aumentan la sospecha de glaucoma, pero no lo definen. En el último tiempo, se le ha dado gran importancia a la presencia de hemorragia de disco en astilla que cruza el nervio óptico, y se considera asociada a la presencia de pit (fosa) adquirida de nervio óptico, lo cual es una asociación fuerte a glaucoma (12, 13).
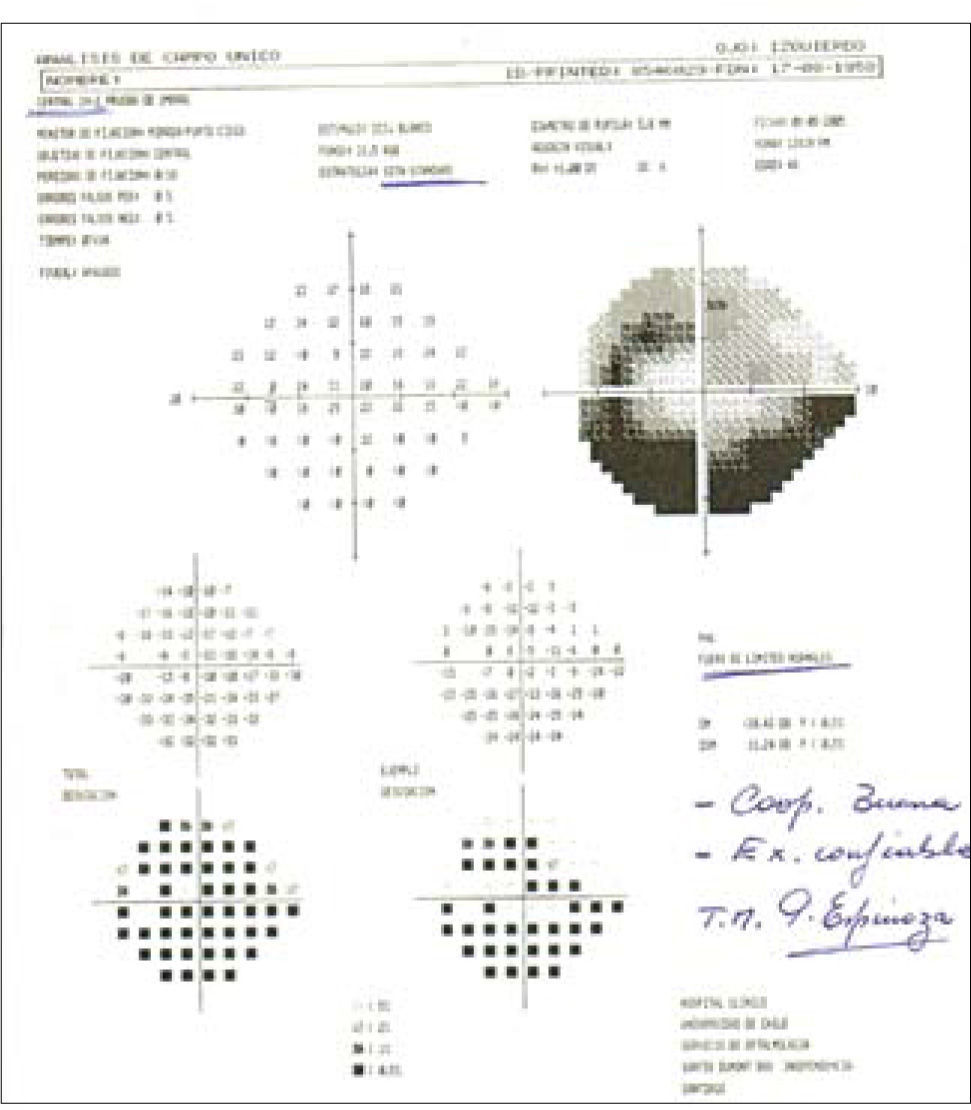
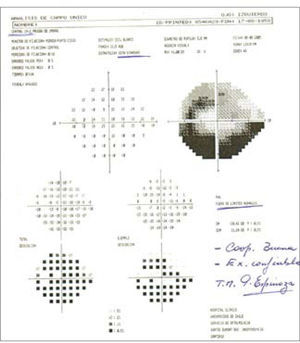
El uso de las pruebas de campo visual automatizado nos ayuda enormemente para diagnosticar glaucoma en una fase aún temprana de enfermedad, cuando aún no se producen cambios significativos en términos de visión, esto además proporciona una cantidad de datos necesarios para supervisar el control y posible progresión de la enfermedad. Numerosos estudios de la década pasada, han permitido que este tipo de examen sea rápido, preciso, fiable y reproducible, como la estrategia SITA (Swedish Interactive Treshhold Algorithm). Otra estrategia es la tecnología de duplicación de frecuencia (FDT) que demuestra una alta sensibilidad, pero no tan buena especificidad como el SITA, lo cual lo hace más eficiente en términos de screening de enfermedad que de diagnóstico debido a su rapidez (14) (Figura 8).
Short Wavelenght Automated Perimetry (SWAP) es capaz de predecir la aparición y progresión de glaucoma mucho antes que la perimetría automatizada convencional, pero como desventaja está lo tedioso del examen, poco práctico, pensando en que la mayoría de los pacientes son ancianos y que últimos estudios demuestran que no hay mayores diferencias si el SITA está bien realizado por el operador correspondiente.
Presión intraocularEn la última década no ha aparecido ningún avance significativo en el registro de la presión intraocular. A pesar de la aparición de varios tipos de tonómetros como por ejemplo de aplanación de aire, como el Pneumatonograph, tonómetro electrónico Mackay Marg, Tonopen XL (tonómetro de flujo sanguíneo) (15) e incluso tonómetros de no contacto, el tonómetro de Goldman sigue siendo el más confiable. Hay que tomar en cuenta además de la rigidez escleral, que el grosor corneal central afecta la lectura de la presión intraocular, se establece la paquimetría o medida del grosor corneal como factor independiente de riesgo de tener glaucoma a futuro, en este sentido pacientes con córneas con un grosor menor a 520 micras tienen en un 50% más riesgo de enfermedad (16, 17).
Lo que sí se ha establecido es el concepto de PIO objetivo o “target”, la cual se define como la presión intraocular segura para cada persona en particular, que puede corresponder a un valor menor de 21mm Hg, dependiendo del estado de daño del paciente.
Esta PIO objetivo se determina en general bajo los siguientes principios:
- A.
Leve pérdida de campo (<6 dB DM de daño en Campo Visual), reducir un 20% la PIO inicial.
- B.
Daño moderado (entre 6 y 12 dB DM de daño de Campo Visual), reducir un 30% la PIO inicial.
- C.
Daño avanzado (>12 dB DM en daño de Campo Visual), reducción de 40% o más la PIO inicial.
No hay una presión intraocular específica en la que uno pueda decir que el paciente está completamente libre de daño, por lo tanto esta debe ser individualizada para decidir cuan frecuente repetir el examen biomicroscópico y los campos visuales. Los factores de riesgo de edad, miopía, herencia, raza afroamericana, etc. deben tenerse en cuenta, la presencia de diabetes ya no se considera como criterio mayor de diagnóstico, pues se ha establecido sólo como un factor coincidente con el hecho de tener glaucoma. Se presentan como factores de riesgo seguros los pacientes con exfoliación y dispersión pigmentaria (18).
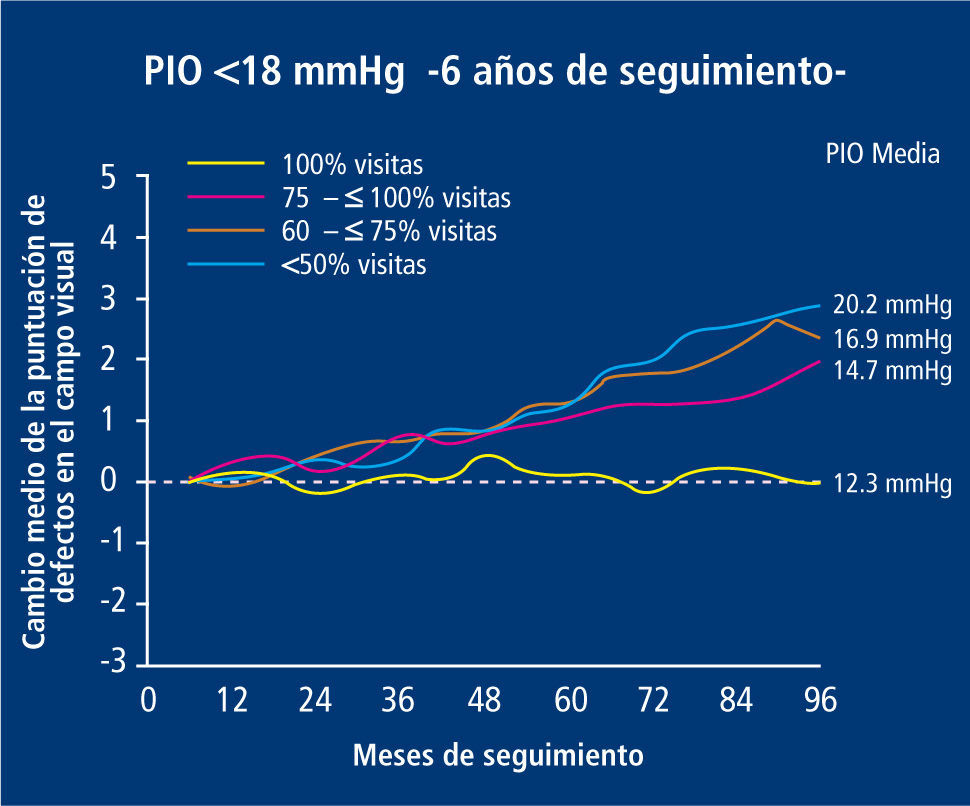
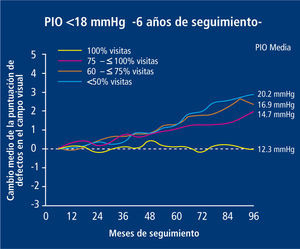
Se ha establecido por el Advanced Glaucoma Intervention Study (AGIS) que el hecho de disminuir la PIO es un factor independiente de progresión de enfermedad, respecto de los otros mencionados previamente (18) (Figura 9).
El grupo de estudio en el glaucoma avanzado (AGIS) ha establecido que la PIO a la cual no se produce avance de daño en campo visual corresponde a un promedio de 12.3 mmHg.
La mayoría de las decisiones terapéuticas en glaucoma se basan en mediciones de PIO en estado estacionario, generalmente en la consulta, no considerando los “peaks” de presión que ocurren en ciertos momentos, más frecuentes en la noche y que producen daño (19). Se establece también una relación en los cambios de medición de PIO, al comparar la toma desde decúbito supino a postura sentada, aumentando la PIO en esta última, pero su relación exacta con la progresión de daño aún no está bien esclarecida.
Presión de perfusiónEl daño glaucomatoso se asocia a una disminución de la presión de perfusión de la lámina cribosa y del reborde neuroretiniano. Si existe un desregulación vascular que interfiera con la adecuada perfusión ocular, el ojo se hace más sensible al aumento de presión intraocular o frente a una disminución de la presión arterial. Esto explicaría el por qué se produce pérdida de campo visual, en pacientes con presiones intraoculares bajas y pone en evidencia la importancia de usar para el glaucoma, sólo medicamentos que no pongan en riesgo la presión de perfusión de la papila óptica (20). La presión de perfusión de disco se puede medir, por ejemplo, con las técnicas de fluorometría retinal de Heidelberg o fluorometría de barrido doppler. Sin embargo, debido a lo poco práctico del examen, éstas no se realizan de forma rutinaria, además estas no cambiarían el enfrentamiento terapéutico.
Se señala en muchos estudios que esta falta de perfusión de disco es la principal causa de pérdida de campo, y ésta puede ser debida a una PIO elevada o ser independiente de la presión, lo que explicaría los casos de glaucoma de tensión baja (21, 22). Muchos pacientes con glaucoma de tensión normal, se encuentran en mayor riesgo de daño si tienen antecedentes de migraña o cefalea tipo vasoespasmo, esto hará necesario el uso de bloqueadores de canales de calcio, para prevenir futuras lesiones glaucomatosas. Es notable la recuperación de la presión de perfusión de la papila óptica, una vez reducida la PIO, especialmente después de una exitosa cirugía de glaucoma (trabeculectomía) (23).
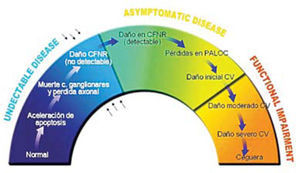
ApoptosisEn una persona normal se pierden alrededor de 10.000 células ganglionares por año, y cerca de los 80 años es normal haber perdido el 30% de ellas. En el caso del glaucoma de ángulo abierto, cuando la pérdida de campo visual se hace evidente, se ha perdido o destruido al menos el 50% de estas células (Figuras 1 y 10).
Se establece claramente que lo primero que se daña es la capa de fibras nerviosas antes de que aparezca un cambio en el disco medible ya sea por imágenes o por oftalmoscopía directa, y que cuando el daño es detectable por campo visual computado este daño estructural ya ha llegado a un 50%.
La apoptosis es un proceso genéticamente programado en el cual las células se suicidan, que se caracteriza por la condensación cromática, fragmentación intracelular y del ADN internucleosomal. La muerte celular programada retinal se inicia cuando un evento patológico como la isquemia, lesión axonal o cambios en la lámina cribosa, llevan a la activación de la apoptosis, que puede ocurrir debido a mecanismos primarios o secundarios.
Los mecanismos principales son- •
El estrés mecánico, una PIO elevada puede interferir con el flujo retrógrado axoplásmico de factores de crecimiento esenciales, producidos por el núcleo geniculado lateral.
- •
Compromiso vascular, una PIO elevada, enfermedad vascular o ciertas drogas, pueden reducir la perfusión del nervio óptico, causando condiciones de isquemia.
- •
Determinantes genéticos, que pueden contribuir a la susceptibilidad de las células ganglionares al daño.
- •
Enfermedades, como la diabetes, que puede también hacer que las neuronas sean más vulnerables al daño.
En el daño neuronal participan factores tóxicos, como los niveles elevados de glutamato (que en niveles normales actúa como neurotransmisor), los radicales libres de oxígeno o el óxido nítrico, que pueden ser liberados tras una lesión primaria, generalmente isquémica, y que continuarán con el daño aún cuando la injuria primaria haya sido controlada. Así es como las células muertas continuarán liberando glutamato y otros aminoácidos que perpetuarán el proceso de apoptosis.
NeuroprotecciónEl término neuroprotección se refiere a la protección de las neuronas sanas, pero vulnerables que se encuentran en las proximidades de las células muertas y las que están muriendo, que están en riesgo de ser lesionadas, incluso después de la lesión primaria como mencionamos antes.
En glaucoma, el objetivo de la neuroprotección es limitar o retrasar el daño dependiente de presión intraocular o independiente de ella en las células ganglionares retinales, esto al interferir con los procesos y sustancias que provocan la muerte celular neuronal o mediante la mejora de las vías de señalización axonal que aumentan la supervivencia neuronal bajo condiciones de estrés (24, 25). Se ha demostrado que la cantidad de glutamato aumenta al doble en el vítreo en los casos de glaucoma.
La neuroprotección se basa en los principios de reducir los factores de riesgo, esto es bajando la PIO para reducir la isquemia, promover la supervivencia neuronal e inhibir la muerte celular.
El glutamato es tóxico para las células ganglionares por la sobreestimulación de los receptores NMDA (N-metil-D-aspartato) cuando sobrepasa el nivel normal, matando las células ganglionares de la retina. La memantina, derivado de la amantadita, promete ser una eficiente sustancia neuroprotectora en el glaucoma por interacción no competitiva, bloqueando los efectos tóxicos del glutamato, previniendo la muerte ganglionar.
Las proteínas codificadas por la familia de genes Bcl-2 desempeñan un papel central en la regulación de la apoptosis, por ejemplo la expresión de los genes para bad y bax activan la apoptosis mientras que la inducción de Bcl-2 y Bcl-xl aumentan la disponibilidad de importantes factores neurotróficos y suprimen el proceso apoptótico. Algunos estudios muestran que la brimonidina aumenta la expresión de genes anti-apoptosis, mediante la activación de los receptores alfa-2 en la retina, por lo tanto evitaría la muertes de células ganglionares retinianas y promovería el crecimiento axonal (26), igualmente neutraliza el ácido kaínico que es tóxico para las células neuronales.
Otros con potencial neuroprotector son algunos antioxidantes, superóxido dismutasa eliminando radicales libres, catalasa y la vitamina E. Se encuentran bajo estudio como agentes neuroprotectores los bloqueadores de los canales calcio, Temax, citicolina, eliprodil, riluzol, L-deprenal, etc.
Tratamiento médicoExisten hoy en día numerosos fármacos de diferentes clases, disponibles para disminuir la PIO, debido a esto existen distintas estrategias de tratamiento según cada paciente con glaucoma. La reducción de la PIO que se logre durante los primeros tres meses, en general al primer control luego del diagnóstico de glaucoma, resulta ser muy importante, se ha establecido que por cada mm de Hg que logremos bajar en este período se disminuye en un 11% el riesgo de progresión de enfermedad (27).
Tradicionalmente los betabloqueadores se consideraron como el tratamiento estándar para el glaucoma, pero otras drogas como los alfa-2 agonistas, inhibidores de la anhidrasa carbónica y las prostaglandinas se ofrecen como alternativas terapéuticas para el clínico, mejorando además la adherencia a tratamiento o “compliance”.
En general, los fármacos anti-glaucomatosos se eligen según su eficacia, perfil de seguridad, costo y tolerancia local.
En función de estos criterios, los beta bloqueadores, especialmente el timolol junto al betaxolol en sus presentaciones al 0.25% y 0.5%, ha sido el medicamento más utilizado en la terapia antiglaucomatosa. Se caracteriza por ser bastante eficaz, reduciendo la PIO entre un 15% y 30%, relativamente barato y con una tolerancia excelente, que lo han hecho altamente recomendable y sigue siendo el fármaco más usado en el mundo.
Sin embargo hay que considerar y monitorear los efectos adversos sistémicos, como estado asmático y problemas cardiovasculares, los cuales incluso puede provocar la muerte del paciente; otros problemas son la depresión, impotencia, pérdida de líbido, descompensación de diabetes e hipotensión nocturna (28). Beta bloqueadores selectivos como el betaxolol, son seguros para pacientes con problemas respiratorios, pero menos eficaz que el timolol.
La pilocarpina aún se sigue utilizando, teniendo cabida en el glaucoma primario por ángulo cerrado. Tiene un efecto sinérgico con beta bloqueantes, brimonidina e inhibidores de anhidrasa carbónica.
Los agentes adrenérgicos (agonistas) como la dipivefrina, clonidina y apraclonidina ya no se utilizan de regla, pues a menudo están asociadas a alergia conjuntival y otros efectos secundarios como disminución de la presión de perfusión de la papila óptica.
BrimonidinaLa brimonidina (Alphagan-P®, Brimopress®, Aglad®), es un agonista alfa-2 selectivo, análogo de la clonidina, muy baja afinidad para los receptores alfa-1 por lo que se elimina el efecto midriático, su principal mecanismo de acción es la disminución de la PIO por supresión de la producción de humor acuoso como lo hace el timolol, pero además aumenta en cierto grado el flujo uveoescleral. Tiene una relativa seguridad sistémica y tendría una función de neuroprotección a través de un regulación positiva de factores de supervivencia celular y neuronal como bFGF1 en respuesta a la activación de los receptores adrenérgicos alfa-2 y al aumento del flujo sanguíneo ocular (52). Se usa dos veces al día al igual que el timolol y su efecto en disminución de la PIO es comparable a este último. Factores limitantes de esta droga son las reacciones alérgicas en forma de conjuntivitis folicular y dermatoconjuntivitis de contacto, esto se ha mejorado cambiando el preservante de la droga. Además, se ha reportado en algunas ocasiones fatiga, somnolencia y sequedad bucal.
Análogos de prostaglandinasLos análogos de las prostaglandinas como el latanoprost (Xalatan®, Latof®, Gaap®, Louten®, Gaax®, Gatif®), bimatoprost (Lumigan®), y travoprost (Travatan®) disminuyen la PIO en un 30% a 40%, debido a esta razón se convierten actualmente en el fármaco de elección como monoterapia en aquellos pacientes que necesitamos esta presión objetivo.
Muestran un control superior en la PIO, ya que su efecto se mantiene por 24 horas, evitando los aumentos bruscos de PIO, causante de daño en pacientes glaucomatosos sobre todo en los casos avanzados, comportamiento no mostrado por otra clase de drogas.
Este tipo de fármacos aumenta el flujo de salida uveoescleral sin afectar el flujo de salida trabecular o la producción de humor acuoso, la cual estaría mediada por una modificación de la matriz extracelular y una relajación del músculo ciliar. Se ha reportado que el latanoprost aumenta en un 50% el flujo de salida uveoescleral mientras que además aumentaría el flujo trabecular en un 30% a través de un mecanismo no explicado completamente, adicionalmente aumentaría el flujo sanguíneo hacia el nervio óptico (29).
Diversos estudios muestran la eficacia superior frente al efecto producido por el timolol, por ejemplo, un 62% de los pacientes que reciben bimatoprost tienen un 40% de reducción en los niveles de PIO, en comparación con un 35% recibiendo timolol (30).
El mayor inconveniente con los análogos de las prostaglandinas son los efectos secundarios oculares en forma de hiperhemia conjuntival 15%, escozor y ardor 30–40%, sensación de cuerpo extraño 20–22%, crecimiento de pestañas, aumento de la pigmentación iridiana y del tejido periorbitario, incluyendo párpados, edema macular quístico, queratitis y uveítis sólo en algunos casos.
Otros tipos de fármacos relacionados son las prostamidas, como la unoprostona, pero no han mostrado un efecto tan dramático como los análogos de prostaglandinas, por lo que su uso no se masificó en comparación a los análogos.
Inhibidores de la anhidrasa carbónica (IAC)Los IAC tópicos siendo menos eficaces que sus homólogos orales, evitan los efectos secundarios de la acetazolamida por ejemplo. Se usan en el medio la dorzolamida (Trusopt®, Glaucotensil®) y brinzolamida (Azopt®) las cuales reducen la PIO en aproximadamente 15 a 24%, no siendo eficaces en todos los pacientes. Sus efectos secundarios son ardor, escozor, sensación de cuerpo extraño, queratitis superficial, pueden descompensar patologías corneales previas. En general se emplean como terapia de segunda o tercera línea.
Terapias combinadasTodas las combinaciones fijas de fármacos antiglaucomatosos comercializadas contienen maleato de timolol 0,5%, que se ha combinado con análogos de prostaglandinas, como latanoprost (Xalacom ®), travoprost (Duotrav®) y bimatoprost (Ganfort®), con alfa-2 agonistas como la brimonidina (Combigan®) y con inhibidores de la anhidrasa carbónica tópicos como la dorzolamida (Cosopt®) y la brinzolamida (Azarga®), esta combinación sería más eficaz que cada uno de los componentes por separado.
Se encontró que un 39,7% de los pacientes en tratamiento usa dos o más medicamentos, y que un no despreciable porcentaje de 9,3% usa tres o más (31).
Se debe considerar que la eficacia de tratamiento no aumenta al doble al asociar otra droga como se podría pensar, y que el efecto de taquifilaxis igual existe en este tipo de fármacos.
Se debe considerar que las fluctuaciones de la PIO son un factor de riesgo significativo para la progresión de las lesiones del campo visual, aunque la PIO medida en la consulta está controlada, durante el resto del día puede no estarlo. Debemos tener en cuenta las variaciones circadianas de la PIO al elegir los fármacos hipotensores, por tanto, los objetivos son obtener eficacia durante las 24 horas y evitar al máximo las fluctuaciones de la PIO (32).
Con respecto al cumplimiento terapéutico, un 33% de los pacientes confiesa no seguir bien el tratamiento, sólo un 41% de los pacientes conocen el riesgo de glaucoma en sus familiares y que sólo el 45% de los familiares han ido a algún tipo de screening de glaucoma (33). Un 76% de los pacientes persiste en el tratamiento, las razones para no seguir con el tratamiento son la dificultad en la instilación de gotas, los efectos secundarios, la falta de conciencia de enfermedad y el olvido en la medicación.
En estos momentos se están estudiando nuevas moléculas que puedan ser de utilidad en el tratamiento médico del glaucoma. Entre estos podemos destacar las investigaciones sobre los antagonistas del calcio como la lomerizina, que parece no producir hipotensión sistémica, y productos que se están investigando para uso tópico ocular como la flunarizina y la iganidipina. También se investigan inhibidores de la endotelina 1, como el sulfisoxazol y la bunazosina. Dentro del sistema renina-angiotensina se evalúa la angiotensina 1 y 7, y el olmesartan. Drogas trabeculares, como los inhibidores de la Rho-kinasa, podrían actuar sobre el mecanismo patogénico del glaucoma primario de ángulo abierto. Finalmente se evalúa la mifepristona tópica, antagonista de receptores glucocorticoides, lo cual sería de especial utilidad en la elevación de la PIO secundaria al uso de esteroides.
Trabeculopastía láser selectiva (SLT)Es una herramienta terapéutica reciente, fue autorizada en 2001 por la FDA. Se trata de un láser de longitud de onda 532 nm Nd:YAG, cuyo objetivo son las células pigmentadas de la malla trabecular, produciendo una fototermolisis controlada, favoreciendo los mecanismos locales de regulación del flujo del humor acuoso, con la consiguiente disminución de la PIO. Al actuar sobre los gránulos de melanina, activa en las células la liberación de citoquinas, las cuales gatillan la respuesta guiada de macrófagos. Estos actúan sobre las células pigmentadas dejando indemne a las células circundantes.
La SLT puede ser usada como alternativa terapéutica primaria o como coadyuvante a la terapia medicamentosa. Su uso ambulatorio y la ausencia de complicaciones le confieren importantes ventajas sobre otras alternativas de tratamiento. Además, la baja energía utilizada, sumada a la ausencia de cicatrización en el tejido tratado, permite repetir la aplicación hasta tres veces en el mismo ojo.
Estudios han demostrado la eficacia de SLT en la disminución de la PIO a niveles comparables con latanoprost y su gran efectividad en comparación con tratamiento médico máximo o trabeculoplastía láser argón (34). En general, el tratamiento realizado con SLT lleva a disminuir la necesidad de tratamiento médico para el control de la PIO.
Sería recomendada como terapia inicial para todos los pacientes con glaucoma primario de ángulo abierto, especialmente en pacientes jóvenes, personas con dificultades para aplicarse colirios (ancianos, problemas motores) o pacientes con baja adherencia al tratamiento medicamentoso.
Otro grupo de pacientes que se puede beneficiar de esta técnica son los hipertensos oculares aún no glaucomatosos. La técnica es muy reproducible, y fácil de aplicar, lo cual la hace muy segura para los pacientes. La PIO baja entre un 25–30%. Los estudios muestran efecto en un 40% de los pacientes a los 7 años de seguimiento, un 50% de los pacientes no requerirá adición de medicamentos tópicos, sin embargo la cantidad de pacientes que llegará a cirugía no cambia.
Cirugía en glaucomaSe considera tratamiento médico máximo estando en tratamiento con tres o más fármacos no alcanzando una PIO objetivo adecuada para el estado de glaucoma de cada paciente en particular y en que no se logre eliminar las fluctuaciones especialmente nocturnas que perpetúan el daño. En estudio colaborativo, al estudiar dos grupos comparables, se establece que mientras los fármacos pueden bajar la PIO en un 35%, la cirugía lo hace en un 48% (35). Debido a esto, hoy en día la tasa de cirugías ha disminuido gracias a la aparición de fármacos como los análogos de prostaglandinas, cuando un 30% de disminución de la PIO es lo adecuado, evitando las posibles complicaciones que conllevan las medidas quirúrgicas como hipotonía, hemorragias coroideas, cataratas y endoftalmitis, entre otras.
Sin embargo, en pacientes en los que se requiere una mayor reducción, o en aquellos en que no estamos evitando las fluctuaciones durante el día, se llega a la cirugía que puede ser no perforante (esclerectomía profunda) o perforante (clásica trabeculectomía o tubos de drenaje).
En nuestro medio, debido a que la escleroctomía profunda alcanza un control de la PIO de alrededor de un 20%, ésta no se realiza de rutina debido a lo efectivo de las drogas antiglaucomatosas disponibles. Cuando nos enfrentamos a un paciente en terapia máxima se prefiere una trabeculectomía, esta se prefiere realizar con antimetabolitos, mitomicina C en vez del 5-fluorouracilo por su efectividad a largo plazo.
En el caso de falla de la trabeculectomía la cual ocurre especialmente en casos como enfermedades de la superficie ocular como los pénfigos y penfigoides oculares, glaucomas uveíticos, pediátricos o congénitos, traumáticos y neovasculares, es decir, en los glaucomas secundarios en su mayoría, actualmente existe la posibilidad del uso de tubos de drenaje que pueden ser valvulados o no valvulados dependiendo de cuán baja necesitemos la PIO para cada paciente o también dependiendo de cuan inflamatorio será el postoperatorio, así es como en un paciente uveítico se preferirá in tubo con un plato de drenaje amplio y no valvulado para que el paciente tenga la presión lo más baja posible y con la amplitud del plato haya una menor probabilidad de fibrosis que limite el flujo.
Nuestra experiencia es que al momento de llegar a una cirugía de válvula o tubo, los pacientes ya han tenido al menos tres cirugías previas, y que un 51% llega con visiones menores a 20/200. Teniendo esta cirugía una adecuada tasa de éxito de un 75% a 2 años, esta se está realizando con mayor frecuencia para evitar estos pobres resultados visuales, esto por llegar tarde a controlar la fluctuación de PIO. Los pacientes pediátricos y uveíticos presentan mayor riesgo de exposición del tubo y existe una baja tasa de complicaciones severas dadas en su mayoría en glaucoma neovascular y pediátrico.
En glaucoma pediátrico y congénito todos los casos son de resolución quirúrgica, la farmacoterapia estará indicada sólo como medida hipotensora previa a la cirugía y como coadyuvante luego de haber sido ésta realizada. Fármacos como la brimonidina y timolol están contraindicados en niños.
El autor declara no tener conflictos de interés, en relación a este artículo.