El período perioperatorio es determinante en los resultados oncológicos tras la cirugía de mama, pues numerosos factores influyen en la función inmune, la angiogénesis y la diseminación tumoral. El objetivo de esta revisión fue identificar los factores de riesgo perioperatorios asociados con la proliferación y la recurrencia del cáncer tras la cirugía oncológica de mama, para ello se siguió el protocolo PRISMA (registro en PROSPERO con número CRD42021227297). Tras una búsqueda bibliográfica en PubMed, Google Scholar, Web of Science y Embase, guías clínicas europeas y Cochrane, se incluyeron estudios en inglés o español, que cumplieran criterios de calidad establecidos. Las variables cualitativas se presentaron según su distribución de frecuencias. Se analizaron 34 estudios de las 253 publicaciones identificadas, utilizando el programa estadístico IBM SPSS Statistics versión 24.0 para Windows. El tiempo de seguimiento fue de 36 meses de media (rango amplio entre 1 día y 5 años), encontrando 10% de recurrencias tumorales tras la cirugía de mama y mayor supervivencia libre de tumor no significativa en caso de anestesia intravenosa libre de opioides frente a anestesia inhalatoria con opioides. En general se encuentran mejores resultados oncológicos con antiinflamatorios, ketamina, bloqueantes del sistema nervioso simpático, anestésicos locales y buen control del dolor postoperatorio. Se necesitan ensayos clínicos multicéntricos que analicen los factores pronósticos oncológicos de forma independiente, con seguimiento superior a la supervivencia tumoral, que estudien los factores histológicos, anatomopatológicos y de extensión asociados a la agresividad oncológica.
Perioperative period is decisive in oncological results after breast surgery, because of numerous factors are involved in immune function, angiogenesis and tumor spread. The aim of this review was to identify perioperative risk factors associated with cancer proliferation and recurrence after breast cancer surgery. PRISMA protocol was followed for this purpose (PROSPERO registration number CRD42021227297). After bibliographic search in PubMed, Google Scholar, Web of Science and Embase, European clinical guidelines and Cochrane, we included studies in English or Spanish, which met established quality criteria. The qualitative variables were presented according to their frequency distribution. We analyzed 34 studies of the 253 identified publications, using the statistical program IBM SPSS Statistics version 24.0 for Windows. The follow-up time was 36 months on average (wide range between 1 day and 5 years), finding 10% tumor recurrences after breast surgery and increased tumor-free survival in case of opioid-free intravenous anesthesia versus inhalation anesthesia with opioids, but no significant differences were found. Recurrence data were better every time that anti-inflammatories, ketamine, sympathetic nervous system blockers and, local anesthetics were used and good postoperative pain control registered. There is a need for multicenter clinical trials that analyze oncological prognostic factors independently, with follow-up greater than tumor survival, and that study the histological, pathological and extension factors associated with oncological aggressiveness.
La mayor esperanza de vida junto a factores de riesgo (tabaco, alcohol, dieta poco saludable, inactividad física, contaminación del aire e infecciones crónicas) es causante del aumento de la incidencia del cáncer, que constituye una de las principales causas de mortalidad (10 millones de fallecimientos en 2020)1. El cáncer de mama constituye un 12,5% de cánceres diagnosticados (2,26 millones de casos en 2020), ocupando el quinto lugar en mortalidad, después del pulmonar, colorrectal, hepático y gástrico1.
Los avances en el conocimiento de la etiopatogenia y el desarrollo de nuevas líneas terapéuticas multimodales y multidisciplinares, no han frenado el aumento de su incidencia1. La aplicación de medidas sencillas de prevención evitando factores de riesgo, así como un diagnóstico y tratamiento precoces evitarían un 30–50% de la mortalidad.
Diferentes factores (estado de receptores hormonales y del HER2, marcadores genómicos, presencia de mutaciones BRCA1 o BRCA2, edad, raza, estadificación del tumor y estado físico del paciente y preferencias individuales) condicionan y deben personalizar el tratamiento2. La resección quirúrgica es la base terapéutica, especialmente en cáncer triple negativo (ausencia de expresión de receptores hormonales y proteína HER2), de rápido crecimiento o baja respuesta a quimioterapia3.
La recidiva tumoral posquirúrgica ganglionar o a distancia (metástasis) presenta un pico máximo a los 18 meses, relacionado con estímulo perioperatorio y otro a los 60 meses, debido a la evolución natural de la enfermedad4. La propia cirugía, la anestesia, la analgesia y algunos agentes específicos podrían influir en los resultados oncológicos tras una cirugía de resección5,6.
El objetivo de esta revisión fue identificar los factores de riesgo asociados con la diseminación y la recurrencia del cáncer tras una resección quirúrgica, especialmente los susceptibles de evitar como el dolor, la respuesta al estrés y las técnicas analgésicas; con el fin último de protocolizar las prácticas perioperatorias de elección para optimizar los resultados oncológicos, con base en evidencia de calidad.
MetodologíaSe realizó una búsqueda bibliográfica en las bases de datos PubMed, Google Scholar, Web of Science y Embase el 3 de junio de 2021 cruzando las palabras clave «breast cancer», «anesthesia», «pain», «angiogenesis», «recurrence», «inmunomodulation», «metastasis». Se incluyeron guías clínicas de organismos internacionales (Comisión Europea) y revisiones de la Cochrane.
Los criterios de inclusión fueron: 1) revisiones sistemáticas o metaanálisis, 2) ensayos clínicos aleatorizados, 3) revisiones narrativas y 4) escritos en idioma inglés o español. Cuando se detectaron revisiones firmadas por los mismos autores y con metodología similar, se seleccionó el estudio más reciente. Se excluyeron duplicidades, casos-control, estudios piloto descriptivos; o sobre cánceres diferentes al de mama.
Los investigadores recogieron datos de cada publicación seleccionada: autor principal, año de publicación, región geográfica, tipo de estudio, tamaño muestral, técnica anestésica y conclusiones. Estos datos se introdujeron en una base de datos Excel.
Cada autor otorgó una puntuación al estudio tras leer los resúmenes correspondientes y seleccionaron los artículos con base en la puntuación de los criterios de calidad establecidos. Todos los autores desconocían las decisiones del resto. Los artículos en que hubiera discrepancia entre los 3 autores eran incluidos o excluidos, en caso de 2 opiniones a favor o en contra respectivamente.
La calidad de los ensayos clínicos se evaluó siguiendo la escala de Jadad. Las puntuaciones de 5 o mayores (con un máximo de 9) en la escala NOS eran consideradas de alta calidad frente a los estudios con puntuaciones menores de 5, consideradas de baja calidad. Si la puntuación era menor de 3, no se incluía el estudio. No se analizaron revisiones que no siguieran los ítems esenciales de la lista de verificación PRISMA.
Análisis estadístico descriptivo donde las variables cualitativas se presentaron según su distribución de frecuencias. Los datos han sido analizados con el programa estadístico IBM SPSS Statistics versión 24.0 para Windows.
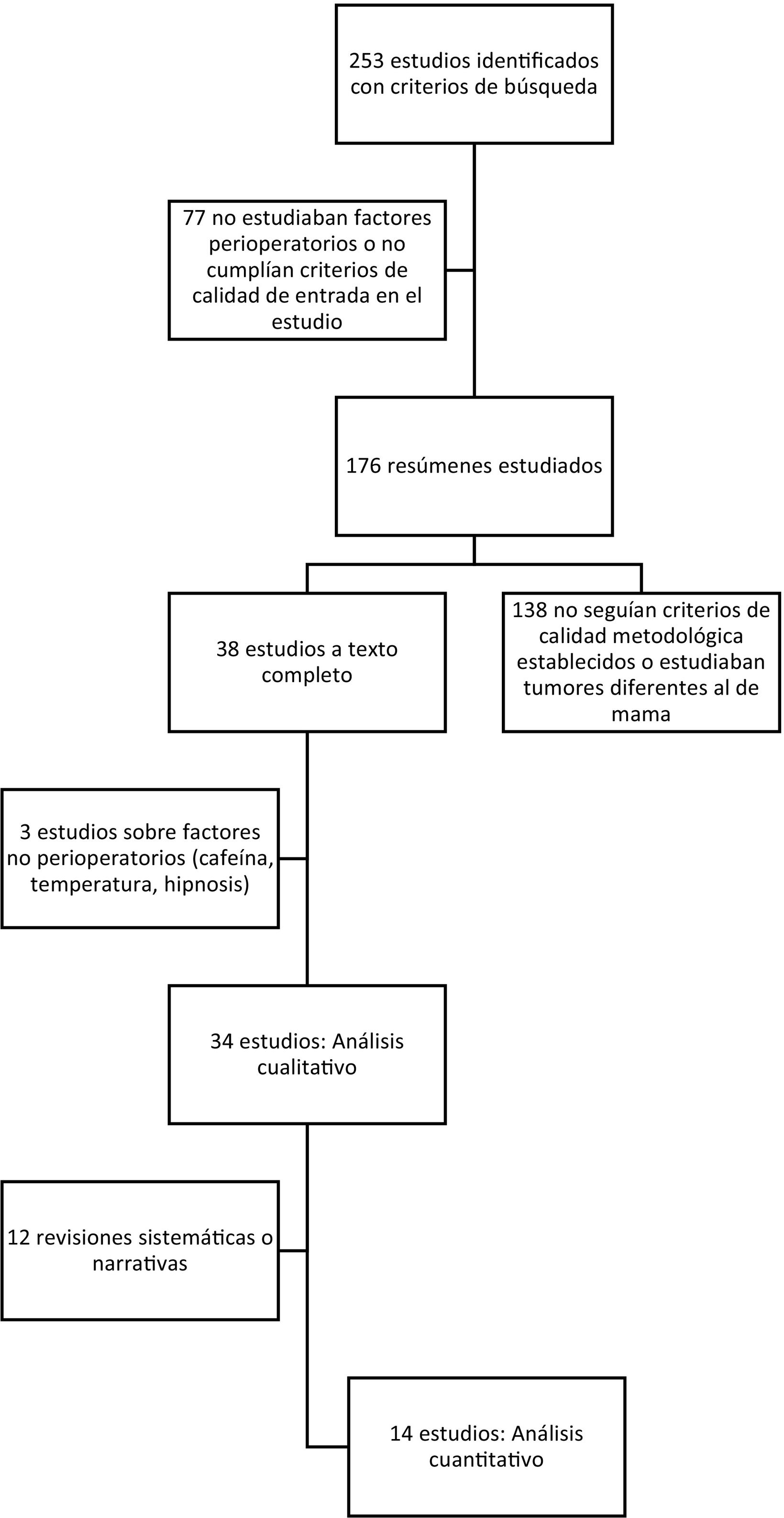
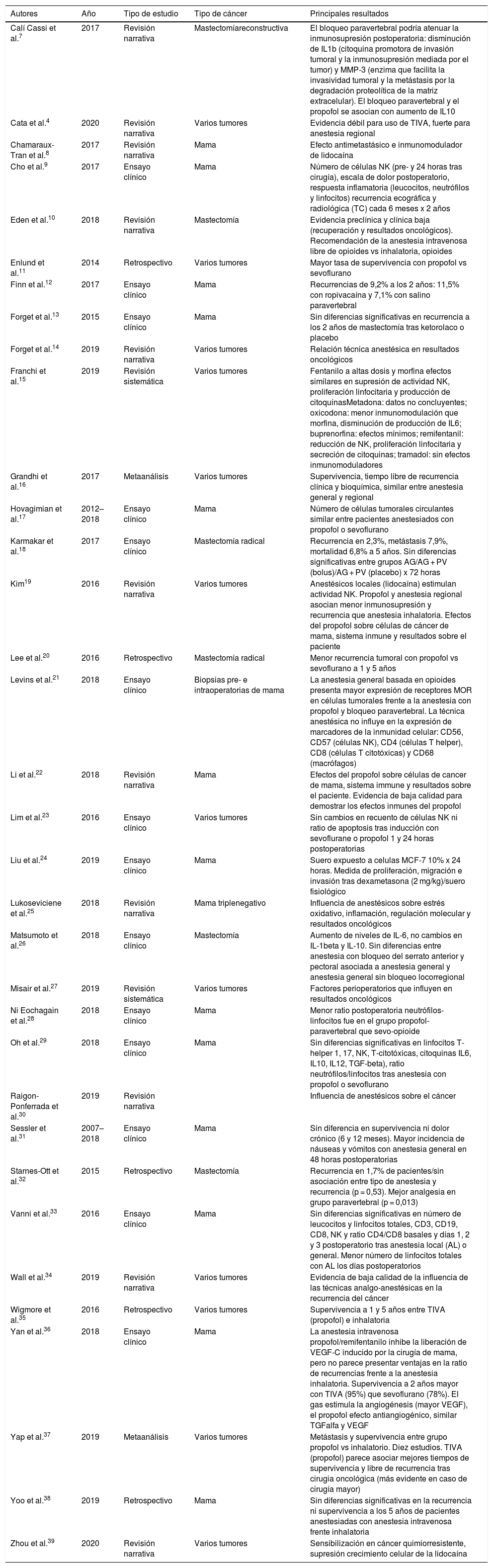
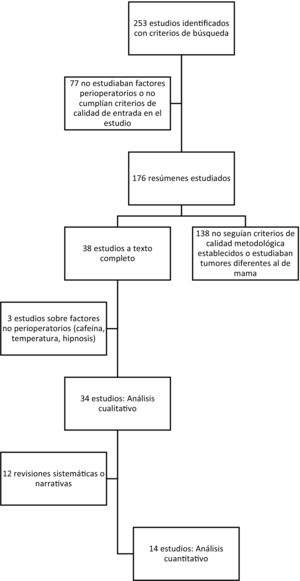
ResultadosSe identificaron 253 publicaciones (fig. 1), de las cuales cumplían los criterios de inclusión 38 estudios, y el análisis únicamente se realizó sobre 34 estudios (tabla 1). Se analizaron datos de 30.837 pacientes, 20.488 de los 2 metaanálisis estudiados y 10.349 de los 14 ensayos clínicos, 2 revisiones sistemáticas, 11 narrativas y 5 estudios retrospectivos.
Artículos revisados.
| Autores | Año | Tipo de estudio | Tipo de cáncer | Principales resultados |
|---|---|---|---|---|
| Calí Cassi et al.7 | 2017 | Revisión narrativa | Mastectomíareconstructiva | El bloqueo paravertebral podría atenuar la inmunosupresión postoperatoria: disminución de IL1b (citoquina promotora de invasión tumoral y la inmunosupresión mediada por el tumor) y MMP-3 (enzima que facilita la invasividad tumoral y la metástasis por la degradación proteolítica de la matriz extracelular). El bloqueo paravertebral y el propofol se asocian con aumento de IL10 |
| Cata et al.4 | 2020 | Revisión narrativa | Varios tumores | Evidencia débil para uso de TIVA, fuerte para anestesia regional |
| Chamaraux-Tran et al.8 | 2017 | Revisión narrativa | Mama | Efecto antimetastásico e inmunomodulador de lidocaína |
| Cho et al.9 | 2017 | Ensayo clínico | Mama | Número de células NK (pre- y 24 horas tras cirugía), escala de dolor postoperatorio, respuesta inflamatoria (leucocitos, neutrófilos y linfocitos) recurrencia ecográfica y radiológica (TC) cada 6 meses x 2 años |
| Eden et al.10 | 2018 | Revisión narrativa | Mastectomía | Evidencia preclínica y clínica baja (recuperación y resultados oncológicos). Recomendación de la anestesia intravenosa libre de opioides vs inhalatoria, opioides |
| Enlund et al.11 | 2014 | Retrospectivo | Varios tumores | Mayor tasa de supervivencia con propofol vs sevoflurano |
| Finn et al.12 | 2017 | Ensayo clínico | Mama | Recurrencias de 9,2% a los 2 años: 11,5% con ropivacaína y 7,1% con salino paravertebral |
| Forget et al.13 | 2015 | Ensayo clínico | Mama | Sin diferencias significativas en recurrencia a los 2 años de mastectomía tras ketorolaco o placebo |
| Forget et al.14 | 2019 | Revisión narrativa | Varios tumores | Relación técnica anestésica en resultados oncológicos |
| Franchi et al.15 | 2019 | Revisión sistemática | Varios tumores | Fentanilo a altas dosis y morfina efectos similares en supresión de actividad NK, proliferación linfocitaria y producción de citoquinasMetadona: datos no concluyentes; oxicodona: menor inmunomodulación que morfina, disminución de producción de IL6; buprenorfina: efectos mínimos; remifentanil: reducción de NK, proliferación linfocitaria y secreción de citoquinas; tramadol: sin efectos inmunomoduladores |
| Grandhi et al.16 | 2017 | Metaanálisis | Varios tumores | Supervivencia, tiempo libre de recurrencia clínica y bioquímica, similar entre anestesia general y regional |
| Hovagimian et al.17 | 2012–2018 | Ensayo clínico | Mama | Número de células tumorales circulantes similar entre pacientes anestesiados con propofol o sevoflurano |
| Karmakar et al.18 | 2017 | Ensayo clínico | Mastectomía radical | Recurrencia en 2,3%, metástasis 7,9%, mortalidad 6,8% a 5 años. Sin diferencias significativas entre grupos AG/AG + PV (bolus)/AG + PV (placebo) x 72 horas |
| Kim19 | 2016 | Revisión narrativa | Varios tumores | Anestésicos locales (lidocaína) estimulan actividad NK. Propofol y anestesia regional asocian menor inmunosupresión y recurrencia que anestesia inhalatoria. Efectos del propofol sobre células de cáncer de mama, sistema inmune y resultados sobre el paciente |
| Lee et al.20 | 2016 | Retrospectivo | Mastectomía radical | Menor recurrencia tumoral con propofol vs sevoflurano a 1 y 5 años |
| Levins et al.21 | 2018 | Ensayo clínico | Biopsias pre- e intraoperatorias de mama | La anestesia general basada en opioides presenta mayor expresión de receptores MOR en células tumorales frente a la anestesia con propofol y bloqueo paravertebral. La técnica anestésica no influye en la expresión de marcadores de la inmunidad celular: CD56, CD57 (células NK), CD4 (células T helper), CD8 (células T citotóxicas) y CD68 (macrófagos) |
| Li et al.22 | 2018 | Revisión narrativa | Mama | Efectos del propofol sobre células de cancer de mama, sistema immune y resultados sobre el paciente. Evidencia de baja calidad para demostrar los efectos inmunes del propofol |
| Lim et al.23 | 2016 | Ensayo clínico | Varios tumores | Sin cambios en recuento de células NK ni ratio de apoptosis tras inducción con sevoflurane o propofol 1 y 24 horas postoperatorias |
| Liu et al.24 | 2019 | Ensayo clínico | Mama | Suero expuesto a celulas MCF-7 10% x 24 horas. Medida de proliferación, migración e invasión tras dexametasona (2 mg/kg)/suero fisiológico |
| Lukoseviciene et al.25 | 2018 | Revisión narrativa | Mama triplenegativo | Influencia de anestésicos sobre estrés oxidativo, inflamación, regulación molecular y resultados oncológicos |
| Matsumoto et al.26 | 2018 | Ensayo clínico | Mastectomía | Aumento de niveles de IL-6, no cambios en IL-1beta y IL-10. Sin diferencias entre anestesia con bloqueo del serrato anterior y pectoral asociada a anestesia general y anestesia general sin bloqueo locorregional |
| Misair et al.27 | 2019 | Revisión sistemática | Varios tumores | Factores perioperatorios que influyen en resultados oncológicos |
| Ni Eochagain et al.28 | 2018 | Ensayo clínico | Mama | Menor ratio postoperatoria neutrófilos-linfocitos fue en el grupo propofol-paravertebral que sevo-opioide |
| Oh et al.29 | 2018 | Ensayo clínico | Mama | Sin diferencias significativas en linfocitos T-helper 1, 17, NK, T-citotóxicas, citoquinas IL6, IL10, IL12, TGF-beta), ratio neutrófilos/linfocitos tras anestesia con propofol o sevoflurano |
| Raigon- Ponferrada et al.30 | 2019 | Revisión narrativa | Influencia de anestésicos sobre el cáncer | |
| Sessler et al.31 | 2007–2018 | Ensayo clínico | Mama | Sin diferencia en supervivencia ni dolor crónico (6 y 12 meses). Mayor incidencia de náuseas y vómitos con anestesia general en 48 horas postoperatorias |
| Starnes-Ott et al.32 | 2015 | Retrospectivo | Mastectomía | Recurrencia en 1,7% de pacientes/sin asociación entre tipo de anestesia y recurrencia (p = 0,53). Mejor analgesia en grupo paravertebral (p = 0,013) |
| Vanni et al.33 | 2016 | Ensayo clínico | Mama | Sin diferencias significativas en número de leucocitos y linfocitos totales, CD3, CD19, CD8, NK y ratio CD4/CD8 basales y días 1, 2 y 3 postoperatorio tras anestesia local (AL) o general. Menor número de linfocitos totales con AL los días postoperatorios |
| Wall et al.34 | 2019 | Revisión narrativa | Varios tumores | Evidencia de baja calidad de la influencia de las técnicas analgo-anestésicas en la recurrencia del cáncer |
| Wigmore et al.35 | 2016 | Retrospectivo | Varios tumores | Supervivencia a 1 y 5 años entre TIVA (propofol) e inhalatoria |
| Yan et al.36 | 2018 | Ensayo clínico | Mama | La anestesia intravenosa propofol/remifentanilo inhibe la liberación de VEGF-C inducido por la cirugía de mama, pero no parece presentar ventajas en la ratio de recurrencias frente a la anestesia inhalatoria. Supervivencia a 2 años mayor con TIVA (95%) que sevoflurano (78%). El gas estimula la angiogénesis (mayor VEGF), el propofol efecto antiangiogénico, similar TGFalfa y VEGF |
| Yap et al.37 | 2019 | Metaanálisis | Varios tumores | Metástasis y supervivencia entre grupo propofol vs inhalatorio. Diez estudios. TIVA (propofol) parece asociar mejores tiempos de supervivencia y libre de recurrencia tras cirugia oncológica (más evidente en caso de cirugía mayor) |
| Yoo et al.38 | 2019 | Retrospectivo | Mama | Sin diferencias significativas en la recurrencia ni supervivencia a los 5 años de pacientes anestesiadas con anestesia intravenosa frente inhalatoria |
| Zhou et al.39 | 2020 | Revisión narrativa | Varios tumores | Sensibilización en cáncer quimiorresistente, supresión crecimiento celular de la lidocaína |
AG: anestesia general; COX: ciclooxigenasa; IL: interleucina; IFN: interferón; MMP: metaloproteinasas de matriz; NK: natural killer; NF: factor nuclear; NET: atrapamiento extracelular de neutrófilos; PV: bloqueo paravertebral; TGF: factor de crecimiento tumoral; Th1: T-helper 1; Th2: T-helper 2; TIVA: anestesia total intravenosa; VEGF: factor de crecimiento vascular endotelial.
Los datos analizados demostraron asociación de 80 variables independientes con recurrencia o metástasis de cáncer. Las variables más frecuentemente estudiadas fueron: tasa de supervivencia, tiempo libre de recurrencia tumoral o metástasis, número de células tumorales circulantes, número de células natural killer (NK), linfocitos y neutrófilos, concentración plasmática de citoquinas pro- y antiinflamatorias, y de factores proangiogénicos. Los factores más investigados fueron los efectos de la anestesia general sobre la inmunidad celular, comparando anestesia intravenosa (propofol) frente a anestesia inhalatoria, y anestesia general asociada a opioides frente a anestesia regional. También se analizó el impacto de los fármacos y las técnicas perioperatorias como antiinflamatorios, opioides, ventilación mecánica o transfusiones sanguíneas.
Se objetivó un número creciente de estudios hasta el año 2018, para después ir disminuyendo progresivamente. La población estudiada en los artículos analizados fue en su mayoría occidental, con predominio italiano con 5 manuscritos, seguida por grupos de investigación multinacionales europeos. La población asiática está representada en 8 artículos (4 chinos, 3 coreanos y uno japonés).
El tiempo de seguimiento fue de 36 meses de media (con rango entre 1 día y 5 años). Se registraron un 10% de recurrencias tumorales posquirúrgicas. No se encontraron diferencias significativas al comparar técnicas anestésicas regionales frente a anestesia general (intervalo de confianza de 95%; p = 0,83) ni al comparar anestesia general inhalatoria asociada a opioides frente a anestesia intravenosa libre de opioides; aunque la tasa de supervivencia libre de tumor fue mayor en el segundo caso. La administración perioperatoria de antiinflamatorios (no esteroideos y esteroideos23), ketamina y anestésicos locales asoció mejores datos de recurrencia. La presencia de dolor postoperatorio se relacionó con mecanismos celulares inmunosupresores que podrían facilitar la progresión tumoral.
DiscusiónEl origen y la progresión tumoral es un proceso complejo, donde células cancerígenas con DNA dañado conviven en un ambiente favorable con mediadores inflamatorios y factores favorecedores de la angiogénesis, como el factor de crecimiento vascular endotelial (VEGF), metaloproteinasas de matriz (MMP), factor de necrosis tumoral a (TNF-a), factor transformante del factor de crecimiento b (TGF-b), y prostaglandina E2 (PGE2), ocupan un papel primordial16. La rapidez del crecimiento tumoral supera al aporte sanguíneo necesario para su nutrición, provocando carencia de glucosa, consumo de piruvato intracelular y secundariamente, estrés oxidativo e hipoxia. El estrés oxidativo activa factores de transcripción (NK-B, AP-1, p53 y HIF-1α); que facilitan la transformación oncológica celular, aumentando su supervivencia, proliferación, invasión, resistencia a quimio y radioterapia, y angiogénesis.
La inmunidad celular innata constituye la primera línea de defensa contra el cáncer. En esta participan macrófagos (células TAM: macrófagos asociados a tumores), células NK y células dendríticas. Las células TAM se clasifican en M1 (predominantes en estadios tumorales iniciales, responsables de respuestas inmunes adaptativas) y M2 (promotoras de inmunosupresión, angiogénesis y remodelado tisular), y se relacionan con linfocitos T-helper 1 y 2, respectivamente. Las células inmunes antígeno-específicas (linfocitos T citotóxicos) reconocen las células oncológicas e inducen apoptosis selectiva sobre ellas.
La diseminación del cáncer permite el agrupamiento de células inflamatorias, liberación de mediadores químicos, algunas con efecto dual sobre las células NK, como la interleucina-10 (IL-10), daño de tejidos adyacentes y, a veces, fracaso de la apoptosis40.
La aparición de metástasis constituye el aspecto más desconocido de la biología tumoral. El estrés oxidativo y la inflamación facilitan el crecimiento, la diseminación y el desarrollo de la denominada «cascada de invasión metastásica». La proteína Src estimula el crecimiento y la diseminación tumoral, especialmente en tumores triple negativos (TNBC), caracterizados por la ausencia de receptores a estrógenos y progesterona, y no sobreexpresión de HER240.
El estudio de los factores perioperatorios que podrían intervenir en la evolución del cáncer tras la cirugía de resección mamaria ha provocado un aumento del número y la calidad de ensayos clínicos, metaanálisis y estudios experimentales5. Sin embargo, tal como describe Wall34, la mayoría de las conclusiones de estos estudios no son extrapolables a la clínica. A partir del año 2019, disminuye el número de publicaciones, quizá debido al colapso mundial del sistema sanitario secundario a la pandemia de Covid-19, que ha influido negativamente tanto en la financiación, como en la posibilidad de recogida de datos.
La propia cirugía, la respuesta a la agresión quirúrgica, la anestesia, analgesia y algunos agentes específicos, influyen en la función inmune y la metástasis tumoral6 (tablas 2, 3 y 4). La paciente con cáncer es un reto para todos los profesionales que intervienen en su tratamiento, pues se deben tener en cuenta las características propias de la enfermedad (grado de extensión, tipo histológico, etc…) y los tratamientos empleados; para garantizar un manejo perioperatorio óptimo que garantice buenos resultados pronósticos41. Los anestésicos tienen capacidad para alterar la expresión de señales de reconocimiento de células cancerosas por el sistema inmune (como mutaciones p53), modificar la respuesta inmune del huésped; modular la respuesta al estrés o favorecer la angiogénesis. Estos factores podrían influir en los resultados oncológicos posquirúrgicos del cáncer de mama.
Mecanismos inmunosupresores de la cirugía y factores perioperatorios
| Mecanismo | Evidencias clínicas y experimentales |
|---|---|
| Estimulación de proliferación de células tumorales | Liberación de células tumorales: células tumorales circulantes (factor independiente para recurrencia). Permite la adhesión de células tumorales. Microambiente rico en ROSAumento de factores de crecimiento (local y sistémico)Respuesta adaptativa a la cirugía. Cambios del ambiente neural, endocrino, metabólico, inflamatorio e inmunológicoMetaloproteinasas (MMP). Estimulación de crecimiento tumoral y metástasis pulmonares en cáncer de mama (la anestesia regional asociada a propofol inhibe el efecto de la cirugía sobre los MMP en comparación con la anestesia general balanceada con opioides)Aumento de citoquinas proinflamatorias (IFN-α, IL-6) |
| Inhibición de respuesta inmune | Inmunosupresión perioperatoria16 (aparece en las primeras horas y de duración proporcional a la agresión): liberación de catecolaminas (respuesta endocrina al estrés, activación simpática y del eje hipotálamo-hipófiso-suprarrenal)Supresión de la actividad NK (proporcional a la extensión del trauma quirúrgico y a la intensidad de la respuesta al estrés) y disminución de células NK circulantesDisminución de células dendríticas, linfocitos T citotóxicos y T-helper. Disminución de la ratio Th1/Th2Liberación de mediadores de inflamación que inducen inmunosupresión, estimulan angiogénesis (VEFG, TGF-B), transición epitelio-mesenquimal (metaloproteinasas) y microambiente propicio para migración, invasión tisularMetaloproteinasas (MMP). Inhibición de funciones linfocitarias como la proliferación y producción de citoquinas que inducen apoptosis de linfocitos in vitro |
| Angiogénesis | Respuesta adaptativa a la cirugía. Aumento de vascularizaciónDisminución factores antiangiogénicos (angiostatina, endostatina)Hipoxia tisular. Aumento de angiogénesis tumoral |
Relación de los mecanismos inmunosupresores y anestésicos
| Mecanismo | Agente involucrado |
|---|---|
| Supresión de células NK y aumento de metástasis | Ketamina, tiopental, halotano |
| Sobrerregulación del factor inducible por la hipoxia (HIF) | Anestésicos inhalatorios |
| Inducción de apoptosis de células de cáncer de mama | Propofol |
| Estímulo de respuesta inmune y reducción de progresión tumoral en animales | Anestesia general combinada con analgesia/anestesia regional |
| Menor riesgo de metástasis, menor expresión del factor de crecimiento endotelial vascular (VEGF) y factor de crecimiento transformante (TGF-ß) | Anestesia general combinada con analgesia/anestesia regional |
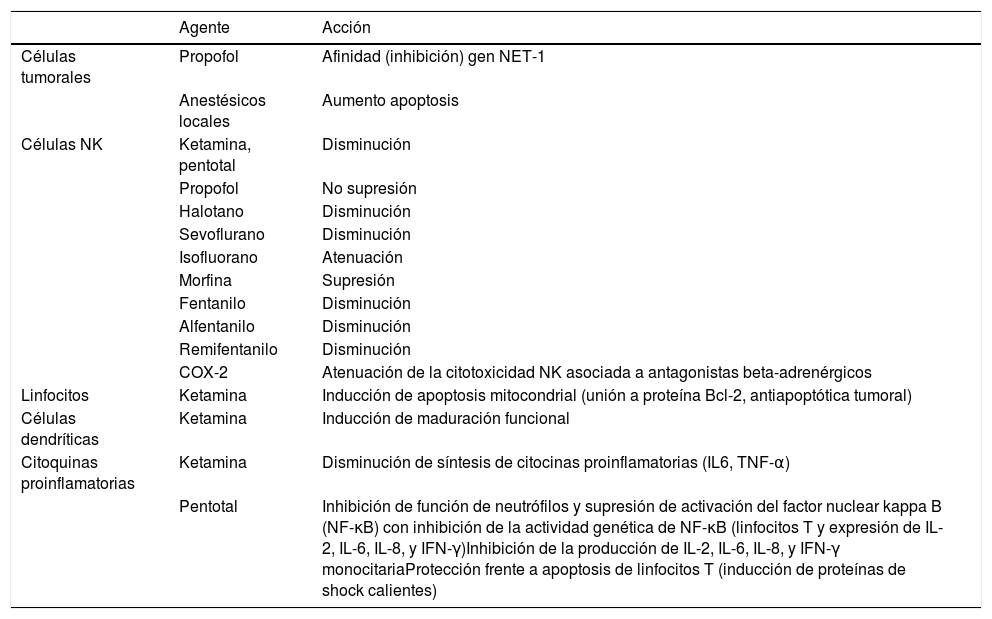
Mecanismos perioperatorios que influyen en la inmunidad celular, la proliferación tumoral y la aparición de metástasis
| Agente | Acción | |
|---|---|---|
| Células tumorales | Propofol | Afinidad (inhibición) gen NET-1 |
| Anestésicos locales | Aumento apoptosis | |
| Células NK | Ketamina, pentotal | Disminución |
| Propofol | No supresión | |
| Halotano | Disminución | |
| Sevoflurano | Disminución | |
| Isofluorano | Atenuación | |
| Morfina | Supresión | |
| Fentanilo | Disminución | |
| Alfentanilo | Disminución | |
| Remifentanilo | Disminución | |
| COX-2 | Atenuación de la citotoxicidad NK asociada a antagonistas beta-adrenérgicos | |
| Linfocitos | Ketamina | Inducción de apoptosis mitocondrial (unión a proteína Bcl-2, antiapoptótica tumoral) |
| Células dendríticas | Ketamina | Inducción de maduración funcional |
| Citoquinas proinflamatorias | Ketamina | Disminución de síntesis de citocinas proinflamatorias (IL6, TNF-α) |
| Pentotal | Inhibición de función de neutrófilos y supresión de activación del factor nuclear kappa B (NF-κB) con inhibición de la actividad genética de NF-κB (linfocitos T y expresión de IL-2, IL-6, IL-8, y IFN-γ)Inhibición de la producción de IL-2, IL-6, IL-8, y IFN-γ monocitariaProtección frente a apoptosis de linfocitos T (inducción de proteínas de shock calientes) |
COX: ciclooxigenasa; IL: interleucina; IFN: interferón; MMP: metaloproteinasas de matriz; NF: factor nuclear; NET: atrapamiento extracelular de neutrófilos; NK: natural killer; Th1: T-helper 1; Th2: T-helper 2; TGF: factor de crecimiento tumoral; VEGF: factor de crecimiento vascular endotelial.
La mayoría de los trabajos analizados describen los efectos de la anestesia general durante la cirugía en el pronóstico del cáncer, tanto por estimular la proliferación de células tumorales24, como por inhibir la respuesta inmune28 o promover angiogénesis36.
Estímulo de la proliferación tumoralEstudios retrospectivos y experimentales apoyan la participación de la anestesia sobre la supervivencia oncológica35. Se ha demostrado menor riesgo de recurrencia con anestesia regional y un efecto modulador de anestésicos inhalatorios con efectos negativos sobre los genes de las células cancerígenas de mama. El sevoflurano estimula la proliferación, la migración y la invasión de líneas celulares de cáncer de mama; mientras que el xenón inhibe la migración de células de adenocarcinoma mamario42. Sin embargo, estos efectos no son extrapolables a la clínica, pues Hovagimian et al.17 demostraron un recuento de células tumorales circulantes similar tras la anestesia con propofol o sevoflurano.
La proliferación de células tumorales puede estar influida por algunos anestésicos y analgésicos, que presentan sobreexpresión de receptores en tejidos tumorales (tabla 3). Estudios experimentales como el de Eden et al., han demostrado menor incidencia de metástasis pulmonar con propofol que con pentotal, ketamina o gas halotano en ratas10, atribuible a la inhibición del gen específico NET1 de células oncológicas de mama43.
La ketamina inhibe la apoptosis de células malignas por acción sobre la proteína Bcl-2, la morfina produce un aumento de la migración celular, y la naloxona presenta un papel inhibidor del crecimiento celular del cáncer de mama, tal como se demuestra en estudios in vitro44.
Otros fármacos como los alfa-agonistas (clonidina y dexmedetomidina), antiinflamatorios no esteroideos y antieméticos presentan actividad oncológica controvertida, pero efectos beneficiosos debidos a la menor necesidad de anestésicos y opioides, como demuestran Retsky et al.6 sobre 720 pacientes, a los que se administraba ketorolaco o diclofenaco intraoperatorio14.
La lidocaína inhibe la aparición de metástasis por varios mecanismos: inhibición de canales de sodio24, de la fosforilación de la proteína Src y la expresión de ICAM-1 en células tumorales39; demetilación del ácido deoxirribonucleico, inhibición del remodelado del citoesqueleto y de la migración celular45. Se ha demostrado un aumento de la caspasa 3 y de la proteína Bax, y una reducción de la proteína Bcl-28; así como la capacidad para reducir la capacidad migratoria de células neoplásicas en ratones y aumentar la apoptosis de células tumorales humanas por la activación de las caspasas 7, 8 y 946.
Inhibición de respuesta inmunitariaLa técnica anestésica y los opioides se han involucrado en la modificación de numerosas funciones inmunes sobre neutrófilos, macrófagos, células dendríticas, células T y células NK19, influyendo en los resultados oncológicos a largo plazo (tabla 5), que se han demostrado en estudios histológicos, como el de Levins et al.21. La distribución de los receptores opiodes tipo μ (MOR) en células NK podrían predecir el pronóstico del cáncer. Estos resultados están en concordancia con revisiones narrativas y documentos de consenso (grupo EuroPeriscope)14.
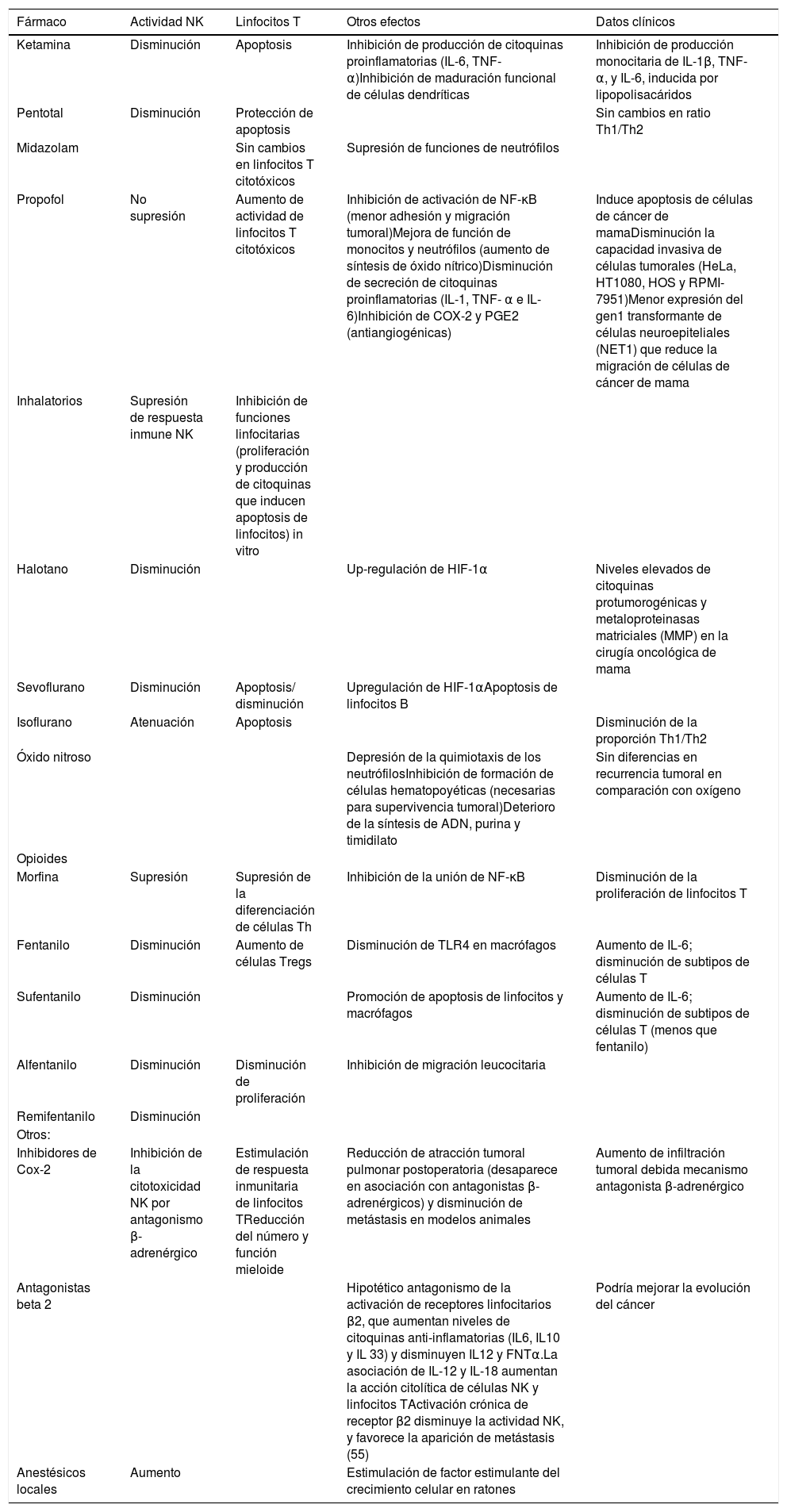
Efectos de los anestésicos sobre la función inmune
| Fármaco | Actividad NK | Linfocitos T | Otros efectos | Datos clínicos |
|---|---|---|---|---|
| Ketamina | Disminución | Apoptosis | Inhibición de producción de citoquinas proinflamatorias (IL-6, TNF-α)Inhibición de maduración funcional de células dendríticas | Inhibición de producción monocitaria de IL-1β, TNF-α, y IL-6, inducida por lipopolisacáridos |
| Pentotal | Disminución | Protección de apoptosis | Sin cambios en ratio Th1/Th2 | |
| Midazolam | Sin cambios en linfocitos T citotóxicos | Supresión de funciones de neutrófilos | ||
| Propofol | No supresión | Aumento de actividad de linfocitos T citotóxicos | Inhibición de activación de NF-κB (menor adhesión y migración tumoral)Mejora de función de monocitos y neutrófilos (aumento de síntesis de óxido nítrico)Disminución de secreción de citoquinas proinflamatorias (IL-1, TNF- α e IL-6)Inhibición de COX-2 y PGE2 (antiangiogénicas) | Induce apoptosis de células de cáncer de mamaDisminución la capacidad invasiva de células tumorales (HeLa, HT1080, HOS y RPMI-7951)Menor expresión del gen1 transformante de células neuroepiteliales (NET1) que reduce la migración de células de cáncer de mama |
| Inhalatorios | Supresión de respuesta inmune NK | Inhibición de funciones linfocitarias (proliferación y producción de citoquinas que inducen apoptosis de linfocitos) in vitro | ||
| Halotano | Disminución | Up-regulación de HIF-1α | Niveles elevados de citoquinas protumorogénicas y metaloproteinasas matriciales (MMP) en la cirugía oncológica de mama | |
| Sevoflurano | Disminución | Apoptosis/ disminución | Upregulación de HIF-1αApoptosis de linfocitos B | |
| Isoflurano | Atenuación | Apoptosis | Disminución de la proporción Th1/Th2 | |
| Óxido nitroso | Depresión de la quimiotaxis de los neutrófilosInhibición de formación de células hematopoyéticas (necesarias para supervivencia tumoral)Deterioro de la síntesis de ADN, purina y timidilato | Sin diferencias en recurrencia tumoral en comparación con oxígeno | ||
| Opioides | ||||
| Morfina | Supresión | Supresión de la diferenciación de células Th | Inhibición de la unión de NF-κB | Disminución de la proliferación de linfocitos T |
| Fentanilo | Disminución | Aumento de células Tregs | Disminución de TLR4 en macrófagos | Aumento de IL-6; disminución de subtipos de células T |
| Sufentanilo | Disminución | Promoción de apoptosis de linfocitos y macrófagos | Aumento de IL-6; disminución de subtipos de células T (menos que fentanilo) | |
| Alfentanilo | Disminución | Disminución de proliferación | Inhibición de migración leucocitaria | |
| Remifentanilo | Disminución | |||
| Otros: | ||||
| Inhibidores de Cox-2 | Inhibición de la citotoxicidad NK por antagonismo β-adrenérgico | Estimulación de respuesta inmunitaria de linfocitos TReducción del número y función mieloide | Reducción de atracción tumoral pulmonar postoperatoria (desaparece en asociación con antagonistas β-adrenérgicos) y disminución de metástasis en modelos animales | Aumento de infiltración tumoral debida mecanismo antagonista β-adrenérgico |
| Antagonistas beta 2 | Hipotético antagonismo de la activación de receptores linfocitarios β2, que aumentan niveles de citoquinas anti-inflamatorias (IL6, IL10 y IL 33) y disminuyen IL12 y FNTα.La asociación de IL-12 y IL-18 aumentan la acción citolítica de células NK y linfocitos TActivación crónica de receptor β2 disminuye la actividad NK, y favorece la aparición de metástasis (55) | Podría mejorar la evolución del cáncer | ||
| Anestésicos locales | Aumento | Estimulación de factor estimulante del crecimiento celular en ratones |
COX: ciclooxigenasa; IL: interleucina; IFN: interferón; MMP: metaloproteinasas de matriz; NF: factor nuclear; NK: natural killer; Th1: T-helper 1; Th2: T-helper 2; TGF: factor de crecimiento tumoral; VEGF: factor de crecimiento vascular endotelial.
Los anestésicos inhalatorios inhiben la respuesta inmunitaria, al suprimir la actividad NK e inducir apoptosis de linfocitos T19. Sin embargo, Oh no demuestra diferencias significativas en la inmunidad celular ni humoral tras la anestesia con propofol o sevoflurano29. Woo et al.47 demostraron un efecto favorable de desfluorano sobre leucocitos y células NK, preservando las interleucinas 2 y 4 y los CD4 y CD8, por lo que sería buena opción para la cirugía oncológica.
La anestesia reduciría la respuesta a la agresión quirúrgica atenuando la inmunosupresión secundaria. Vanni et al.33, demostraron un pico máximo de la concentración plasmática de leucocitos el primer día postoperatorio tras la cuadrantectomía de mama, que disminuían en caso de anestesia general, pero no se alteraba tras la anestesia local. Asimismo, Cho et al.9 demostraron menor actividad inmunosupresora sobre las células NK de propofol y ketorolaco, que sevoflurano y fentanilo.
El efecto de la anestesia regional como factor protector sobre la progresión tumoral de mama está en controversia. Exadaktylos et al.48, describieron mayor supervivencia libre de metástasis en 129 pacientes que recibieron resección mamaria con anestesia paravertebral (94%) que con morfina intravenosa (82%) al año y a los 36 meses (94 y 77%, respectivamente). Sin embargo, Karmakar et al.18 no encontraron diferencias en recurrencia, mortalidad ni metástasis tras mastectomía radical en 180 pacientes al asociar bloqueo paravertebral combinada con general frente a anestesia general. Finn et al.12 no demostraron diferencias significativas en la recurrencia tumoral a los 2 años en 60 pacientes mastectomizadas bajo anestesia paravertebral con ropivacaína o con suero fisiológico. Estudios retrospectivos posteriores, como el de Enlund et al.11 o Starnes-Ott et al.32, y metaanálisis, como el de Grandhi et al.16 o el ensayo clínico de Sessler et al.31, no demostraron diferencias significativas en supervivencia ni en recurrencias tumorales posquirúrgicas comparando anestesia general con sevoflurano y anestesia regional. Por su parte, Calí Cassi et al.7 apoyan la atenuación de la inmunosupresión humoral postoperatoria del bloqueo paravertebral.
Los bloqueos regionales actúan sobre la expresión tumoral de forma directa e indirecta. El bloqueo simpático inhibe la respuesta neuroendocrina al estrés quirúrgico (secundariamente, preservan las células T y aumentan las citoquinas antitumorogénicas, disminuyen los CRP y las células T reguladores circulantes). Los efectos antiinflamatorios de los anestésicos locales (menor concentración plasmática de citoquinas IL-6, IL-8, y IL-1Ra por lidocaína), la mejora de la función linfocitaria y la reducción del consumo de opioides, y por tanto, de la inmunosupresión asociada, contribuirían a los resultados oncológicos positivos39.
Los mecanismos de inmunosupresión de los opioides son múltiples: a) acción directa sobre receptores de células inmunes y sistema nervioso, demostrado en el estudio de Sacerdote49 (disminución del número de linfocitos tras administración de 10 mg de morfina), y b) acción indirecta, a través de la liberación de glucocorticoides por el eje hipotálamo-hipófisis-suprarrenal y liberación de noradrenalina por el sistema nervioso simpático, estudiado en pacientes en deshabituación con metadona y buprenorfina. Por el contrario, la naloxona, puede inhibir este efecto inmunosupresor43. Sin embargo, no se puede generalizar un efecto inmunosupresor a todos los opioides, tal como señalan Franchi et al.15.
El dolor también se ha relacionado con la progresión tumoral, pues suprime la actividad NK. El dolor activa el eje hipotálamo-hipófisis-adrenal y el sistema nervioso simpático, favoreciendo la inmunosupresión vía β-adrenérgica. En cambio, el bloqueo simpático inhibe la inmunosupresión quirúrgica, y la anestesia espinal preserva la función NK y de los linfocitos Th1 y 2. El manejo adecuado del dolor postoperatorio preserva la actividad NK a nivel experimental.
Acción sobre la angiogénesisLos anestésicos inhalatorios parecen inducir la angiogénesis secundaria a hipoxia (TNF-α), tal como demuestran Yan et al.36, al comparar las concentraciones séricas de VEGF-C and TGF-β, ambos proangiogénicos tras la cirugía oncológica de mama bajo anestesia intravenosa (propofol y remifentanilo) o inhalatoria (sevoflurano) en 80 pacientes. El xenón sería una buena opción como anestésico en la cirugía oncológica, dado que disminuye la liberación del factor RANTES (pro-angiogénico)43. Los opioides también modulan la angiogénesis, como demostraron los estudios de Sacerdote et al.49 y Bimonte et al.44, pues la morfina estimula la proliferación del endotelio, la supervivencia y la progresión del ciclo celular tanto en vivo como in vitro. Sin embargo, aunque dosis elevadas de opioides perioperatorios podrían influir en la progresión tumoral y algunos estudios retrospectivos sugieren peores resultados en neoplasias de mama, no se ha objetivado un efecto significativo en estudios prospectivos4. El estudio de Suzuki et al.50 demostró que la lidocaína (1–10 μg/ml) presenta un efecto inhibitorio de angiogénesis dosis-dependiente.
Otras accionesRecientemente se han descrito propiedades antiinflamatorias, antihiperalgésicas, inmunomoduladoras, antiarrítmicas y antibacterianas de los anestésicos locales; y una posible acción terapéutica contra el cáncer, por inhibir la proliferación, la invasión y la migración de las células tumorales16,39,50. La lidocaína actúa como quimiosensibilizador frente a cisplatino, 5-fluorouracilo, mitomicina C en células tumorales resistentes a quimioterapia y a dosis altas inhibe el crecimiento celular.
LimitacionesEsta revisión tiene muchas limitaciones, tanto metodológicas debido a la falta de estudios traslacionales o ensayos clínicos que faciliten la identificación de mecanismos específicos como la angiogénesis perioperatoria e interacciones neuroinmunes14. La mayoría de estudios están basados en estudios in vitro sobre una variable, y no reflejan la complejidad del periodo perioperatorio y del cáncer de mama. Tampoco se discrimina entre los numerosos factores pronósticos tanto anatomopatológicos, como de extensión o inmunohistoquímicos. Los estudios clínicos existentes no permiten establecer recomendaciones fuertes al no existir evidencia de calidad alta y haberse realizado en periodos de tiempo inferiores a la supervivencia tumoral (mayor de 10 años), tal como se señala en la reciente revisión realizada por Misair et al.27.
ConclusionesLa resección quirúrgica del cáncer de mama crea un ambiente favorable para su crecimiento y diseminación. Aunque no se ha descrito la técnica anestésica-analgésica óptima en cuanto a resultados oncológicos y de recuperación postoperatoria34, la evidencia disponible es favorable a una anestesia multimodal basada en propofol asociado a anestésicos locales y antiinflamatorios50, pues el propofol se asocia con mayor supervivencia en los pacientes con cáncer tanto primario como metastásico6; y los anestésicos locales y la anestesia regional inhibe la inflamación, la inmunosupresión y la angiogénesis4. A pesar de la falta de evidencia clínica, se recomienda evitar la utilización de óxido nitroso y sevofluorano en la cirugía oncológica de mama.
A pesar de la creciente investigación sobre el tema, siguen siendo necesarios ensayos clínicos multicéntricos que analicen por separado cada factor pronóstico del cáncer de mama, estudiando de forma independiente los factores histológicos, anatomopatológicos y de extensión asociados con la agresividad oncológica, teniendo en cuenta la supervivencia de cada tipo tumoral.
Consideraciones éticasEl presente estudio ha sido realizado de acuerdo con las guías sobre ética en publicaciones científicas, en consonancia con los principios de la declaración de Helsinki y siguiendo las normas de buena práctica clínica. Revisión sistemática siguiendo protocolo PRISMA y registrada en PROSPERO (https://www.crd.york.ac.uk/PROSPERO/) con número CRD42021227297. Al tratarse de una revisión sistemática de la literatura, no se consideró necesaria la aprobación por el Comité Ético local.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.