El paraquat es un herbicida utilizado ampliamente en la agricultura. Debido a su gran distribución y uso inadecuado, representa un problema grave de contaminación del suelo y el agua. Se ha encontrado que los hongos de la podredumbre blanca son capaces de degradar compuestos contaminantes que poseen estructuras similares a la lignina, como es el caso del paraquat. En el presente trabajo se evaluó la degradación de este herbicida y su efecto en la producción de enzimas ligninolíticas por parte de algunos hongos de la podredumbre blanca aislados del sur de México. Seis cepas fúngicas mostraron tolerancia al herbicida durante el cultivo en medio sólido. Tres de las 6 cepas evaluadas, correspondientes a las especies Polyporus tricholoma, Cilindrobasidium laeve y Deconica citrispora, mostraron niveles de degradación del 32, el 26 y el 47%, en ese orden, a los 12 días de cultivo en presencia del xenobiótico. Se detectó un incremento en las actividades de las enzimas lacasa y Mn-peroxidasa en las cepas que presentaron el mayor porcentaje de degradación, probablemente asociado a la disminución del herbicida. Adicionalmente, se realizaron ensayos con extractos enzimáticos procedentes del medio de cultivo extracelular de las 2 cepas que presentaron mayor degradación. Después de 24 h de incubación, se obtuvo una degradación del 49% del paraquat inicial con los extractos de D. citrispora. Los resultados obtenidos indican que la degradación del herbicida estaría asociada a la presencia de enzimas extracelulares en los hongos de la podredumbre blanca. En este trabajo se muestran las primeras evidencias del potencial de biodegradación de diferentes especies de hongos de la pudrición blanca.
Paraquat is a widely used herbicide in agriculture. Its inappropriate use and wide distribution represents a serious pollution problem for soil and water. White rot fungi are capable of degrading pollutants having a similar structure to that of lignin, such as paraquat. This study evaluated the degradation effect of paraquat on the production of ligninolytic enzymes by white rot fungi isolated from the South of Mexico. Six fungal strains showed tolerance to the herbicide in solid culture. Three of the six evaluated strains showed levels of degradation of 32, 26 and 47% (Polyporus tricholoma, Cilindrobasidium laeve and Deconica citrispora, respectively) after twelve days of cultivation in the presence of the xenobiotic. An increase in laccase and manganese peroxidase (MnP) activities was detected in the strains showing the highest percentage of degradation. Experiments were done with enzyme extracts from the extracellular medium with the two strains showing more degradation potential and enzyme production. After 24hours of incubation, a degradation of 49% of the initial paraquat concentration was observed for D. citrispora. These results suggest that paraquat degradation can be attributed to the presence of extracellular enzymes from white rot fungi. In this work the first evidence of the biodegradation potential of D. citrispora and Cilindrobasidium leave is shown.
Las prácticas agrícolas son una de las principales actividades responsables de la liberación de sustancias contaminantes al ambiente15, dentro de ellas, los herbicidas son los plaguicidas más utilizados40. El paraquat (1,1’-dimetil-4,4’-bipiridilo) es un herbicida no selectivo y no sistémico que actúa sobre el fotosistema i, específicamente en el cloroplasto. Primero ocasiona la formación de radicales libres y, posteriormente, reacciona con el oxígeno y produce radicales superóxido, los cuales fragilizan y desintegran los tejidos y las membranas de las células47. El paraquat se utiliza para el control de la maleza en la producción de café, cacao, coco, aceite de palma, caucho, banano, papaya, mango, maíz y caña de azúcar, entre otros.
El paraquat es altamente persistente y se inactiva por completo al entrar en contacto con el suelo, por lo que se almacena en este. Se ha comprobado que en suelos turbosos anaerobios, el tiempo de desintegración media (TD50) puede alcanzar hasta 7,2 años; en suelos aerobios, 1,2 años, y en suelos arenosos aerobios, 2,6 años. Este herbicida es nocivo para todos los seres vivos; en humanos se absorbe por contacto y ocasiona lesiones en los tejidos expuestos, como resequedad y fisuras. Una exposición prolongada puede causar incluso ampollas y ulceraciones en la piel. También puede entrar al organismo por vía digestiva e inhalación y originar congestión, edema en los pulmones y, en ocasiones, la muerte37.
Un método ecológico y viable de biorremediación de este tipo de compuestos es el uso de macromicetos, el cual aprovecha la capacidad metabólica de estos agentes para transformar o mineralizar contaminantes orgánicos y compuestos recalcitrantes en sustancias menos peligrosas4,30.
Los hongos de la podredumbre blanca (HPB) han sido los más estudiados6, ya que son reconocidos por su capacidad para metabolizar una amplia variedad de compuestos orgánicos persistentes1,2,13,19,21,24,28,35,39,44,46 y por demostrar una elevada capacidad degradativa, debido a que toleran altas concentraciones de contaminantes11,33.
Los HBP han desarrollado un sistema enzimático extracelular único y no específico, que permite la degradación total de los componentes químicos y estructurales de la madera. Tienen la capacidad de sintetizar enzimas como la lacasa, la manganeso peroxidasa y la lignina peroxidasa (LiP)8,12. Otras enzimas implicadas en este proceso son las del tipo oxidasas, como la aril alcohol oxidasa y la glioxal oxidasa, que generan H2O25,26.
Estos hongos han sido efectivos en la degradación de contaminantes ambientales peligrosos. Por ejemplo, Trametes versicolor degradó en 36h de incubación el 46 y el 65% de fenantreno (100mg/l) en cultivo agitado o estático, respectivamente14. Trametes maxima y Ganoderma zonatum fueron capaces de degradar el 99 y el 73% de DDT, respectivamente7, y un extracto crudo de enzimas de Pleurotus djamor degradó el 90,39% del tinte Direct Blue 14 en 6h de incubación41.
Otros métodos que se utilizan para la remoción de contaminantes son los tratamientos químicos, en los cuales se utilizan agentes oxidantes como el ozono (O3) o el peróxido de hidrogeno (H2O2), la radiación UV, el reactivo de Fenton y el sistema foto-Fenton3,17,27,34. Sin embargo, los elevados costos, la baja eficiencia y la generación de nuevos compuestos contaminantes hacen que estas técnicas sean alternativas poco útiles en términos prácticos.
La degradación del paraquat por organismos ha sido poco estudiada, el único reporte en la literatura para la remoción de este compuesto menciona el uso de la bacteria Pseudomonas putida, con un 47,29% de degradación y de hasta un 95% en presencia de carbón activado23.
El objetivo de este trabajo fue evaluar la capacidad de 6 especies de hongos de la pudrición blanca para degradar el herbicida paraquat y analizar la influencia de este compuesto en la producción de enzimas ligninolíticas por parte de estos hongos.
Materiales y métodosMaterial biológicoSe emplearon 8 cepas de HPB depositadas en la colección micológica de ECOSUR (Tapachula, Chiapas, México): Polyporus tricholoma (ECS-58), Phellinus gilvus (ECS-61), P. tricholoma (ECS-64), Deconica citrispora (ECS-77), Gymnopus barbipes (ECS-85), Cyathus olla (ECS-86), Cylindrobasidium laeve (ECS-91) y Grifola frondosa (ECS-703). Se cultivaron en placas de Petri con agar extracto de malta (EMA) y se mantuvieron a 28°C hasta la colonización completa de la caja.
Determinación de la tasa de extensión radial de los HPB en medio con paraquatPara determinar la tasa de extensión radial (TER) de los HPB, se colocó un disco de agar con micelio (5mm de diámetro) en el centro de una placa de Petri (9cm de diámetro) con medio mínimo de sales y peptona (MMSP: fosfato monobásico de potasio 5g/l, sulfato de magnesio 0,4g/l, sulfato de amonio 10g/l, cloruro de sodio 10g/l, peptona de caseína 2g/l, dextrosa 1g/l y agar bacteriológico 16g/l) adicionado con paraquat (esterilizado con filtro de jeringa marca Acrodisc® Syringe tamaño de poro 0,2μm), a una concentración de 0, 50, 150, 250, 350, 450 y 550mg/l. Se realizaron 3 réplicas por tratamiento y se mantuvieron en incubación a 28°C. Para obtener la TER se midió el crecimiento micelial diariamente utilizando un vernier (Mitutoyo®±0,05mm, Japón) hasta la colonización completa de la caja. La tolerancia de los HPB al paraquat se determinó sobre la base de la ausencia o la presencia del crecimiento micelial a las distintas concentraciones del herbicida.
Para el cálculo de la concentración mínima inhibitoria (CMI), se determinó la concentración más alta a la cual se observó crecimiento. Las cantidades de paraquat aplicadas en los experimentos posteriores se determinaron tomando en cuenta la mitad de la CMI. También se calculó el porcentaje de inhibición del crecimiento mediante la fórmula ([DCC – DCT]/DCC)×100, donde DCC fue el diámetro de la colonia control (sin paraquat) y DCT el del diámetro de la colonia tratada.
Cultivos de HPB en medio líquido con paraquatPara los ensayos de degradación del paraquat se prepararon preinóculos de las cepas que se mostraron tolerantes agregando 8 discos de agar con micelio (5mm de diámetro) a 3 matraces con 30ml de medio líquido EMA. Estos se mantuvieron a 28° C y 125rpm durante 2,5 días en el caso de C. laeve ECS-91, 5 días en el de P. tricholoma ECS-58, 6 días en el de P. tricholoma ECS-64 y 13,5 días en el de D. citrispora ECS-77. A estos tiempos, el cultivo de cada cepa se encuentra a la mitad de la fase exponencial del crecimiento. Transcurridos esos tiempos, el micelio producido en los matraces se filtró (bajo condiciones asépticas) y se trituró en 30ml de agua destilada estéril hasta obtener una suspensión homogénea.
Posteriormente, se utilizó 1ml de esas suspensiones para inocular matraces Erlenmeyer con 30ml de MMSP, los que se mantuvieron en agitación a 125rpm y 28°C durante todo el experimento. Después de 3 días de incubación, se agregó el paraquat a una concentración de 25mg/l en los cultivos de C. laeve ECS-91 y de D. citrispora ECS-77, y de 75mg/l en los cultivos de P. tricholoma ECS-58 y ECS-64. Estas concentraciones se determinaron luego de calcular las CMI a partir de los experimentos de TER. Se realizaron muestreos por triplicado a los 3, 6, 9, 12 y 15 días posteriores a la inoculación. Se utilizaron 2 testigos: medio de cultivo sin inocular y el cultivo del hongo inactivado por esterilización, ambos con las mismas concentraciones de paraquat a las que se expuso cada cepa. Todas las muestras fueron filtradas (filtros Whatman, grado 6) y centrifugadas (5000rpm durante 10 min) a 4°C. El micelio filtrado se utilizó para la determinación de la biomasa mediante la medida del peso seco y el sobrenadante se utilizó para determinar la concentración de paraquat y la actividad de las enzimas lacasa, manganeso-peroxidasa, lignina-peroxidasa, aril alcohol oxidasa y peroxidasa versátil (PVer).
Determinación del paraquatPara determinar la concentración del paraquat se utilizó glucosa como agente reductor, según lo descrito en el método de Kesari et al.22, con algunas modificaciones: se emplearon 2ml de H2O, 0,5ml de solución reductora y 0,5ml de muestra. La mezcla de reacción se calentó en baño maría a 70°C durante 5 min y se midió la absorbancia a 600nm.
Actividad enzimáticaLa actividad lacasa (Lac) se determinó utilizando una mezcla de reacción con 2,6-dimetoxifenol (DMP) 50mM en solución amortiguadora de acetato sódico 200mM pH 5, H2O y extracto enzimático. La oxidación del DMP fue monitorizada por el incremento de la absorbancia a 469nm durante 2min (¿ 469=49.600 1/M.cm)43.
La actividad aril alcohol oxidasa (AAO) se determinó mediante la oxidación del alcohol veratrílico 25mM en solución tampón de fosfato sódico 500mM pH 6, H2O y extracto enzimático. La reacción se monitorizó por 2min a una absorbancia de 310nm (¿ 310=9.300 1/M.cm)31.
La actividad manganeso-peroxidasa (MnP) se determinó utilizando una mezcla de reacción con sulfato manganoso tetrahidratado (MnSO4 4H2O) 20mM en solución amortiguadora de malonato sódico 100mM pH 4,5, H2O2 10mM, H2O y extracto enzimático. La oxidación se midió por espectrofotometría durante 1min a una absorbancia de 270nm (¿ 270=1.159 1/M.cm)48.
La LiP se midió usando solución de reacción con alcohol veratrílico 50mM en una solución amortiguadora de tartrato de sodio 200mM pH 3, H2O2 100mM, H2O y extracto enzimático. El cambio de absorbancia se monitorizó a 310nm (¿ 310=9.3001/M.cm) durante 2 min42.
Por último, la actividad PVer se determinó mediante la oxidación del reactivo black 5 1mM en solución amortiguadora de malonato de sodio 200mM pH 3, H2O2 10mM, H2O y extracto enzimático. Se monitorizó el cambio de absorbancia a 598nm (¿ 598=30.000 1/M.cm) durante 5 min36.
En todos los casos, una unidad enzimática (U) fue definida como la cantidad de enzima requerida para la transformación de 1μmol de sustrato por minuto.
Degradación del paraquat en medio de cultivo libre de células (MCLC)Para los ensayos de degradación del paraquat con MCLC se prepararon preinóculos de las cepas que mostraron mayor degradación del compuesto y mayor actividad enzimática, tal como se describe en el apartado anterior. Estos preinóculos se mantuvieron a 28°C, en agitación constante a 125rpm durante 5 (P. tricholoma ECS-58) o 13,5 días (D. citrispora ECS-77). Transcurridos esos tiempos, el micelio producido en los matraces se filtró (bajo condiciones asépticas) y trituró en 30ml de agua destilada estéril hasta obtener una suspensión homogénea. Posteriormente, se utilizó 1ml de estas suspensiones para inocular matraces Erlenmeyer con 30ml de medio Kirk. El material fue colocado en agitación (125rpm a 28°C en un cuarto de incubación) durante 5 o 13,5 días, según se indicó anteriormente. Luego se procedió a filtrar (filtros Whatman, grado 6) cada uno de los caldos de cultivo para obtener el MCLC. A cada matraz se le agregó 50mg/l de paraquat y se mantuvieron en agitación a 125rpm y 28°C durante 24h. Se midió la degradación del compuesto cada 3h por el método de Kesari et al.22.
Diseño experimentalSe utilizó un diseño completamente al azar. Todos los experimentos fueron realizados por triplicado, bajo las mismas condiciones. Para los análisis estadísticos se utilizó el software IBM SPSS Statistics 23. En todos los casos se realizó un ANOVA multivariado o unifactorial, y los datos se analizaron mediante una comparativa entre la prueba de Tukey y la prueba de Bonferroni, ambas con un nivel de significación de 0,05.
ResultadosCrecimiento e inhibición a diferentes concentraciones de paraquatPara determinar el efecto del paraquat sobre el crecimiento de los HPB, estos se sembraron en un medio adicionado con diferentes concentraciones del herbicida y se midió la TER. Los hongos P. gilvus ECS-61, G. barbipes ECS-85, C. olla ECS-86 y G. frondosa ECS-703 no crecieron en ninguna de las concentraciones de paraquat a las que fueron sometidos. Por otro lado, las cepas que presentaron tolerancia al herbicida fueron D. citrispora ECS-77 y C. laeve ECS-91, las cuales tuvieron crecimiento en presencia de 50mg/l del herbicida, y P. tricholoma ECS-58 y ECS-64, que lo hicieron a 150mg/l.
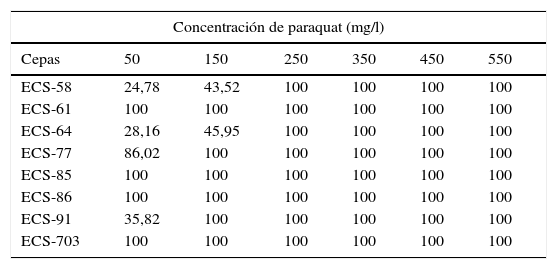
En la tabla 1 se muestra el porcentaje de inhibición del crecimiento de cada cepa de HPB a diferentes concentraciones del paraquat. El resultado que se muestra es la media de 3 experimentos independientes.
Inhibición del crecimiento (%) de diversos aislados de HPB en medio EMA con paraquat
| Concentración de paraquat (mg/l) | ||||||
|---|---|---|---|---|---|---|
| Cepas | 50 | 150 | 250 | 350 | 450 | 550 |
| ECS-58 | 24,78 | 43,52 | 100 | 100 | 100 | 100 |
| ECS-61 | 100 | 100 | 100 | 100 | 100 | 100 |
| ECS-64 | 28,16 | 45,95 | 100 | 100 | 100 | 100 |
| ECS-77 | 86,02 | 100 | 100 | 100 | 100 | 100 |
| ECS-85 | 100 | 100 | 100 | 100 | 100 | 100 |
| ECS-86 | 100 | 100 | 100 | 100 | 100 | 100 |
| ECS-91 | 35,82 | 100 | 100 | 100 | 100 | 100 |
| ECS-703 | 100 | 100 | 100 | 100 | 100 | 100 |
Las cepas D. citrispora ECS-77 y C. laeve ECS-91 crecieron únicamente en presencia de 50mg/l del herbicida y mostraron un porcentaje de inhibición del 86 y el 35,8%, respectivamente, mientras que las cepas de P. tricholoma ECS-58 y ECS-64 crecieron con hasta 150mg/l del herbicida, y tuvieron un 43,5 y un 45,9% de inhibición, respectivamente.
Las cepas P. gilvus ECS-61, G. barbipes ECS-85, C. olla ECS-86 y G. frondosa ECS-703 presentaron un 100% de inhibición en todas las concentraciones, por lo tanto, no se utilizaron en los ensayos de degradación posteriores.
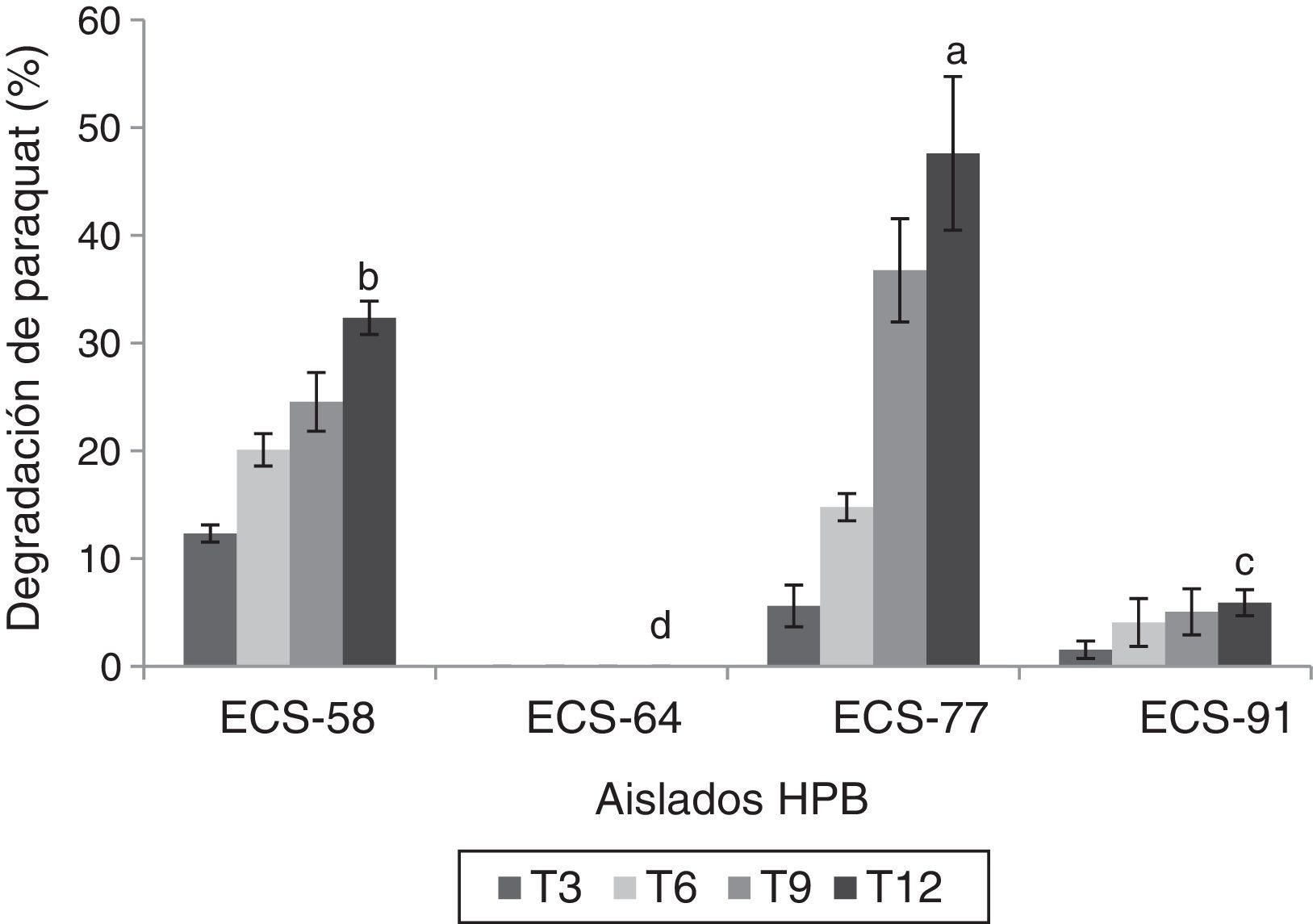
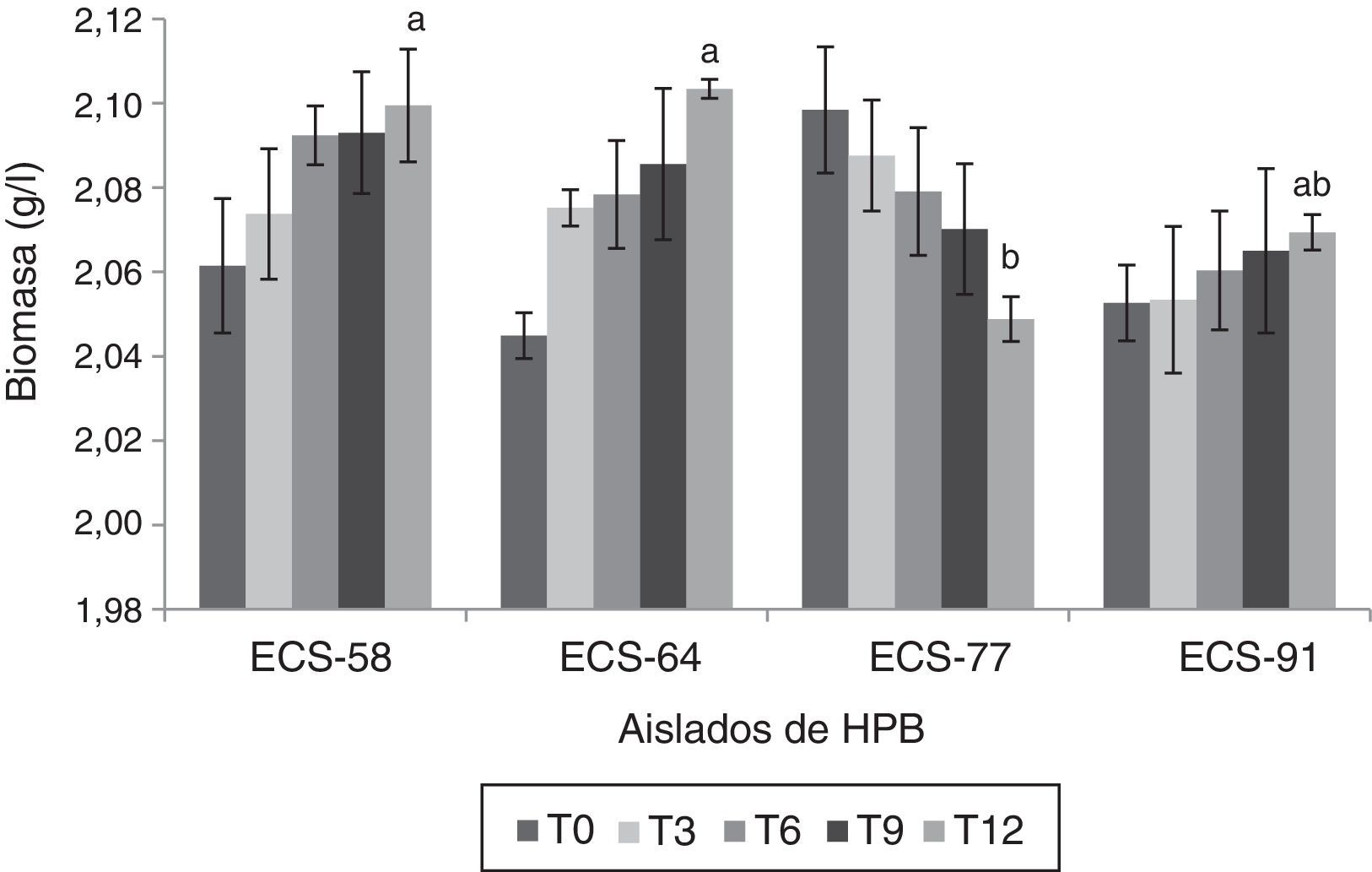
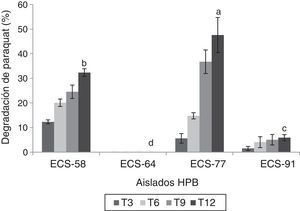
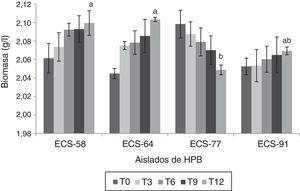
Ensayos de degradación del paraquat por HPB en medio líquidoLas cepas que mostraron los mayores porcentajes de degradación del herbicida fueron P. tricholoma ECS-58 (32,3%) y D. citrispora ECS-77 (47,6%); esta última tasa de degradación se logró a los 12 días de cultivo. La cepa ECS-64, que también corresponde a P. tricholoma no presentó degradación durante el cultivo (fig. 1). También se analizaron en las cepas seleccionadas los valores de producción de biomasa durante 12 días de cultivo. La cepa D. citrispora ECS-77 presentó una pérdida de biomasa de 1,6±0,1g/l hacia el día 12 de cultivo, siendo la cepa con menor de biomasa al día 12(p>0,05). Las cepas P. tricholoma ECS-58 y ECS-64 mostraron los valores de biomasa más altos, sin diferencias significativas entre ellas según la prueba de Tukey (fig. 2). En ambos controles utilizados (medio de cultivo sin inocular y micelio inactivado por esterilización) la cantidad de paraquat en el medio permaneció constante (datos no mostrados), lo cual confirma que no hubo evaporación del paraquat ni adherencia del compuesto al micelio.
Degradación de paraquat (%) por HPB cultivados en medio líquido a 26-28°C, 125rpm, partiendo de concentraciones de 25ppm (ECS-77, ECS-91) y 75ppm (ECS-58, ECS-64). Se ajustó un modelo polinomial y se realizó una comparación múltiple basada en la prueba de Tukey. Letras diferentes en cada barra indican diferencias significativas entre cepas en el día 12 (p<0,05).
Producción de biomasa de HPB durante la degradación de herbicida paraquat después de 12 días de incubación a 26-28°C en cultivo líquido, a 125rpm. Se ajustó un modelo polinomial y se realizó una comparación múltiple basada en la prueba de Tukey. Letras diferentes en cada barra indican diferencias significativas entre cepas en el día 12 (p<0,05). El análisis estadístico se realizó para todos los tiempos en todas las cepas; solo se muestra el análisis del tiempo 12.
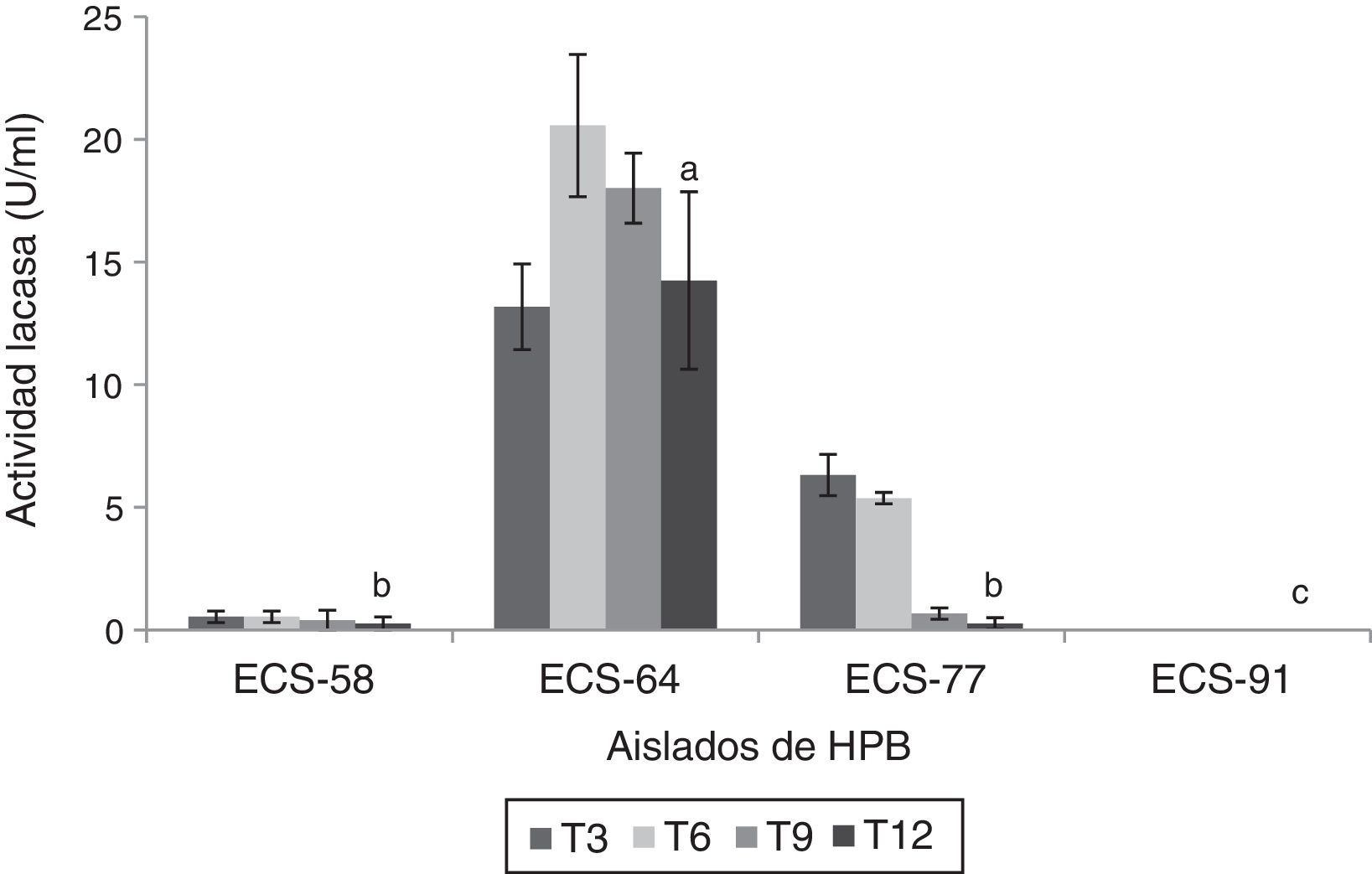
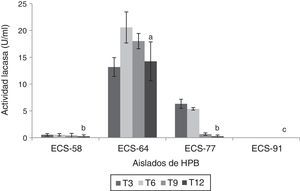
Se encontró actividad Lac durante los ensayos de degradación en la mayoría de los extractos enzimáticos, con excepción del de la cepa C. laeve ECS-91. El extracto enzimático de la cepa ECS-64 de P. tricholoma presentó los valores más altos de actividad a los 6 días de incubación (20,56 U/ml) (p<0,05) (fig. 3).
Actividad lacasa del extracto enzimático de HPB en medio líquido en presencia de paraquat, a 26-28°C y 125rpm. Se ajustó un modelo polinomial y se realizó una comparación múltiple basada en la prueba de Tukey. Letras diferentes en cada barra indican diferencias significativas entre cepas en el día 12 (p<0,05).
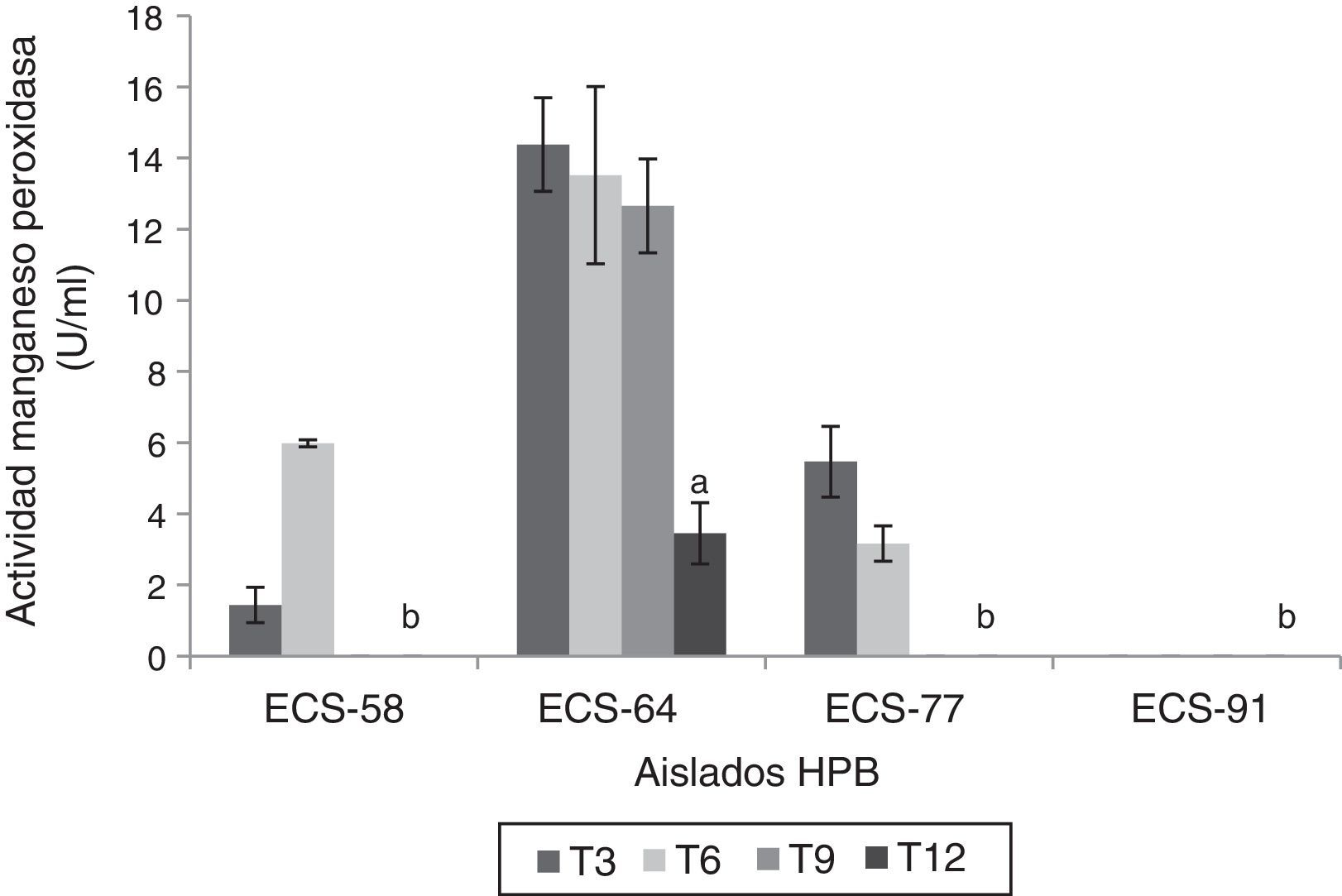
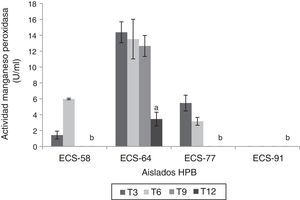
Las cepas P. tricholoma ECS-64 y D. citrispora ECS-77 mostraron valores de actividad de MnP significativamente más altos que las demás cepas (p<0,05) a los 3 días de incubación, con 14,38 U/ml y 5,46 U/ml, respectivamente. C. laeve ECS-91 no presentó actividad MnP (fig. 4). Ninguna de las cepas analizadas presentó actividad AAO, LiP ni PVer.
Actividad manganeso peroxidasa del extracto enzimático de HPB en medio líquido en presencia de paraquat, a 26-28°C, 125rpm. Se ajustó un modelo polinomial y se realizó una comparación múltiple basada en la prueba de Tukey. Letras diferentes en cada barra indican diferencias significativas entre cepas en el día 12 (p<0,05).
Sobre la base de los resultados anteriores, se decidió evaluar en los siguientes ensayos únicamente los sobrenadantes libres de células de P. tricholoma ECS-58 y D. citrispora ECS-77, las cuales disminuyeron la concentración del herbicida paraquat durante los 12 días de crecimiento y mostraron al menos una de las actividades enzimáticas evaluadas (lacasa y manganeso peroxidasa) en su extracto celular.
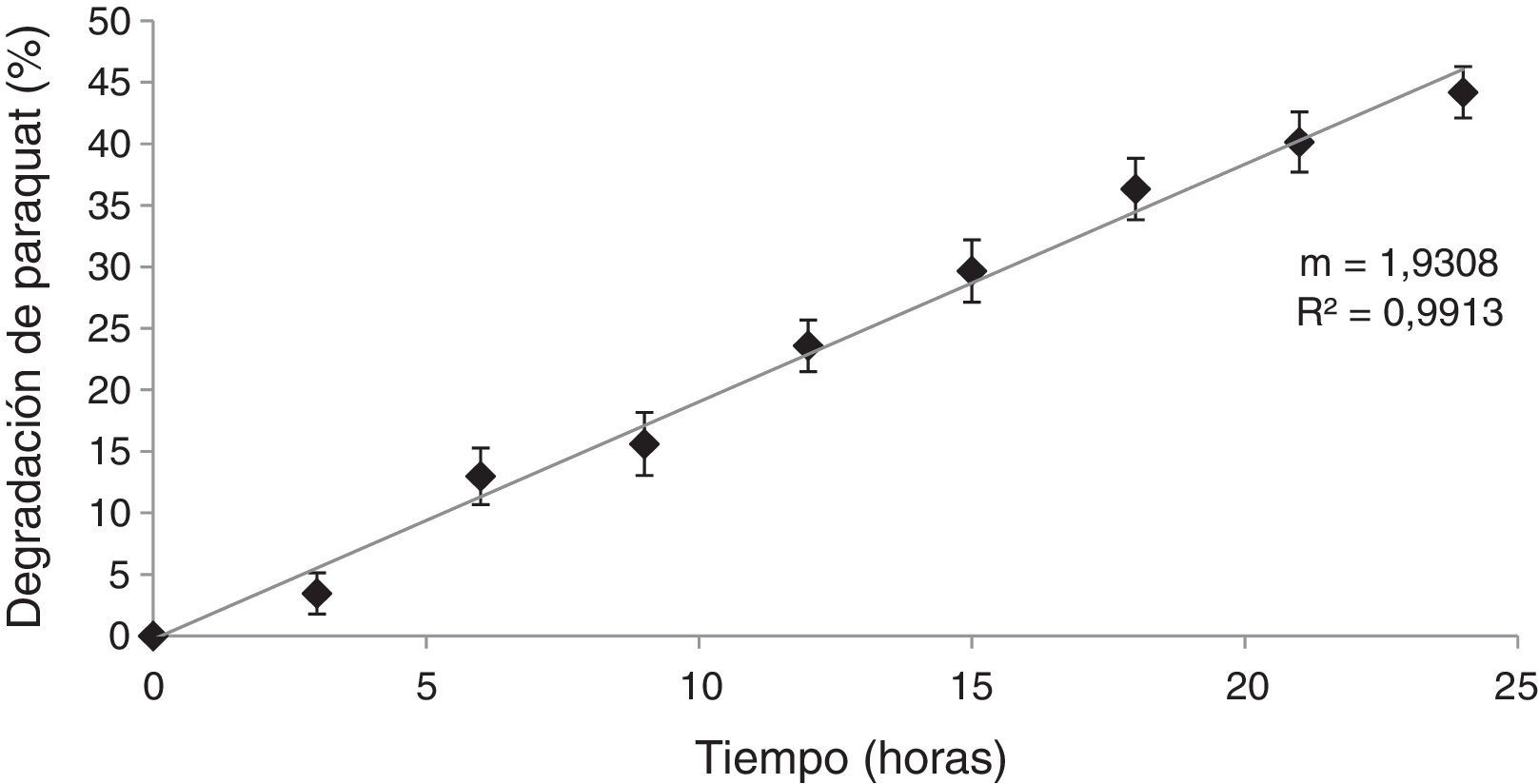
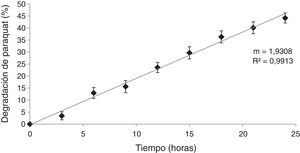
Ensayos de degradación del herbicida paraquat por HPB en MCLCPara demostrar que la disminución del paraquat se debió a la producción de enzimas extracelulares y no a la internalización del compuesto en las células del hongo, se realizó el ensayo de degradación con el MCLC. Los resultados obtenidos (fig. 5) muestran que con el MCLC de D. citrispora ECS-77 se produjo degradación del paraquat, con un valor máximo de compuesto degradado del 44,1% a las 24 h de incubación (p<0,05), y una velocidad de degradación de 1,930/t (r=0,99). Por el contrario, el MCLC de P. tricholoma ECS-58 no presentó degradación de paraquat (datos no mostrados).
DiscusiónLa primera fase de este trabajo consistió en seleccionar cepas de HPB que fueran tolerantes al paraquat. En esta investigación, el crecimiento micelial se vio afectado en la mayoría de las cepas evaluadas a las concentraciones de paraquat elegidas. Cuatro de las 8 cepas empleadas no toleraron ninguna de las concentraciones. Las 4 cepas restantes lograron crecer a 50, 100 y 150mg/l. La mayor concentración reportada en ensayos de degradación realizados en el laboratorio del herbicida paraquat es de 100ppm23.
Nuestros resultados se asemejan a los reportados por Tortella et al.45, quienes evaluaron la tolerancia de 11 cepas de HPB nativas de Chile al 2,4-diclorofenol, ya que el 100% de esos aislados toleraron 25mg/l, pero únicamente el 64% de ellos fue tolerante a 50mg/l. A las concentraciones más altas no se observó crecimiento de los aislados. En este sentido, se puede resaltar que el comportamiento de los aislados de nuestro trabajo fue semejante a los del estudio recién citado, ya que al aumentar la concentración del compuesto el crecimiento micelial se vio inhibido en ambos casos.
Las 4 cepas que fueron medianamente tolerantes al paraquat (D. citrispora ECS-77 y C. laeve ECS-91, que pudieron crecer en presencia de 50mg/l del herbicida, y P. tricholoma ECS-58 y ECS-64, que pudieron crecer hasta con 150mg/l) se seleccionaron para evaluar sus actividades enzimáticas y su capacidad para degradar dicho herbicida cuando este se encuentra a la mitad de la concentración máxima que lograron tolerar.
Una de esas 4 cepas no degradó el herbicida, las otras 3 lograron niveles de degradación que fueron desde el 25% hasta el 50%. Similar degradación se observó en el caso del fenantreno por la lacasa de T. versicolor, donde se obtuvo un 35% de degradación del compuesto en 72h de cultivo20. En ese mismo estudio se evaluó el uso de mediadores rédox como agentes que aceleran la biodegradación del compuesto, utilizando ácido 2,2’-azino-bis-(3-etillbenzotiazolin-6-sulfonico) (ABTS) y 1-hidroxybenzotriazol (HTB); estos llevaron a incrementos de hasta el 40% en la degradación del fenantreno.
Para trabajos futuros, puede ser de importancia el uso de mediadores rédox para intentar mejorar los porcentajes de degradación de paraquat. Los resultados obtenidos en esta investigación se asemejan al informado respecto de la bacteria P. putida, la cual logró una degradación del 47,3% de Gramoxone® Syngenta, nombre de la fórmula comercial del paraquat. Las tasas de degradación aumentaban considerablemente (97%) con el uso de carbón activado, el cual absorbe gran parte del compuesto23.
Pizzul et al.32 evaluaron la degradación de glifosato con las enzimas lacasa y manganeso peroxidasa en ausencia de mediadores rédox y demostraron que las enzimas por sí solas no tienen ningún efecto sobre el herbicida. Cuando los mediadores MnSO4 y Tween 80 se añadieron a la reacción en la que se evaluó la actividad de la lacasa, se obtuvo hasta un 80% de degradación en 24h, mientras que se observó un 100% de degradación cuando se incluyeron en la mezcla de reacción en la que se determinó la actividad de la manganeso-peroxidasa esos mismos mediadores o H2O2.
Las 3 cepas que presentaron la mayor degradación de paraquat corresponden a especies poco estudiadas en el ámbito de la biodegradación de recalcitrantes. De P. tricholoma existe un reporte de decoloración de remazol brillante R Blue25. Es importante mencionar que 2 de las 3 cepas con las que se obtuvo mayor degradación de paraquat no habían sido evaluadas anteriormente como potenciales biodegradadoras, por lo tanto, este es el primer reporte de la utilización de D. citrispora y C. laeve para este fin.
Además, se registró la producción de biomasa de cada una de las cepas de HPB durante la degradación bajo las condiciones de cultivo establecidas. D. citrispora ECS-77 mostró disminución de su biomasa durante la degradación; sin embargo, obtuvo el porcentaje de degradación más alto tras 12 días de cultivo (fig. 2). Por tanto, podemos proponer que la degradación del compuesto no depende directamente del crecimiento del hongo, sino de la secreción de enzimas extracelulares por parte de aquel. En un estudio previo se encontró que el aumento de la actividad enzimática lacasa es inversamente proporcional a la producción de biomasa en presencia del herbicida paraquat17.
Los HPB P. tricholoma ECS-58 y D. citrispora ECS-77 en el cultivo con paraquat mostraron aumentos en la actividades enzimáticas Lac, y MnP durante los 12 días de crecimiento. Cuando el hongo creció en presencia de paraquat, se notó un aumento en la actividad enzimática del día 3 al 12. Se ha reportado que la presencia de diferentes contaminantes ambientales (agroquímicos, compuestos industriales y solventes) ocasionan aumento de la actividad Lac del hongo T. versicolor29. El incremento de la actividad puede deberse a que los compuestos actúan como inductores de la producción enzimática.
En las cepas P. tricholoma ECS-58 y D. citrispora ECS-77 se detectó la enzima MnP. Diversos trabajos de investigación asocian la baja o nula actividad de enzimas ligninolíticas de tipo peroxidasas a las condiciones de crecimiento o a la composición del medio de cultivo, que no favorecería la secreción de las enzimas en el medio extracelular38,50.
La composición de las enzimas constituyentes del sistema ligninolítico depende de cada especie; algunos hongos de pudrición degradan selectivamente la lignina, por tanto, estas especies carecen de una o más enzimas ligninolíticas10.
Sobre la base de estudios de laboratorio, se ha descrito que la síntesis y la secreción de las enzimas ligninolíticas al medio extracelular ocurren cuando hay niveles limitados de carbono o nitrógeno. Además, se ha descrito que la producción de estas enzimas es óptima en presencia de altas cantidades de oxígeno, pero es reprimida por la agitación en cultivo líquido sumergido9,16. Por tanto, la implementación de un proceso óptimo de producción enzimática dependerá de las características del organismo con el que se trabaje, para optimizar la producción proporcionándole las condiciones más favorables.
C. laeve ECS-91 no presentó ninguna de las actividades medidas, pero sí una ligera disminución en la concentración del herbicida. Esto presupone la participación de un sistema intracelular (citocromo P-450, por ejemplo) vinculado con la degradación de contaminantes18,40, o bien la participación de un sistema diferente, y permitiría explicar que haya habido degradación, aun cuando esta cepa no presentó actividad ligninolítica bajo las condiciones de cultivo empleadas en el ensayo.
Solamente el extracto libre de células de D. citrispora ECS-77 disminuyó la concentración de paraquat. Yanez-Montalvo et al.49 evaluaron extractos enzimáticos libres de células de 4 cepas de Auricularia fuscosuccinea y encontraron del 94 al 100% de degradación de endosulfán después de 8 días de incubación. Aunque el porcentaje máximo de degradación del contaminante aquí observado fue menor (44% con una concentración inicial de herbicida de 50mg/l), cabe destacar que este nivel de degradación se logró en solo 24 h.
Los resultados obtenidos hasta el momento nos permiten evaluar el potencial de degradación de 2 cepas que hasta el momento no habían sido descritas como degradadoras de compuestos recalcitrantes. Estudios posteriores que incluyan el uso de mediadores rédox y que amplíen los tiempos de incubación nos permitirán obtener niveles más altos de degradación y poder indagar en la vía por la cual se lleva a cabo dicho proceso.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El primer autor extiende un sincero reconocimiento al Consejo Nacional de Ciencia y Tecnología (Conacyt), por la concesión de la beca PDNAL-227794. Se agradece a la QFB. Lilia Moreno Ruiz, al M.C. René Humberto Gallegos y a la M.C. Luz Verónica García Fajardo, su valiosa ayuda en la realización de este trabajo.