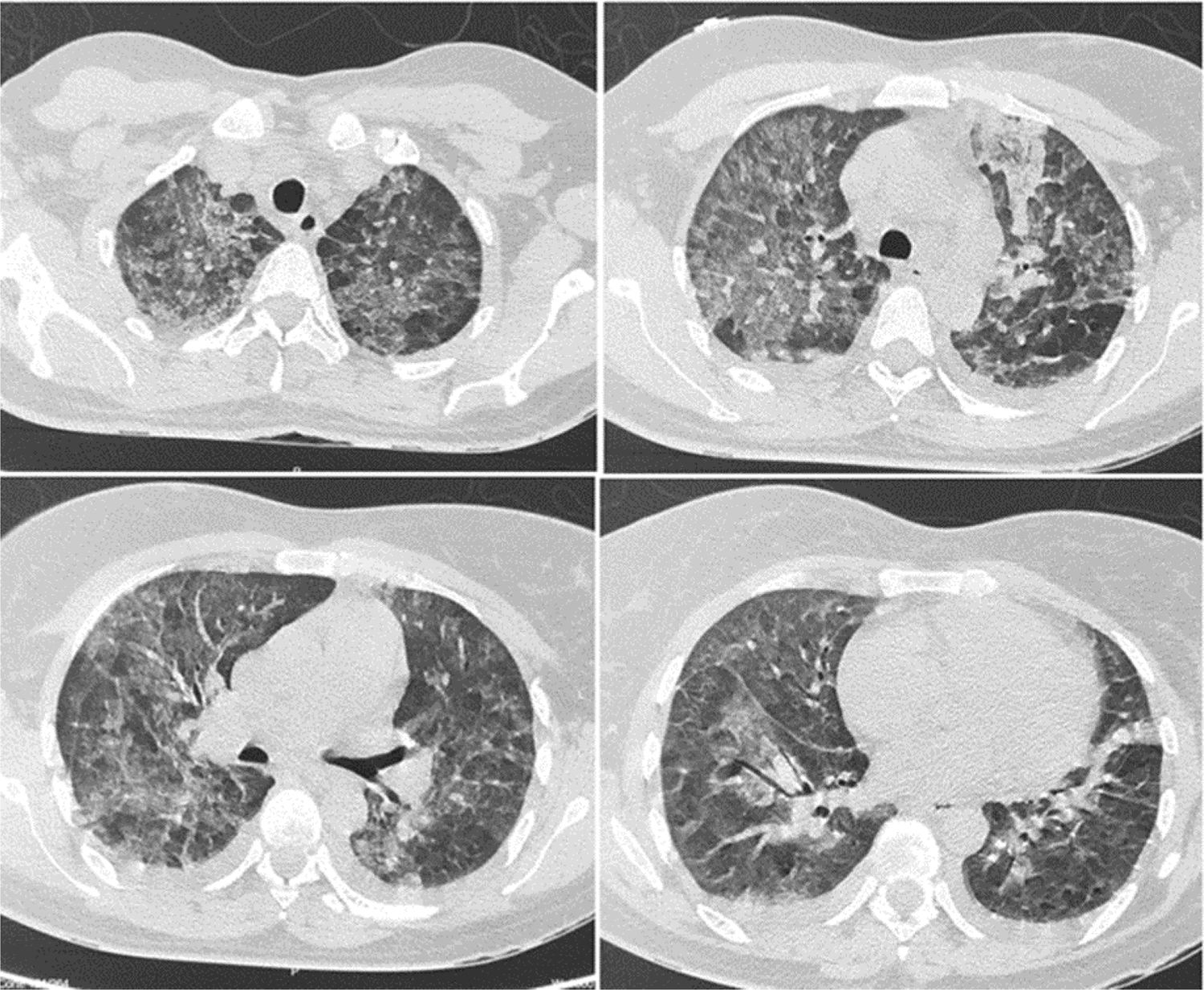
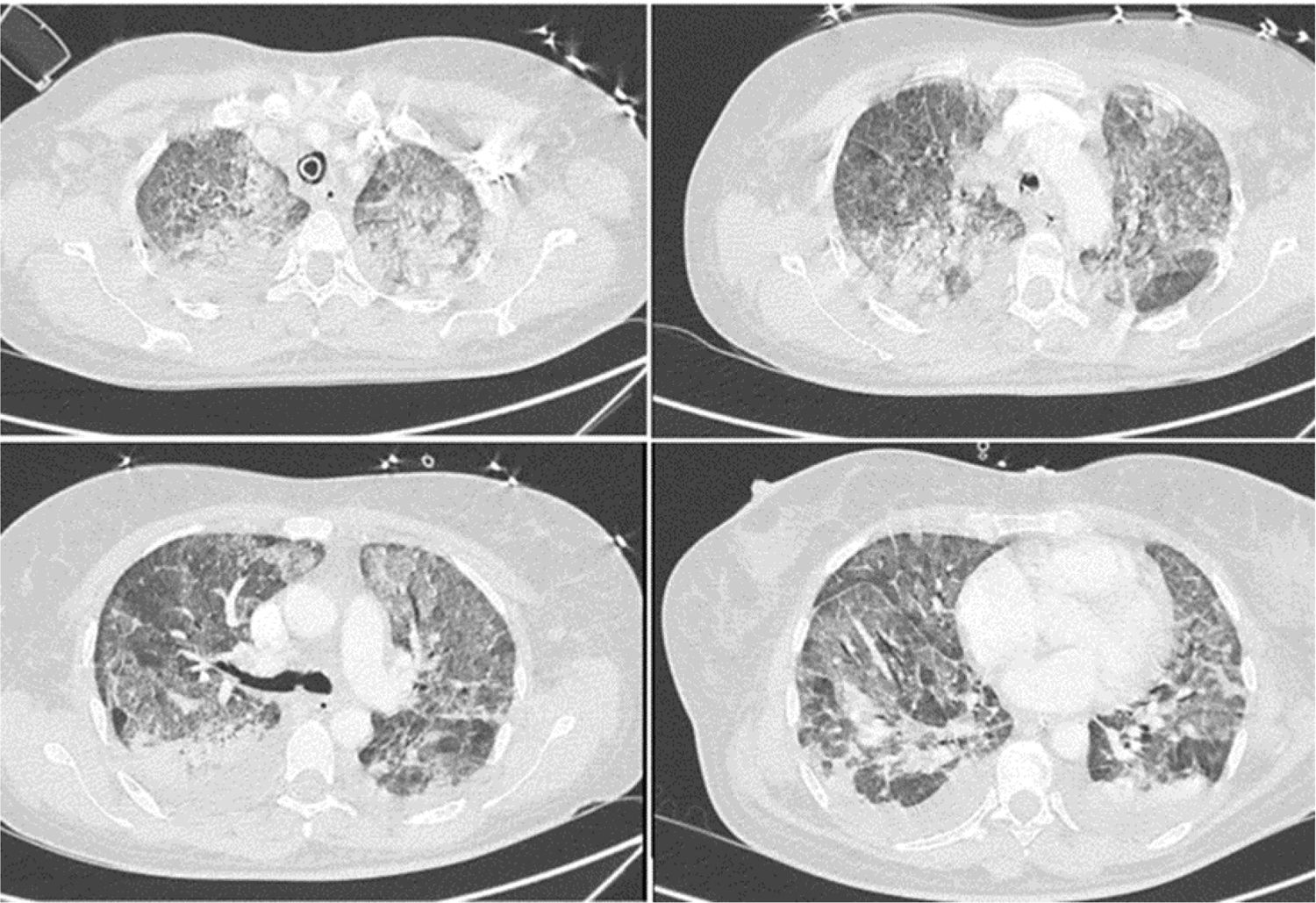
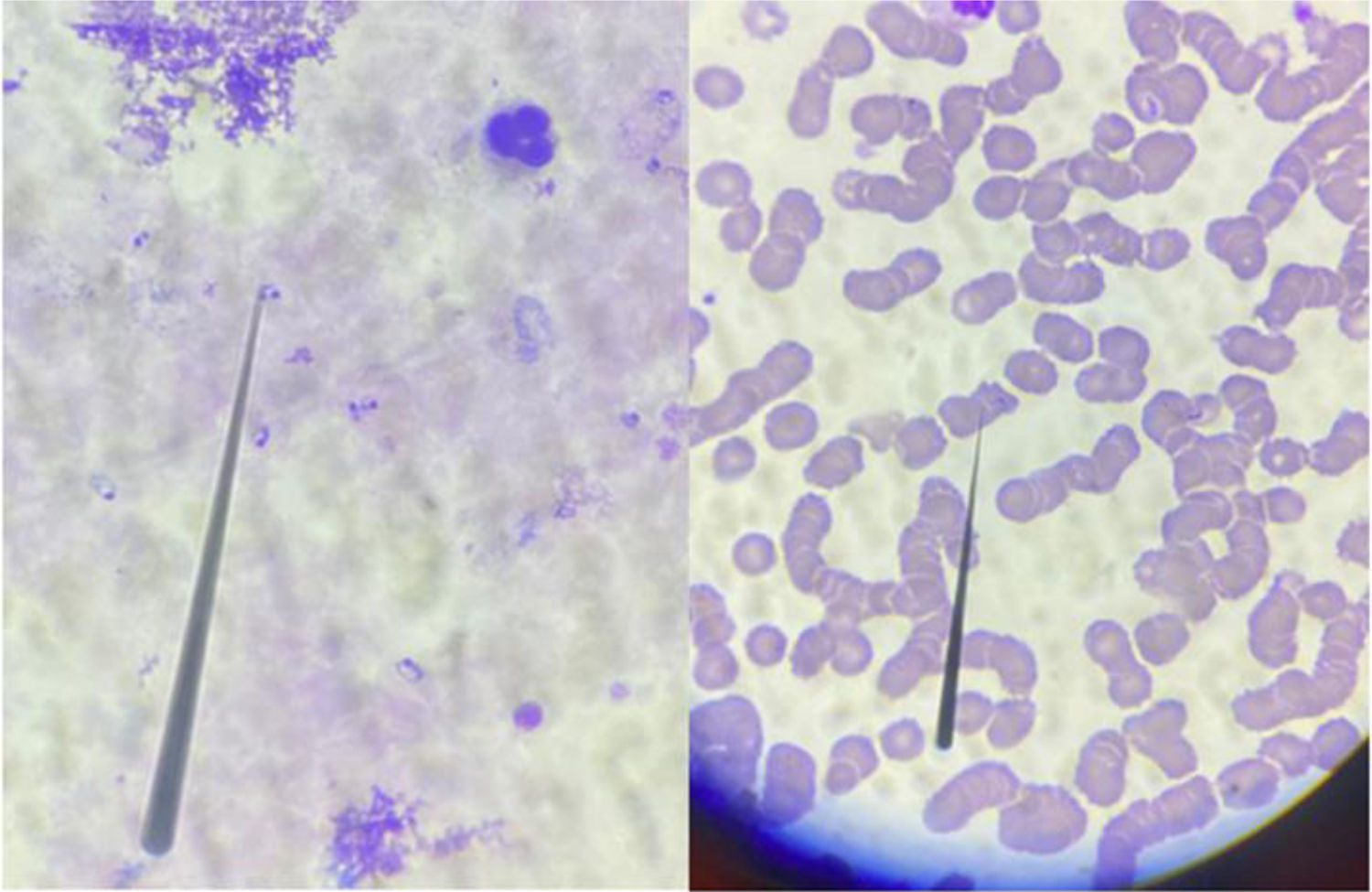
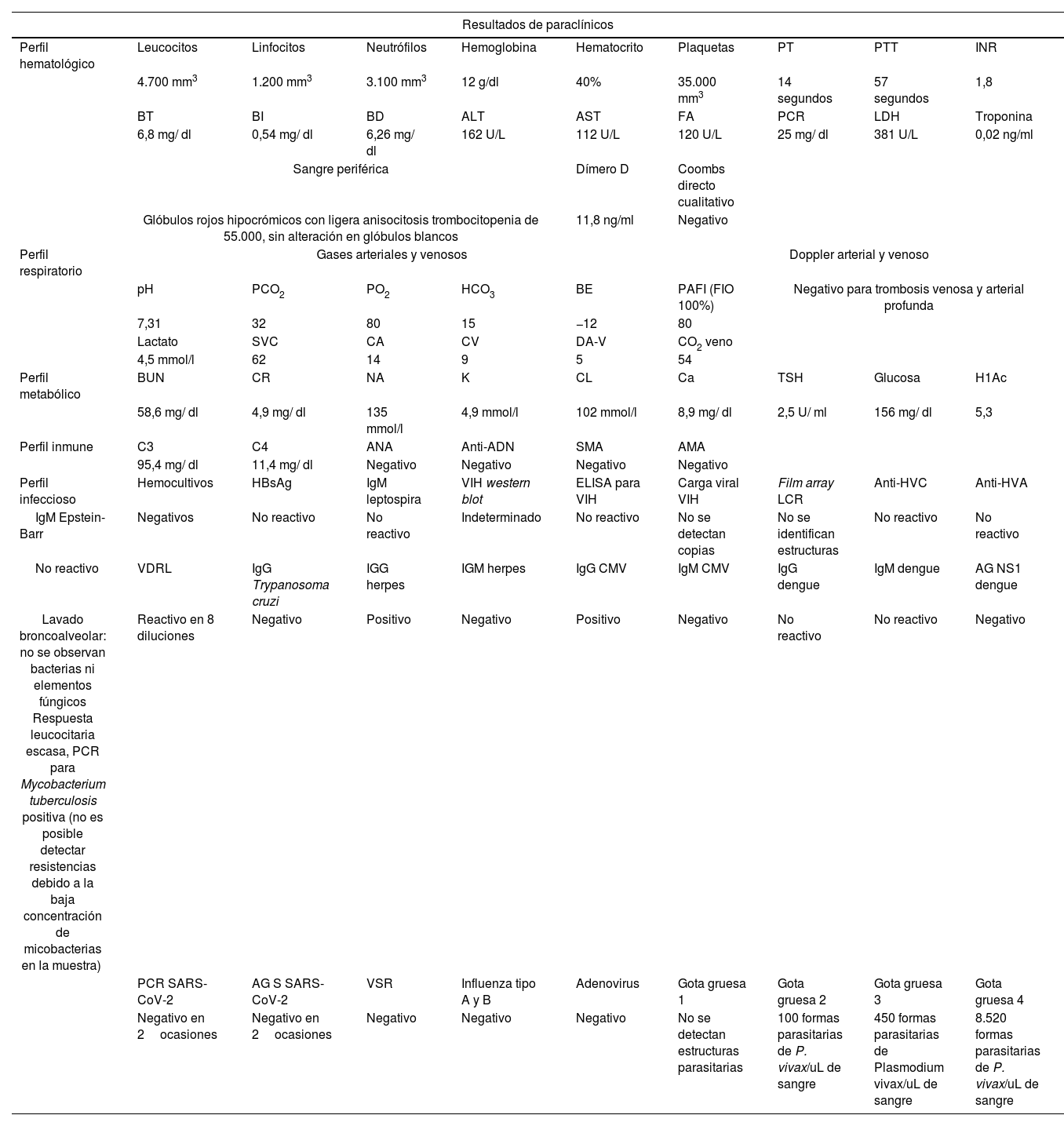
El síndrome de dificultad respiratoria del adulto es una causa común de ingreso a la unidad de cuidados intensivos, que clásicamente se ha relacionado con alta morbimortalidad y costos. La enfermedad por malaria se asocia sobre todo a infección por Plasmodium falciparum, ocasionalmente asociado a Plasmodium vivax. Reportamos el caso de una paciente de 53 años que presentó un síndrome de dificultad respiratoria aguda del adulto por Plasmodium vivax con coinfección por Mycobacterium tuberculosis. El diagnóstico fue realizado por estudios microbiológicos y moleculares. Desde el punto de vista clínico, este caso configura un reto diagnóstico puesto que se presentó durante la pandemia por virus SARS-CoV-2/covid-19; esta fue la principal causa de síndrome de dificultad respiratoria del adulto durante este periodo de tiempo, que dejaba dentro de la minoría los microorganismos descritos en nuestro caso.
Adult respiratory distress syndrome is a common cause of admission to the intensive care unit, which has been related to high morbidity, mortality and costs. Malaria is a disease mainly caused by Plasmodium falciparum infection and occasionally by Plasmodium vivax. We report the case of a 53-year-old patient who presents with acute respiratory distress syndrome due to Plasmodium vivax and coinfection with Mycobacterium tuberculosis. The diagnosis was made by microbiological and molecular studies respectively. From a clinical perspective, this case represents a diagnostic challenge since it occurs during the SARS CoV-2/covid-19 virus pandemic, being this the main an etiology of adult respiratory distress syndrome during the period of time when our case presented, leaving the microorganisms described in our patient to the minority of causes of adult respiratory distress syndrome.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora