La diabetes mellitus tipo 2 o no insulinodependiente es uno de los problemas de salud pública más preocupantes en el mundo. Se estima que el número de diabéticos en el mundo, que era de 135 millones en 1995, pasará a 300 millones en 2025, con un incremento del 42% en los países desarrollados y del 170% en los países en vías de desarrollo1. La principal causa de mortalidad en los pacientes diabéticos es el infarto de miocardio. En estos pacientes, la aterosclerosis es más grave y acelerada2. De hecho, hay una cada vez mayor tendencia a considerar la diabetes tipo 2 una enfermedad cardiovascular que afecta a los lípidos, más allá de una mera enfermedad del metabolismo de los hidratos de carbono3.
Por otro lado, se considera que la inflamación es un denominador común de la aterosclerosis, la dislipemia y la obesidad relacionadas con la diabetes tipo 2. Tanto en los vasos como en la sangre, el hígado y el tejido adiposo de los pacientes ateroscleróticos, obesos y dislipidémicos, se producen citocinas y mediadores de la inflamación como la interleucina (IL) 64, la proteína C reactiva (PCR)5, el factor de necrosis tumoral (TNF)6 y la ciclooxigenasa 2 (COX-2)7. Esta inflamación favorece el daño vascular, la rotura de la placa y la hipercoagulabilidad de la sangre, a la vez que determina la alteración del metabolismo lipídico y la resistencia a la insulina, características importantes del síndrome metabólico y la diabetes tipo 28.
Surgen 2 preguntas ante esta perspectiva. En primer lugar, ¿puede demostrarse in vitro una relación entre la diabetes clínica y la inflamación vascular? Y en segundo lugar, ¿pueden reproducirse in vitro los efectos proinflamatorios de algún factor importante en la diabetes, la obesidad y el síndrome metabólico? Para contestar a ambas preguntas, determinamos la expresión de la enzima proinflamatoria COX-2 en arterias y células de músculo liso vascular de pacientes diabéticos, así como la expresión de COX-2 cuando las células de músculo liso vascular fueron incubadas con triglicéridos.
Material y métodos
Parámetros clinicoepidemiológicos
Se utilizaron los datos del Servicio de Cirugía Cardíaca del Hospital Clínico San Carlos de Madrid, de los pacientes con enfermedad arteriosclerótica sometidos a revascularización miocárdica, de los que se pudo obtener un segmento de arteria sobrante.
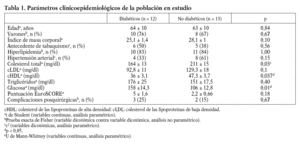
Las historias clínicas de los pacientes incluidos en el estudio fueron revisadas para la obtención de los siguientes datos: edad, sexo, hábito tabáquico, diagnóstico de diabetes mellitus, hipertensión arterial, hiperlipidemia e índice de masa corporal (IMC), puntuación obtenida en la escala EuroSCORE, valores séricos preoperatorios de colesterol total, colesterol unido a lipoproteínas de baja densidad (cLDL) y colesterol unido a lipoproteínas de alta densidad (cHDL), triglicéridos y glucosa en mg/dl, complicaciones postoperatorias cardiovasculares (infarto miocárdico perioperatorio, arritmia grave, insuficiencia cardíaca), renales (insuficiencia renal aguda), accidente cerebrovascular o muerte antes de su baja hospitalaria.
El diagnóstico de diabetes mellitus se definió como concentraciones de glucosa en sangre > 126 mg/dl (>= 7,8 mmol/l en U/I) o el uso de fármacos antidiabéticos. La hipertensión arterial se definió como presión arterial sistólica (PAS) > 140 mmHg y/o diastólica (PAD) > 90 mmHg o el uso de medicamentos antihipertensivos. La hipercolesterolemia se definió como valores plasmáticos de colesterol > 200 mg/dl (>= 5,0 mmol/l en U/I) o el uso de hipolipemiantes. Los criterios de exclusión fueron: pacientes mayores de 75 años, pacientes con enfermedades que afecten al estado inflamatorio general (fallo renal, enfermedades hepáticas, etc.) y pacientes con cáncer.
Se ha utilizado la arteria mamaria interna extraída para la cirugía de revascularización cardíaca; el segmento sobrante de arteria mamaria interna tras la cirugía fue recogido en medio de cultivo RPMI 1640 (Gibco, Invitrogen, Madrid) con 100 U/ml de penicilina G (sal sódica) y 100 µg/ml de anfotericina B (Gibco, Invitrogen, Madrid) por el equipo quirúrgico, etiquetado y trasladado en condiciones asépticas en contenedores con hielo para su utilización en el laboratorio de Farmacología de la Facultad de Medicina.
El uso de material clínico fue aprobado por el Comité Ético del Hospital y se obtuvo consentimiento informado de todos los pacientes participantes en el estudio.
Inmunofluorescencia en cortes de arterias
La localización y expresión de las proteínas COX-2 se estudió mediante inmunofluorescencia de cortes histológicos. Cada segmento de arteria fue limpiado y fijado en paraformaldehído (PFA) al 4% durante 2 h y lavado con PBS. Tras esto, el tejido se pasó a un baño de PBS 0,1 mol/l + sacarosa al 30%, a 4 °C, durante 3 h. Se incluyó los segmentos arteriales así tratados en medio de montaje (OCT tissue-tek, Bayer, Alemania) durante 30 min, se los congeló con nitrógeno líquido y se almacenaron debidamente etiquetados a 80 °C hasta que se procedió a cortarlos.
Se realizaron cortes histológicos de 7 µm de espesor con microtomo en frío (Cryostat HM500, Microm International, Dusseldorf, Alemania). Los cortes se desecaron por 2 h en estufa a 37 °C y se lavaron con solución de PBS + Tween 20® al 0,3% (Sigma-Aldrich Inc., Madrid) (PBS-T). Posteriormente, se bloquearon las uniones inespecíficas con solución de albúmina sérica bovina al 5% en PBS-T por 1 h.
El anticuerpo primario específico de COX-2 (BD-Bioscience Pharmingen) se incubó en solución de albúmina al 2% en PBS-T en una dilución de 1:100 durante una noche a 4 °C. El anticuerpo secundario correspondiente (anti-IgG de cabra, Alexa 568, Molecular Probes, Estados Unidos), se incubó durante 2 h a 37 °C en una dilución 1:500 en la misma solución. Posteriormente se procedió al lavado con PBS-T y secado; las muestras se prepararon con medio de montaje Slow-fade® (Molecular Probes, Estados Unidos). Se utilizaron controles negativos (cortes sin anticuerpo primario). La visualización de las proteínas se realizó por microscopia de inmunofluorescencia confocal (microscopio Leica TSC, Leica Microsystems, Heidelberg, Alemania); la cuantificación de la expresión de COX-2 se realizó mediante planimetría cuantitativa con el programa ImageJ (versión 1.33 NIH, Estados Unidos); el valor positivo se restó al del control negativo y el porcentaje de diferencia fue referido como número de veces más expresado que el control. La medición planimétrica fue realizada por 2 observadores y su correlación alcanzó una r = 0,78.
Homogeneización de arterias y extracción de proteínas
Se limpió los segmentos de arteria mamaria interna, de aproximadamente 5 mm, y se congelaron a 80 °C. Para su procesamiento, los segmentos arteriales se descongelaron y se incluyeron en una solución de homogeneización (SDS al 1%, 10 mmol/l de Tris-HCl pH 7,4 y 1 mmol/l de ortovanadato sódico) a punto de ebullición; se homogeneizó la muestra con un homogeneizador de cristal (Nessler Inc.) adaptado a un taladro eléctrico giratorio hasta lograr la homogeneización del tejido en frío. Posteriormente, la muestra se centrifugó durante 10 min a una velocidad de 6.000 rpm y a una temperatura de 4 °C (Labofuge Kendro Laboratory Products, Alemania), se aspiró el sobrenadante, se cuantificó la concentración de proteínas por técnica espectrofotométrica y se procedió a la determinación de COX-2, CPR y alfactina por técnica de Western blot.
Cultivos celulares y extracción de proteínas
Las células de músculo liso vascular fueron aisladas mediante explante y se cultivaron en medio RPMI 1640 suplementado con 100 U/ml de penicilina G (sal sódica) y 100 µg/ml de anfotericina B (Gibco, Invitrogen, Madrid) y 20% de suero fetal bovino (Gibco-Invitrogen, Madrid). Los experimentos se realizaron en células entre los pases 3 y 5.
Las células fueron lisadas para la extracción de sus proteínas, tras su lavado con PBS frío a 4 °C. La solución de lisado se componía: 50% de glicerol, 10% de SDS, 1 mol/l de Tris pH 6,8, 0,5 mol/l de EDTA y 5 mol/l de NaCl. La medición del contenido de proteínas se realizó por el método del ácido bicinquiónico.
Cuantificación de proteínas por Western blot
Esta técnica se empleó para las muestras de homogeneizado arterial y de lisado celular. Las muestras descongeladas se hirvieron durante 5 min a 95 °C para desnaturalizar las proteínas. Las proteínas (30-50 µg) se separaron según su peso molecular mediante electroforesis en un gel de acrilamida-SDS al 10%. Las proteínas separadas en los geles se transfirieron a una membrana de fluoruro de polivinilideno (PDVF) (Amersham, Barcelona) mediante aplicación de corriente eléctrica. El bloqueo para los sitios inespecíficos se realizó con 3% de BSA en TBS-Tween (Tris 25 mmol/l, NaCl 75 mmol/l, Tween 20 0,1%, pH 7,4). La incubación con anticuerpos primario y secundario fueron diluidos a 1:1.000 y 1:10.000 en TBS-T, respectivamente. Los tiempos de incubación fueron de 12 h a 4 °C para el anticuerpo primario y 1 h a temperatura ambiente para el anticuerpo secundario, ambos en agitación continua. La inmunorreactividad se determinó por un sistema de detección de quimioluminiscencia para Western blot (ECL kit, Amersham). La expresión de proteínas se cuantificó mediante análisis densitométrico de la banda y con planimetría cuantitativa con el programa ImageJ. La expresión de alfa actina se utilizó como proteína constitutiva de referencia y como comprobación de que las células eran realmente de la estirpe de músculo liso vascular.
Estadística
Se realizaron las siguientes pruebas estadísticas: prueba exacta de Fisher (variables dicotómicas, análisis no paramétrico), prueba de la *2 (variables dicotómicas, análisis paramétrico), prueba de la t de Student (variables continuas, análisis paramétrico) y prueba de la U de Mann-Whitney (variables continuas, análisis no paramétrico). Las comparaciones múltiples se analizaron mediante ANOVA o su equivalente no paramétrico y con la prueba de HSD de Tukey post hoc si la ANOVA era significativa. En todos los casos, se consideró como significativo un valor de p < 0,05.
El análisis exploratorio de relación entre variables se realizó con el coeficiente de correlación de Pearson si ambas variables tenían distribución normal y con la Rho de Spearman en caso contrario. La regresión simple se realizó de la forma paramétrica habitual. Los programas estadístico y gráfico utilizados fueron GraphPad Prism version 3.0 para Windows y R versión 2.0.1.
Resultados
Parámetros clinicoepidemiológicos
Fueron registrados los datos clínicos de 25 pacientes (18 varones y 7 mujeres), los mismos de los que se obtuvieron los segmentos de arteria; su edad promedio fue 63,5 ± 11,3 años; 18 (72%) sujetos eran varones; 12 (48%), diabéticos; 12 (48%), hipertensos; el 84% de nuestro grupo de estudio tenía diagnóstico de hiperlipidemia y el 44%, antecedente de hábito tabáquico. Las complicaciones posquirúrgicas se presentaron en 5 (20%) pacientes. Al separar el grupo en diabéticos y no diabéticos, se observaron diferencias significativas en los valores de glucosa, colesterol total y cHDL, y estaban más elevadas la glucemia en el subgrupo de diabéticos y el colesterol total y el cHDL en el grupo de los no diabéticos (tabla 1).
Expresión de COX-2 en inmunofluorescencia de cortes de arterias
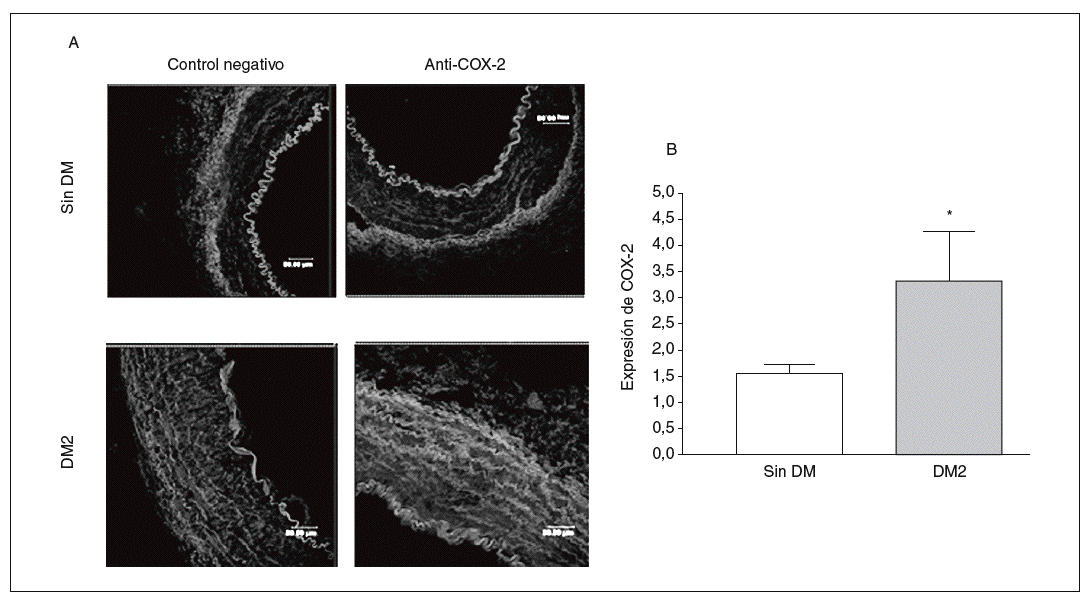
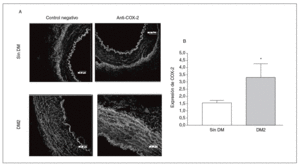
La expresión de la proteína COX-2 en la capa media arterial fue mayor en los cortes de pacientes diabéticos que en los de los no diabéticos de una forma estadísticamente significativa (fig. 1).
Figura 1. Expresión y localización de ciclooxigenasa-2 (COX-2) en arterias de pacientes por inmunofluorescencia. A: se muestran cortes representativos de arterias de pacientes diabéticos y no diabéticos; se aprecia mayor presencia de COX-2 en la capa media de las arterias de los pacientes diabéticos. B: cuantificación de la COX-2 en la capa media de las arterias de pacientes diabéticos y no diabéticos. DM: diabetes mellitus; DM2: diabetes mellitus tipo 2. *p < 0,05.
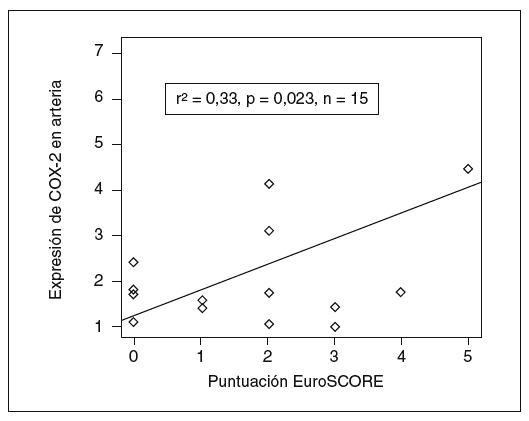
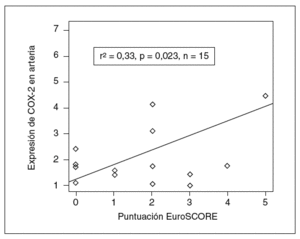
Asimismo, la expresión de COX-2 y la puntuación prequirúrgica de la escala EuroSCORE tuvieron significación estadística (r de Pearson = 0,5; p = 0,04), lo que indica que el estado inflamatorio de la pared vascular tiene importancia en la capacidad predictiva de la escala (fig. 2).
Figura 2. Implicaciones clínicas de la expresión de ciclooxigenasa-2 (COX-2). La expresión de COX-2 se correlacionó con el índice EuroSCORE de pronóstico en cirugía cardíaca, con relación estadísticamente significativa.
Expresión de COX-2 en Western blot de homogeneizado arterial
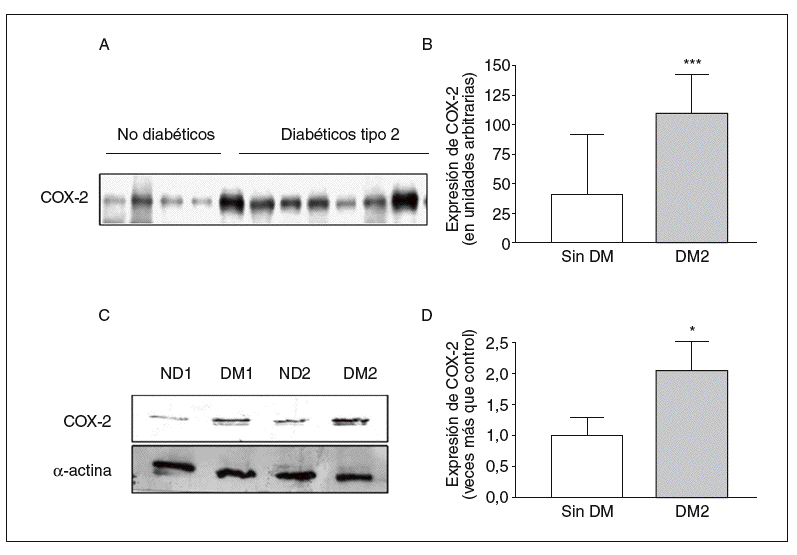
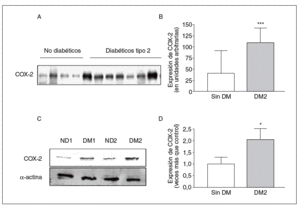
En consonancia con los datos obtenidos por inmunofluorescencia, la expresión de COX-2 en homogeneizado de arteria entera fue mayor en las muestras provenientes de pacientes diabéticos que en las de pacientes no diabéticos (fig. 3A y B).
Figura 3. Expresión de ciclooxigenasa-2 (COX-2) en arterias de pacientes determinada por Western blot. A: pacientes diabéticos y no diabéticos. B: cuantificación de COX-2 en la capa media de las arterias de pacientes diabéticos y no diabéticos. C: expresión de COX-2, medida por Western blot, en células de músculo liso vascular de pacientes diabéticos y no diabéticos. D: cuantificación de COX-2 en células de músculo liso vascular de ambos grupos de pacientes. DM: diabetes mellitus; DM2: diabetes mellitus tipo 2. *p < 0,05.
Expresión de COX-2 en Western blot de lisados de células cultivadas
De acuerdo con los resultados obtenidos en arteria entera, la expresión de COX-2 medida por Western blot en lisados de músculo liso vascular fue mayor en las células obtenidas de arterias de pacientes diabéticos (fig. 3C y D).
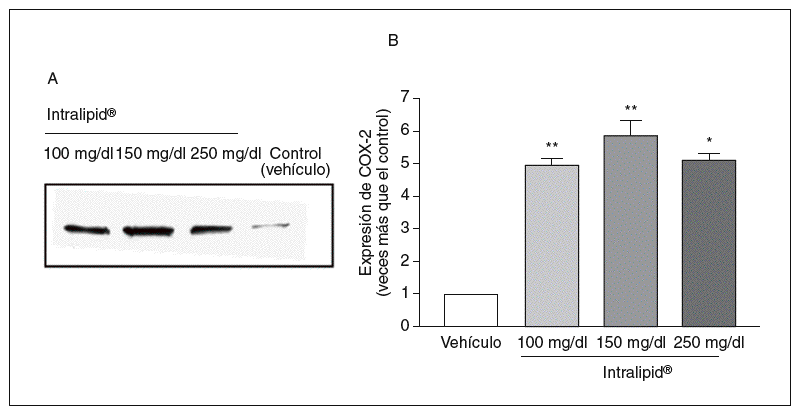
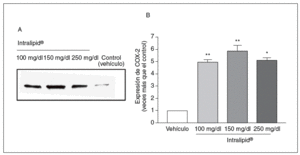
Cuando las células de pacientes no diabéticos se incubaron en medio con Intralipid®, observamos un incremento en la expresión de COX-2 (fig. 4).
Figura 4. Efecto de los triglicéridos en la expresión de ciclooxigenasa-2 (COX-2). A: expresión de COX-2, medida por Western blot, en células de músculo liso vascular de pacientes no diabéticos. B: cuantificación de la expresión de COX-2. *p < 0,05.
Discusión
Los resultados de nuestro estudio respaldan la teoría inflamatoria de la arteriosclerosis y confirman la idea generalizada de que los diabéticos presentan mayor reacción inflamatoria vascular, medida como expresión de COX-2, tanto en células de músculo liso vascular como en arterias enteras de pacientes diabéticos. Estos cambios han sido descritos por otros investigadores directamente en vasos coronarios ocluidos9.
Nuestros resultados refuerzan la idea de que los pacientes con arteriosclerosis desarrollan un proceso inflamatorio y aportan como dato novedoso que ese proceso se generaliza a vasos no ocluidos (pues son datos obtenidos con la arteria que se usa para recanalizar el segmento obstruido). De esta manera, los resultados de este trabajo refuerzan la idea de que la aterosclerosis es una enfermedad inflamatoria vascular generalizada, en lugar de afectar sólo a los vasos ocluidos.
Algunos trabajos han señalado que la hiperglucemia es la causa del aumento observado en la expresión de COX-210; sin embargo, esos autores utilizan concentraciones de glucosa de 25 mmol/l (485 mg/dl), difícilmente alcanzables en la práctica clínica diaria o insostenibles en forma crónica en pacientes con descontrol diabético. En cambio, nuestros resultados muestran un aumento en la expresión de COX-2 en células de músculo liso vascular tratadas con concentraciones crecientes de Intralipid® 20%, que equivale a una solución con concentraciones elevadas de triglicéridos (320 mg/dl), utilizada en la clínica para nutrición parenteral y en investigación como modelo de hipertrigliceridemia11, lo que indica que, independientemente de las concentraciones de glucosa, podrían existir otros factores que induzcan el fenómeno inflamatorio en pacientes diabéticos. De hecho, el síndrome metabólico, caracterizado por la hipertrigliceridemia, suele preceder años o décadas al advenimiento de la diabetes tipo 2, lo que indica que la hipertrigliceridemia podría ser la causa de una mayor inflamación vascular, y ésta a su vez podría ser la causa, y no la consecuencia, de un mal manejo de la glucemia8. La idea de que los ácidos grasos generan un aumento en la función de la vía de las prostaglandinas ha sido demostrada en ratas, en un modelo de músculo estriado, donde se ha comprobado que el resultado final de la inflamación generada por los ácidos grasos se traduce es una menor captación de glucosa12.
La comparación de algunos datos analíticos entre los subgrupos de pacientes diabéticos y no diabéticos ofrece algunos datos relevantes (tabla 1). En los pacientes diabéticos hay un aumento significativo, y muy esperable, de la cantidad de glucosa, así como una disminución del colesterol total. Al analizar las fracciones implicadas, encontramos que esa reducción se debe a una disminución significativa, en estos pacientes, del cHDL. Sus cifras de cLDL tienden a aumentar, pero no de una manera estadísticamente significativa. El cLDL se ha relacionado en otros estudios in vitro con la expresión de COX-2. Se ha descrito que, en estado nativo, las LDL pueden disminuir la expresión de COX-2 en células endoteliales13, mientras que las LDL en estado oxidado pueden estimularla14. Otro hallazgo destacado en nuestros datos es la ausencia de una mayor hipertrigliceridemia en el subgrupo de pacientes diabéticos, a pesar de su estrecha relación con el advenimiento del síndrome metabólico y la diabetes tipo 2. Puede postularse que un tratamiento farmacológico más agresivo en los pacientes diabéticos mitigaría las diferencias de triglicéridos y de cLDL de ambas poblaciones hasta anular la significación estadística, sin poder aumentar los valores de cHDL del subgrupo de pacientes diabéticos.
En resumen, nuestros resultados muestran un aumento en la expresión de COX-2 en arterias y células de músculo liso vascular en los pacientes diabéticos, así como un aumento dependiente de la dosis cuando las células provenientes de individuos no diabéticos se incuban con concentraciones crecientes de un preparado de triglicéridos, a una concentración final que coincide con una hipertrigliceridemia clínica.