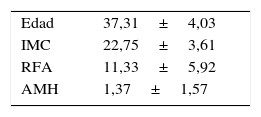La multinucleación es un fenómeno frecuente en los embriones obtenidos por fecundación in vitro y suele asociarse a un pobre pronóstico reproductivo. La monitorización embrionaria en sistemas de cultivo time-lapse permite la observación detallada y continua del desarrollo embrionario. En nuestro trabajo se ha evaluado el impacto de la presencia de multinucleación en la morfocinética, la capacidad de desarrollo y la implantación embrionaria.
Material y métodosEstudio retrospectivo de cohorte. Se han incluido 5.540 embriones cultivados en TL (Embryoscope®, Unisense Fertilitech®) procedentes de 763 ciclos de FIV-ICSI realizados durante el periodo 2012-2014. La presencia de multinucleación se evaluó en todas las etapas del desarrollo. La transferencia embrionaria se realizó en D+3, y los embriones multinucleados se cultivaron hasta alcanzar el estadio de blastocisto.
ResultadosUn 23,6% de los embriones mostraron multinucleación en algún momento del desarrollo embrionario. Los valores de los parámetros morfocinéticos de los embriones multinucleados y no multinucleados mostraron diferencias estadísticamente significativas. El 18% de los embriones multinucleados alcanzaron el estadio de blastocisto y fueron congelados. No se observó efecto ni del tipo de multinucleación ni del porcentaje de células multinucleadas sobre la tasa de blastocisto. La tasa de implantación de los blastocistos procedentes de embriones multinucleados fue del 39,1%.
DiscusiónLa monitorización embrionaria continua permite una mejor detección de la multinucleación. La presencia de multinucleación embrionaria se asocia a una morfocinética alterada y una capacidad de desarrollo reducida. No obstante, los embriones multinucleados que alcanzan el estadio de blastocisto muestran una elevada capacidad de implantación.
Multinucleation is a common phenomenon in in vitro human embryos and is associated with a poor outcome. Time-lapse monitoring of embryo development allows a continuous and detailed observation of fertilisation and cleavage events. An evaluation is presented on the impact of the presence of multinucleation on embryo morphokinetics, developmental ability, and implantation potential.
Material and methodsA retrospective cohort study was conducted on a total of 5540 embryos cultured in a TL system (Embryoscope®, Unisense Fertilitech®) from 763 ICSI cycles performed between 2012 and 2014. Presence of multinucleation in all developmental stages was assessed. Embryo replacement was performed on D+3. Multinucleated embryos were cultured to the blastocyst stage and cryopreserved for subsequent transfer.
ResultsApproximately one quarter (23.6%) of the studied embryos showed multinucleation. Multinucleated embryos showed altered morphokinetic parameters compared to the non-multinucleated ones. The multinucleated embryos that reached the blastocyst stage (18%) were cryopreserved. No differences in the developmental ability were observed compared to the multinucleated type or percentage of multinucleated cells. There was a 39.1% implantation rate of the blastocysts obtained from multinucleated embryos.
DiscussionTime-lapse monitoring of embryo development allows a better detection of the multinucleation phenomenon. The presence of multinucleated cells is associated with changes in the morphokinetics and a reduced developmental ability. However, multinucleated embryos that reach the blastocyst stage can be replaced, and have a high implantation potential.
La presencia de dos o más núcleos en una célula embrionaria se define como multinucleación y fue descrita por primera vez en embriones humanos cultivados in vitro por Tesarik et al. en 1987 (Tesarik et al., 1987). Se considera que un embrión es multinucleado cuando se ha observado más de un núcleo en alguna de sus células en cualquier momento de su desarrollo. Esta característica embrionaria se considera patológica y se asocia a mal pronóstico reproductivo.
La incidencia de este fenómeno en embriones humanos obtenidos in vitro se estima entre un 17% y un 48% (Balakier y Cadesky, 1997; Jackson et al., 1998; Van Royen et al., 2003; Hnida et al., 2004; Meriano et al., 2004; Ergin et al., 2014). El porcentaje de ciclos de fecundación in vitro (FIV) que presentan al menos un embrión multinucleado en la cohorte muestra mucha variabilidad entre las distintas publicaciones (17-79%) y parece estar relacionado con el tipo de paciente incluido.
La multinucleación puede generarse por errores en el proceso de división mitótica o por fragmentación del núcleo (Tesarik et al., 1987; Winston et al., 1991; Hardy et al., 1993; Pickering et al., 1995). Los errores mitóticos incluyen la cariocinesis en ausencia de citocinesis, las divisiones asimétricas, la incorrecta segregación de los cromosomas durante el proceso de división, los errores de empaquetamiento nuclear y la formación de husos multipolares. Las características de las primeras divisiones embrionarias (ciclos cortos, puntos de control poco estrictos y maquinaria de regulación de la apoptosis poco eficiente) propiciarían estos errores (Harrison et al., 2000).
Se han descrito dos patrones básicos de multinucleación: la binucleación y la multi/micronucleación (Meriano et al., 2004; ASEBIR, 2015). La binucleación se define como la presencia de dos núcleos en un mismo blastómero de tamaño similar y equivalente a la de los núcleos de los blastómeros mononucleados del mismo embrión. En la multi/micronucleación los núcleos de los blastómeros son de tamaño y número variable, pero más pequeños que el de las células hermanas mononucleadas.
Varios autores han descrito una asociación entre multinucleación y morfología embrionaria comprometida, capacidad de desarrollo reducida así como con una elevada incidencia de anomalías cromosómicas (Balakier y Cadesky, 1997; Jackson et al., 1998; Alikani et al., 2000; Hardarson et al., 2001; Van Royen et al., 2003; Yakin et al., 2005).
El pronóstico desfavorable de los embriones multinucleados ha llevado a los grupos de expertos en embriología de distintas sociedades científicas (ESHRE, ALPHA, ASEBIR) a consensuar la necesidad de incluir la evaluación de la multinucleación durante las observaciones rutinarias de los embriones en D+2 y D+3. En el documento de consenso elaborado conjuntamente por ALPHA y ESHRE (Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology, 2011) los embriones multinucleados quedan incluidos en la peor categoría, de modo que en general no se transfieren a menos que no haya otros disponibles. Sin embargo, se ha descrito que la transferencia de embriones multinucleados puede dar lugar al nacimiento de niños sanos (Balakier y Cadesky, 1997; Pelinck et al., 1998; Parriego et al., 2013).
Recientemente se han incorporado en los laboratorios de FIV incubadores con tecnología «time-lapse» (TL) que permiten la monitorización dinámica y continua de los embriones. El beneficio de su uso viene dado tanto por la mejor evaluación de la morfología embrionaria como por el mantenimiento de unas condiciones de cultivo más estables. Dado que la aparición de multinucleación puede darse en cualquier momento del desarrollo y desaparecer poco tiempo después, la utilización de TL permite una mejor detección de este fenómeno en comparación a las observaciones puntuales (Desai et al., 2014; Ergin et al., 2014). Si bien la correlación entre multinucleación y morfocinética no ha sido muy estudiada, los trabajos disponibles sugieren que los embriones multinucleados podrían presentar alteraciones de ciertos parámetros morfocinéticos (Ergin et al., 2014; Carrasco et al., 2014). Aguilar y colaboradores, en un estudio reciente, analizan el fenómeno de la multinucleación mediante el uso de tecnología TL en un programa de donación de ovocitos. A partir de sus datos determinan que la multinucleación en estadio de 2 células es un fenómeno frecuente y reversible y que no tiene impacto en la tasa de implantación (Aguilar et al., 2016).
El objetivo de nuestro estudio ha sido analizar las características de los embriones multinucleados cultivados en un sistema TL. Se ha determinado su incidencia, el momento de aparición de la multinucleación y la frecuencia de cada patrón de multinucleación. Se han analizado los parámetros morfocinéticos de los embriones MN comparándolos con los de embriones sin signos de multinucleación y se ha evaluado su capacidad de desarrollo hasta blastocisto. Se han analizado los resultados clínicos en los casos que han sido transferidos.
Material y métodosSe incluyeron 5.540 embriones cultivados en TL (Embryoscope®, Unisense Fertilitech®) procedentes de 763 ciclos de FIV-ICSI realizados durante el periodo 2012-2014. Fueron excluidos los ciclos realizados con espermatozoides testiculares o epididimarios, los ciclos con donación de ovocitos, los pautados para transferencia en blastocisto y los ciclos con DPI. Se consideraron multinucleados los embriones que mostraron >1 núcleo en alguna de sus células en cualquier momento del desarrollo.
Se analizó el momento de aparición de la multinucleación, el estadio embrionario en ese momento, el patrón de multinucleación (binucleación o multi/micronucleación) y el porcentaje de células multinucleadas (≤50% de células multinucleadas vs. >50%). Se evaluó la capacidad de desarrollo hasta blastocisto y se analizó la posible correlación entre patrón de multinucleación y capacidad de desarrollo por un lado y entre porcentaje de células multinucleadas y capacidad de desarrollo por el otro.
Para el análisis de la morfocinética embrionaria, únicamente se consideraron los embriones de los ciclos con al menos un embrión multinucleado en su cohorte. Se incluyeron 4.192 embriones multinucleados y no multinucleados procedentes de 540 ciclos.
Se calculó la tasa de embarazo e implantación de los embriones multinucleados y no multinucleados a partir de transferencias en fresco. Se analizaron también los resultados clínicos de los ciclos de criotransferencia de blastocistos resultantes de embriones tempranos multinucleados.
Fecundación in vitroLas pacientes fueron sometidas a un tratamiento farmacológico inductor de la ovulación con agonistas o antagonistas de la GnRH. Los protocolos de estimulación ovárica y punción folicular fueron los utilizados habitualmente en nuestro centro (Barri et al., 2002). La manipulación y el cultivo de gametos y embriones se realizó siguiendo los procedimientos estandarizados en nuestro laboratorio (Arroyo et al., 2007). Las condiciones de cultivo en el Embryoscope® fueron 37°C de temperatura y concentraciones de CO2 y O2 del 6 y 5% respectivamente. La captura de las imágenes se realizó en 5 planos focales distintos a intervalos de 15 min. El análisis de las imágenes obtenidas se realizó utilizando el software de análisis de imágenes EmbryoWiewer® (Unisense Fertilitech®).
Se registraron los momentos en que se habían producido los distintos sucesos: aparición y desaparición de los pronúcleos, división a 2 (t2), 3 (t3), 4 (t4), 5(t5), 6 (t6), 7 (t7) y 8 (t8) células respectivamente y el momento de aparición de multinucleación. A partir de estos valores se calculó la duración del segundo y tercer ciclo celular (cc2=t3-t2 y cc3=t5-t3) y la sincronía entre las divisiones celulares dentro de un mismo ciclo (s2=t4-t3 y s3=t8-t5).
La selección de los embriones a transferir se realizó a las 66±2 h siguiendo criterios de evaluación morfológica propios de nuestro centro (Clua et al., 2015). En caso de disponer de varios embriones de la misma categoría se tuvieron en cuenta criterios morfocinéticos.
El número de embriones a transferir se determinó teniendo en cuenta las características de las pacientes y de los embriones según criterios propios previamente establecidos (Tur et al., 2006). Únicamente se seleccionaron embriones multinucleados para transferir cuando no había otros disponibles.
Los embriones multinucleados no transferidos se cultivaron hasta el estadio de blastocisto (D+5/D+6/D+7) y en caso de alcanzarlo se vitrificaron siguiendo el procedimiento habitual (Solé et al., 2013).
Transferencia embrionaria y embarazoLa transferencia embrionaria en fresco se realizó en D+3 con seguimiento ecográfico (Coroleu et al., 2006). El primer control de embarazo se realizó midiendo los niveles de βHCG en sangre a los 15 días pospunción folicular. La confirmación de gestación clínica se realizó mediante la visualización ecográfica de saco fetal con latido cardíaco positivo entre 3 y 5 semanas después de la transferencia.
La preparación endometrial y los procedimientos de laboratorio en los ciclos de criotransferencia fueron los establecidos en nuestro centro y han sido descritos (Parriego et al., 2007). El procedimiento de transferencia fue el mismo que para las transferencias en fresco. El primer control de embarazo se realizó 10 días postransferencia.
Análisis estadísticoLas variables continuas se describieron mediante su media y desviación típica. Para las variables nominales o categóricas se utilizaron tablas de frecuencias. Para la comparación de variables continuas se utilizó el test de Mann-Whitney. La asociación entre variables categóricas se evaluó mediante el test de Chi cuadrado.
Las variables morfocinéticas se describieron con su mediana y sus máximo y mínimo. Las comparaciones se realizaron también utilizando el test de Mann-Whitney. Todos los test fueron bilaterales y con nivel de significación del 5%.
El análisis estadístico se realizó utilizando el software IBM© SPSS© Statistics v22.
ResultadosLas características de las pacientes incluidas en el trabajo se detallan en la tabla 1.
Se observó presencia de multinucleación en 1.312 embriones (23,6%). En 540 ciclos, al menos un embrión mostró multinucleación (70,8%). La media de embriones multinucleados observados en los ciclos con presencia de multinucleación fue de 2,43.
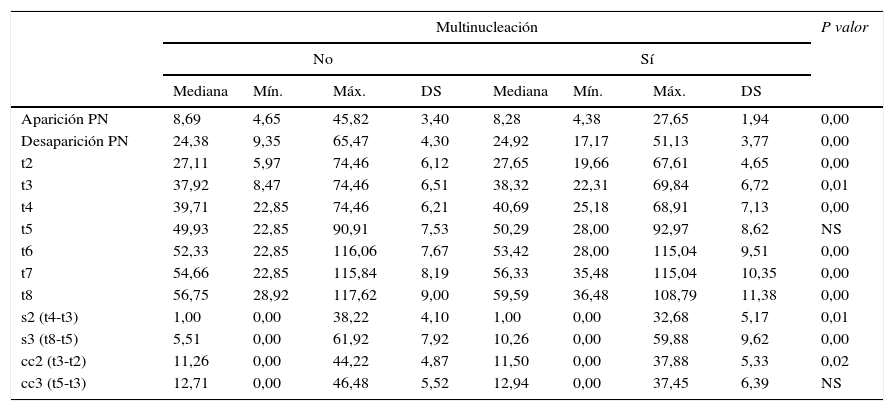
Los valores del los parámetros morfocinéticos de los embriones multinucleados y no multinucleados se detallan en la tabla 2.
Valores de los parámetros morfocinéticos de embriones multinucleados y no multinucleados
| Multinucleación | P valor | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| No | Sí | ||||||||
| Mediana | Mín. | Máx. | DS | Mediana | Mín. | Máx. | DS | ||
| Aparición PN | 8,69 | 4,65 | 45,82 | 3,40 | 8,28 | 4,38 | 27,65 | 1,94 | 0,00 |
| Desaparición PN | 24,38 | 9,35 | 65,47 | 4,30 | 24,92 | 17,17 | 51,13 | 3,77 | 0,00 |
| t2 | 27,11 | 5,97 | 74,46 | 6,12 | 27,65 | 19,66 | 67,61 | 4,65 | 0,00 |
| t3 | 37,92 | 8,47 | 74,46 | 6,51 | 38,32 | 22,31 | 69,84 | 6,72 | 0,01 |
| t4 | 39,71 | 22,85 | 74,46 | 6,21 | 40,69 | 25,18 | 68,91 | 7,13 | 0,00 |
| t5 | 49,93 | 22,85 | 90,91 | 7,53 | 50,29 | 28,00 | 92,97 | 8,62 | NS |
| t6 | 52,33 | 22,85 | 116,06 | 7,67 | 53,42 | 28,00 | 115,04 | 9,51 | 0,00 |
| t7 | 54,66 | 22,85 | 115,84 | 8,19 | 56,33 | 35,48 | 115,04 | 10,35 | 0,00 |
| t8 | 56,75 | 28,92 | 117,62 | 9,00 | 59,59 | 36,48 | 108,79 | 11,38 | 0,00 |
| s2 (t4-t3) | 1,00 | 0,00 | 38,22 | 4,10 | 1,00 | 0,00 | 32,68 | 5,17 | 0,01 |
| s3 (t8-t5) | 5,51 | 0,00 | 61,92 | 7,92 | 10,26 | 0,00 | 59,88 | 9,62 | 0,00 |
| cc2 (t3-t2) | 11,26 | 0,00 | 44,22 | 4,87 | 11,50 | 0,00 | 37,88 | 5,33 | 0,02 |
| cc3 (t5-t3) | 12,71 | 0,00 | 46,48 | 5,52 | 12,94 | 0,00 | 37,45 | 6,39 | NS |
Los pronúcleos aparecieron antes y desaparecieron después en los embriones que posteriormente mostraron multinucleación. Todos los tiempos de división, a excepción de t5, resultaron retardados en estos embriones y las divisiones celulares se realizaron de forma más asincrónica. La duración del segundo ciclo celular (cc2) fue superior en los embriones multinucleados aunque no se observaron diferencias en la duración del tercer ciclo celular (cc3).
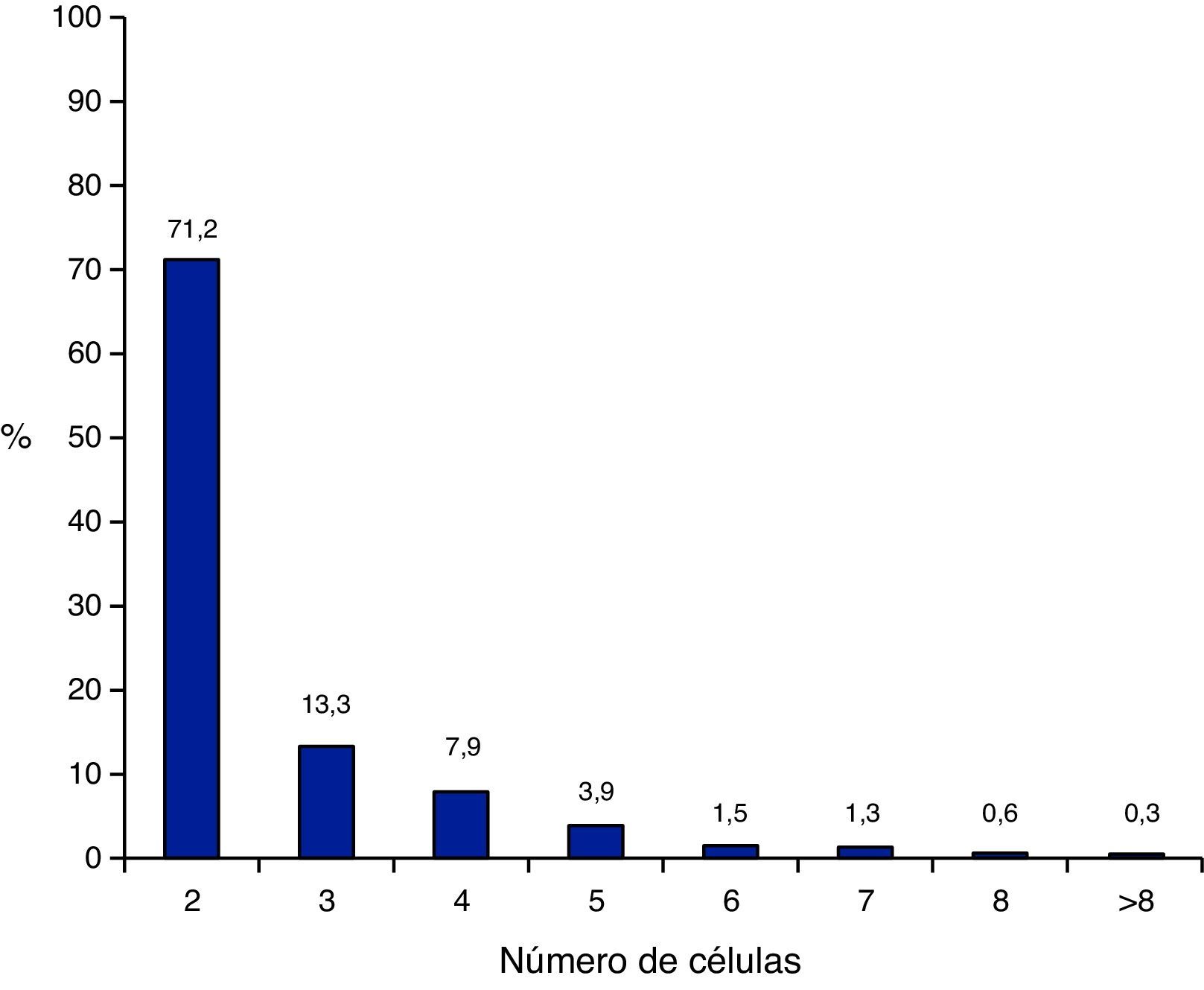
Se detectó multinucleación en todos los estadios del desarrollo embrionario aunque el estadio de 2 células fue el que mostró mayor incidencia (fig. 1). La mediana del primer momento de observación de multinucleación fue a las 33,96 h post-ICSI [2,60-83,21].
La multi/micronucleación se observó con mas frecuencia que la binucleación (58,8 y 41,2% respectivamente) y se detectaron más embriones con ≤50% de células multinucleadas que con >50% (74,7 y 25,3%).
En 166 ciclos se transfirieron embriones multinucleados por no disponerse de otros sin multinucleación. En 104 casos las transferencias fueron mixtas, transfiriéndose también embriones no multinucleados. Se realizaron 62 transferencias de exclusivamente embriones multinucleados. La tasa de embarazo global por transferencia fue del 35,5%. No se detectaron diferencias estadísticamente significativas entre las tasas de embarazo tras la transferencia de embriones no multinucleados, mixtas y homogéneas de embriones multinucleados (tabla 3). No obstante, se observó una diferencia de 11,7 puntos porcentuales entre transferencias homogéneas de embriones no multinucleados y multinucleados. Es posible que el bajo número de transferencias homogéneas de embriones multinucleados no haya permitido la detección de diferencias estadísticamente significativas.
Los embriones multinucleados no transferidos se dejaron en cultivo hasta el estadio de blastocisto y, en caso de alcanzarlo, se congelaron (18,0%). No se observaron diferencias en la capacidad de desarrollo hasta blastocisto en función del patrón de multinucleación (18,0% en embriones binucleados y 17,9% en embriones multi/micronucleados). Tampoco se observaron diferencias en la tasa de blastocisto en función del porcentaje de células multinucleadas (18,8% en embriones con ≤50% de células multinucleadas y 15,5% con >50% de células multinucleadas).
Se realizaron 87 criotransferencias, de las cuales 56 exclusivamente de blastocistos procedentes de embriones multinucleados (64,4%). La tasa de supervivencia fue del 84,6%. No se observaron diferencias estadísticamente significativas entre las tasas de embarazo obtenidas a partir de las transferencias mixtas y las homogéneas de blastocistos procedentes de embriones multinucleados (54,8 y 48,2% respectivamente). La tasa de implantación de los blastocistos procedentes de embriones multinucleados fue del 39,1%.
DiscusiónLa multinucleación es un fenómeno frecuente en los embriones humanos obtenidos in vitro. El porcentaje de ciclos con algún embrión multinucleado de nuestra serie (70%) se sitúa en el rango alto de los datos existentes en la literatura y coincide con el descrito en dos de las series publicadas (Jackson et al., 1998; Van Royen et al., 2003). El porcentaje de embriones multinucleados de los ciclos de nuestro trabajo (23,6%) es comparable al descrito en una publicación que analiza la multinucleación mediante monitorización continua (Ergin et al., 2014), y, sorprendentemente no es superior al descrito en trabajos donde se ha detectado durante las observaciones puntuales (17-48%) (Balakier y Cadesky, 1997; Jackson et al., 1998; Van Royen et al., 2003; Hnida et al., 2004; Meriano et al., 2004). En nuestra serie, si las observaciones se hubieran realizado puntualmente a las 44 y 66 h postinseminación la tasa de multinucleación detectada habría sido muy inferior (9,0%). Las mejoras en los sistemas de cultivo embrionario podrían explicar la reducción de la incidencia de la multinucleación.
Nuestros datos confirman que la multinucleación puede observarse en cualquier estadio del desarrollo, pero es máxima en estadio de 2 células. Algunos estudios describen porcentajes de multinucleación superiores en D+2 que en D+3 (Van Royen et al., 2003; Yakin et al., 2005). Se ha descrito que la dificultad para detectar multinucleación crece al aumentar el número de células y con la aparición de fragmentos (Munné et al., 2006). A partir de la observación continua de los embriones mediante TL se demuestra una correlación inversa entre número de células y detección de la multinucleación.
A partir de nuestros datos se ha confirmado que la morfocinética de los embriones multinucleados muestra diferencias respecto a la de los embriones no multinucleados. Estas diferencias ya se evidencian desde el estadio de pronúcleos con una duración de esta fase del desarrollo superior. La duración anormalmente larga de la fase de pronúcleos y por lo tanto de la fase S observada en los embriones multinucleados podría estar indicando dificultades en el proceso de replicación del DNA. Varios estudios han evaluado el efecto de variaciones en el momento de aparición y desaparición de los pronúcleos, aunque los resultados no son concluyentes (Lemmen et al., 2008; Azzarello et al., 2012; Chamayou et al., 2013; Kirkegaard et al., 2013).
En una publicación previa que evalúa la morfocinética de los embriones multinucleados se observan, tal y como sucede en nuestro trabajo, retrasos en los momentos en que los embriones alcanzan determinados estadios (Desai et al., 2014). El tiempo necesario para duplicar el DNA de los distintos núcleos, la formación de los cromosomas, el desmantelamiento de las membranas nucleares y el posicionamiento centralizado de los cromosomas para dar lugar a las dos células hijas podría ser superior cuando la célula presenta más de un núcleo. La presencia de multinucleación en estadio de 2 células explicaría el aumento de la duración de cc2 (t2-t3) en embriones multinucleados. Este hecho y el no aumento de la duración de cc3 reforzaría la hipótesis de una mayor incidencia de multinucleación en estadio de dos células y no únicamente a una mejor detección de este fenómeno en este momento. La asincronía observada en los embriones multinucleados se podría explicar por las diferencias entre los ritmos de división de células multinucleadas y no multinucleadas en un mismo embrión.
Se ha observado una menor capacidad de los embriones multinucleados para alcanzar el estadio de blastocisto (18%). Esta tasa, significativamente inferior a la observada en embriones no multinucleados (46,9%, datos propios), confirma las observaciones previas de una reducción importante de la capacidad de desarrollo de estos embriones (Alikani et al., 2000; Yakin et al., 2005).
El patrón de multinucleación detectado con más frecuencia en nuestra cohorte ha sido la multi/micronucleación. Estudios previos realizados mediante observaciones puntuales en los momentos habituales habían descrito una mayor incidencia de binucleación respecto micro/multinucleación (Meriano et al., 2004), no obstante la observación continua de los embriones ha revelado una mayor incidencia de embriones multi/micronucleados.
Nuestros datos no muestran diferencias en la tasa de blastocisto entre embriones binucleados y multi/micronucleados. Meriano y colaboradores (2004) reportaron que la capacidad de desarrollo de los embriones binucleados era comparable a la observada en embriones sin signos de multinucleación, y muy superior a la de los embriones multi/micronucleados. Datos procedentes de pacientes de buen pronóstico y de ciclos de donación de ovocitos describen tasas elevadas de blastocisto tanto en embriones binucleados como en multi/micronucleados (Desai et al., 2014). Otros autores tampoco han observado correlación entre el patrón de multinucleación y la calidad embrionaria (De Cássia Savio Figueira et al., 2010) o la capacidad de implantación (Ergin et al., 2014).
La mayoría de los embriones multinucleados de nuestra cohorte presentan multinucleación en ≤50% de sus células. El porcentaje de células multinucleadas tampoco ha resultado predictivo de la capacidad de desarrollo hasta blastocisto. Mientras que algunos autores habían observado una mejor evolución de los embriones con un único blastómero multinucleado (De Cássia Savio Figueira et al., 2010), otros autores tampoco observan diferencias en la capacidad de implantación de los embriones en función del porcentaje de células multinucleadas (Ergin et al., 2014), en la línea de nuestras observaciones. Debería determinarse si la persistencia de la multinucleación en distintas etapas del desarrollo podría tener un efecto sobre su viabilidad y su capacidad de implantación. La necesidad de más procesos de reparación podría dificultar su correcta evolución.
A pesar de la menor tasa de blastocisto obtenida tras el cultivo de embriones multinucleados, nuestros resultados no han detectado una reducción de su capacidad para dar lugar a un embarazo tras su transferencia en fresco en D+3 respecto de los embriones no multinucleados (30 y 41% respectivamente), a diferencia de lo descrito por otros autores (Jackson et al., 1998; Pelinck et al., 1998; Van Royen et al., 2001; Ergin et al., 2014). Probablemente, el tamaño limitado de la muestra no permite que se detecten diferencias estadísticamente significativas.
La capacidad de implantación de los blastocistos procedentes de embriones multinucleados transferidos en un ciclo de criotransferencia ofrece resultados muy satisfactorios (39,9%) sin diferencias respecto los obtenidos de blastocistos sin multinucleación (40,7%, datos propios).
Como conclusión, podemos afirmar que los embriones multinucleados presentan una morfocinética alterada y tienen un bajo potencial de desarrollo pero aquellos que, tras el cultivo, alcanzan el estadio de blastocisto muestran un elevado potencial reproductivo. Se recomienda, por tanto, el cultivo prolongado de los embriones multinucleados como estrategia de selección de los potencialmente aptos para la transferencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses