La corifolitropina alfa permite disminuir el número de inyecciones por ciclo, lo que podría traducirse en una disminución de la carga emocional con la consecuente mejora de la adhesión al tratamiento. El objetivo del presente estudio es comparar los resultados de los tratamientos de estimulación ovárica para FIV usando FSH recombinante de acción prolongada y FSH recombinante de administración diaria, en pacientes con pronóstico de normorrespuesta.
Material y métodosEstudio retrospectivo realizado entre 2013-2014, en 310 pacientes sometidas a su primer ciclo de ICSI, con pronóstico de normorrespuesta. Se realizó un estudio comparativo entre dos protocolos de estimulación: el grupo estudio formado por 125 pacientes, donde la estimulación se llevó a cabo con corifolitropina alfa seguido, en caso de ser necesario, de FSH-r a partir del octavo día, y el grupo control formado por 185 pacientes, que recibieron desde el principio FSH-r diaria. El frenado hipofisario para evitar la ovulación espontánea se realizó con antagonista de la GnRH a partir del 5.° día de estimulación, tras visualización de un folículo >14mm. Comparamos los resultados del ciclo de estimulación analizando los días de duración de la estimulación, el número de folículos entre 14-16mm y los mayores de 16mm, el estradiol y el grosor de la línea endometrial en el momento de inducción de la ovulación, el número de ovocitos obtenidos y el estadio madurativo, la tasa de fecundación del ICSI y el número de embriones conseguidos, embriones transferidos, desechados y criopreservados. Comparamos la tasa de gestación, la tasa de cancelación, la presencia de síndrome de hiperestimulación ovárica y otras complicaciones.
ResultadosLas tasas de gestación fueron similares en ambos grupos (por ciclo iniciado; del 33,6% en el grupo estudio vs. 36,4% en el grupo control). No encontramos diferencias en las variables analizadas en el ciclo de estimulación y en el número de complicaciones entre ambos grupos, siendo únicamente 4 pacientes canceladas por riesgo de hiperestimulación ovárica en el grupo estudio y no existiendo diferencias con el grupo control (3,2 vs. 5,9%).
ConclusionesEn pacientes con pronóstico de normorrespuesta, la estimulación ovárica controlada con corifolitropina alfa no presenta diferencias estadísticamente significativas, con el tratamiento convencional, por lo que esta representa una alternativa cómoda para la paciente, ya que mejora la adherencia al tratamiento en las pacientes con pronóstico establecido de normorrespuesta.
Corifollitropin alpha helps in reducing the number of injections per cycle, which could result in a decrease in the emotional burden and the subsequent improved adherence to treatment. The aim of this study is to compare the results of ovarian stimulation treatment for IVF using long-acting recombinant FSH and recombinant FSH daily administration in patients with normal response prognosis.
Material and methodsA retrospective study was conducted between 2013 and 2014 on 310 patients with normal response prognosis undergoing their first cycle of ICSI. A comparative study was performed between two stimulation protocols: the study group was composed of 125 patients, in whom stimulation was performed with corifollitropin alpha, followed, if necessary, by FSH-r from the eighth day. The control group was composed of 185 patients, who received FSH-r daily from the beginning. Pituitary braking to prevent spontaneous ovulation was done with GnRH antagonist from the 5th day of stimulation, after visualisation of a follicle> 14mm. We compared the results of the stimulation cycle by analysing the days of stimulation, the number of follicles between 14-16mm and greater than 16mm, oestradiol, and the thickness of the endometrial line at the time of induction of ovulation, the number of oocytes obtained and the maturational stage, ICSI fertilization rate and the number of embryos obtained, embryos transferred, discarded and cryopreserved. A comparison was made between pregnancy rate, the cancellation rate, the presence of ovarian hyperstimulation syndrome and other complications.
ResultsPregnancy rates were similar in both groups (per cycle initiated, 33.6% in the study group vs. 36.4% in the control group). No differences were found in the variables analysed in the stimulation cycle and in the number of complications between both groups, with only 4 patients being cancelled due to the risk of ovarian hyperstimulation in the study group, with no differences with the control group (3.2 vs. 5.9%).
ConclusionsIn patients with a normal response prognosis, controlled ovarian stimulation with corifollitropin alpha, shows no statistically significant differences with conventional treatment, and represents a comfortable alternative for the patient, since it improves adherence to treatment in those with established normal response prognosis.
Los dos principales objetivos de un protocolo de estimulación ovárica controlada son incrementar las tasas de embarazo y minimizar complicaciones, entre las que destaca la hiperestimulación ovárica. También se han de buscar estrategias para reducir la complejidad y la carga que supone la estimulación ovárica controlada para la paciente, como la realización de ciclos de tratamientos más cortos, menos inyecciones por día y por ciclo y, con todo ello, reducir las tasas de abandono (fig. 1).
Desde sus inicios la fecundación in vitro se ha basado en la administración de hormonas exógenas para conseguir una hiperestimulación ovárica controlada, pero debido a la vida media corta y el rápido aclaramiento metabólico de las gonadotropinas, se hace necesaria la administración diaria (Park et al., 2015). Esto es percibido por la paciente como un proceso largo y complejo que asocia mucho estrés.
La carga emocional, el estrés, la ansiedad de los tratamientos de FIV, producen una afectación psicológica que puede determinar que muchas mujeres abandonen el tratamiento y por lo tanto tengan menos oportunidades para conseguir una gestación (Olivius et al., 2004; Olivius et al., 2014; Domar et al., 2010). Existen varios estudios que apuntan como principal causa de abandono de tratamiento no las causas físicas, sino el estrés que estos tratamientos asocian (Hammarberg et al., 2001), por ello se han desarrollado protocolos para minimizar este estrés (Tarlatzis y Kolibianakis, 2007; Olivennes, 2003), como puede ser el uso de protocolos con antagonistas de la GnRH en vez de con agonistas, ya que la duración del ciclo de estimulación y la tasa de abandono es menor con los primeros (Tarlatzis y Kolibianakis, 2007).
En ese contexto, en el que se pretende mejorar la adhesión de la paciente al tratamiento, otra de las herramientas podría ser el uso de la FSH-r de acción prolongada, la corifolitropina alfa (Elonva ®), que permite disminuir el número de inyecciones por ciclo, ya que una única inyección sustituye a una semana de inyecciones diarias con FSH-r.
La corifolitropina alfa es una glicoproteína de fusión recombinante compuesta por la cadena β de la FSH humana y el péptido carboxiterminal de la subunidad β de la gonadotropina coriónica humana (hCG) (Fares et al., 1992) consiguiendo una molécula que permite prolongar la acción de la FSH. Pese a esta asociación, la corifolitropina alfa no presenta ninguna actividad LH/hCG intrínseca. Tras la administración subcutánea, presenta una absorción y eliminación lentas. La biodisponibilidad absoluta es del 58%, con unas concentraciones independientes de la dosis, alcanzándose la máxima a las 44 h. La vida media es de 70 h (60-110h), por lo que las concentraciones activas se mantienen una semana (Duijkers et al., 2002).
Numerosos estudios han demostrado que la administración de FSH-r de acción prolongada es equiparable en cuanto a efectividad a la administración diaria de FSH-r (Pouwer et al., 2012; Mahmoud et al., 2012; Devroey et al., 2009), aunque existe controversia acerca de si aumenta el riesgo de síndrome de hiperestimulación ovárica (SHO), o si hay un mayor número de ciclos cancelados por una mayor o menor respuesta (Devroey et al., 2009).
Se han publicado tres ensayos clínicos aleatorizados y doble ciego (Devroey et al., 2009; Obruca et al., 2010; Boostanfar et al., 2015), en los que se comparó el tratamiento con una única inyección de corifolitropina alfa a dosis de 100 mcg (estudio ENSURE) (Obruca et al., 2010), y a dosis de 150 mcg (estudio ENGAGE y PURSUE) (Devroey et al., 2009; Boostanfar et al., 2015), frente al tratamiento con una dosis diaria de 150, 200, o 300 UI de FSH-r. En cada uno de los tres ensayos clínicos se realizó la supresión hipofisaria con un antagonista de la GnRH y el tratamiento se inició el día 2 del ciclo. En estos estudios se estableció que la dosis recomendada era 100μg para pacientes con un peso menor o igual a 60kg y 150μg para un peso superior a 60kg (Abyholm et al., 2008; De Greef et al., 2010). Después de una semana de la inyección de corifolitropina alfa, el tratamiento se continuó con dosis extra de FSH-r en caso de ser necesario.
En los tres estudios, el tratamiento con una única inyección de corifolitropina alfa, de 100 o 150 mcg, consiguió un número superior de ovocitos recuperados en comparación con el tratamiento con una dosis diaria de FSH-r, aunque estos resultados no alcanzaron significación estadística. No hubo diferencias en la tasa de gestación en ninguno de los ensayos clínicos. Además el perfil de seguridad y la incidencia de hiperestimulación ovárica de una inyección única de corifolitropina alfa, fue equiparable a las inyecciones diarias de FSH-r. Estos datos se han confirmado recientemente en un metaanálisis (Griesinger et al., 2016).
Los protocolos de estimulación ovárica de nuestro centro pretenden incorporar cualquier tratamiento que sea efectivo y cómodo para la paciente. El manejo de la coriofolitropina alfa, en pacientes con pronóstico de normorrespuesta, nos ha permitido analizar los datos para realizar este estudio cuyo objetivo principal es comparar la tasa de gestación de los ciclos de estimulación ovárica controlada con FSH-r de administración diaria frente a FSH-r de acción prolongada. También analizamos variables relacionadas con el ciclo de estimulación, la punción y la transferencia, así como las complicaciones surgidas durante el proceso.
Material y métodosPoblación de estudioRealizamos un análisis retrospectivo de los casos consecutivos sometidos a ciclos de FIV-ICSI realizados en nuestra Unidad de Reproducción, Hospital Politécnico y Universitario La Fe de Valencia, entre enero de 2013 y diciembre de 2014.
Se incluyeron las pacientes subsidiarias de FIV/ICSI siempre que cumplieran los siguientes criterios de inclusión: a) pacientes≤de 35 años, b) sometidas a su primer ciclo de fecundación in vitro mediante la técnica de ICSI, c) tratadas con una FSH recombinante (FSH-r) o con FSH-r de acción prolongada corifolitropina alfa, d) una FSH basal en el día 3 del ciclo <10 UI/l, e) recuento de folículos antrales (RFA) >7, y f) que la causa de esterilidad fuera idiopática, factor masculino o patología tubárica. Se excluyeron otras causas de esterilidad como los trastornos de la ovulación, incluyendo el síndrome de ovarios poliquísticos, la endometriosis y la insuficiencia ovárica prematura, así como pacientes con cirugía ovárica previa.
Durante el periodo de estudio fueron seleccionadas un total de 310 pacientes. Ciento veinticinco pacientes fueron estimuladas con corifolitropina alfa (grupo estudio) y las 185 restantes con inyecciones diarias de FSH-r (grupo control).
Protocolo de estimulación ováricaEl grupo de corifolitropina alfa inició la estimulación el día 2 del ciclo menstrual. La dosis fue la recomendada por la ficha técnica (100μg para pacientes con un peso de≤60kg y 150μg si era>60kg). La respuesta ovárica fue monitorizada mediante ecografía transvaginal y medición de los niveles séricos de estradiol. El primer control ecográfico durante la estimulación se realizó el 5.° día de tratamiento y se fue controlando cada 2 o 3 días según la evolución. Se añadió el antagonista de la GnRH (0,25mg diarios de ganirelix. Orgalutran ®), cuando se evidenció un folículo≥de 14mm y/o un estradiol≥de 400pg/ml. A partir del octavo día, en aquellos casos que fue preciso, se añadieron inyecciones diarias adicionales de FSH-r (150-300 UI) hasta el día de HCG.
En el grupo control las pacientes fueron estimuladas con inyecciones diarias de FSH-r se siguió el mismo protocolo de antagonista de la GnRH, descrito anteriormente. Las dosis utilizadas dependieron de la edad, FSH en el día 3 del ciclo y el RFA, con una dosis de inicio media, entre 150-300 UI. A partir del día 5 de estimulación se valoraba la posibilidad de variar la dosis según la respuesta ovárica obtenida.
De forma similar en ambo grupos y una vez alcanzado el desarrollo folicular adecuado (≥ de 3 folículos≥de 16mm de diámetro medio) se desencadenó la ovulación con una punción subcutánea de 250μg de hCG (Ovitrelle ®). A las 36 h de la inyección se realizó la punción folicular y a las 48 h de la misma la transferencia (día +2) de 1 o 2 embriones. El soporte de la fase lútea se realizó con 200mg cada 12 h de progesterona vaginal. En los casos con sospecha de riesgo de síndrome de hiperestimulación ovárica se desencadenó la ovulación con un análogo de la GnRH (Decapeptyl 0,2mg, subcutáneo) y se realizó la punción, pero no la transferencia.
Se canceló el ciclo por falta de respuesta ovárica ante el desarrollo de menos de 3 folículos con un diámetro medio ≥16mm y por riesgo de hiperestimulación ovárica ante más de 20 folículos>de 11mm de diámetro medio o>de 3.500pg/ml de estradiol el día de programación de la inducción de la ovulación.
VariablesLas variables basales estudiadas fueron la edad, el índice de masa corporal (IMC), la causa de esterilidad, el recuento de folículos antrales y los niveles FSH en el día 3 del ciclo.
Analizamos los datos del ciclo de estimulación completo, los días de duración de la estimulación, el número de folículos entre 14-16mm y los mayores de 16mm el día de HCG, el estradiol y el grosor de la línea endometrial en el momento de inducción de la ovulación.
Los datos relacionados con la punción folicular se recogieron a partir de las siguientes variables: la calidad del semen, el número de folículos el día de la punción, los folículos puncionados, el número de ovocitos obtenidos y el estadio madurativo (número de metafase II), la tasa de fecundación del ICSI y el número de embriones conseguidos, embriones transferidos, desechados y criopreservados. Analizamos también las causas de cancelación de ciclos de estimulación, como la falta de respuesta ovárica y los casos de hiperestimulación ovárica.
Comparamos por último, la tasa de gestación por ciclo iniciado, por punción y por transferencia realizada, así como la tasa de recién nacido vivo en ambos grupos.
Análisis estadísticoLos datos fueron expresados como media con la desviación estándar correspondiente y con porcentajes en caso de tratarse de proporciones. El test estadístico utilizado fue la t de Student para comparar variables cuantitativas y el chi-cuadrado para las variables cualitativas. Consideramos la significación estadística con un valor de p< 0,05.
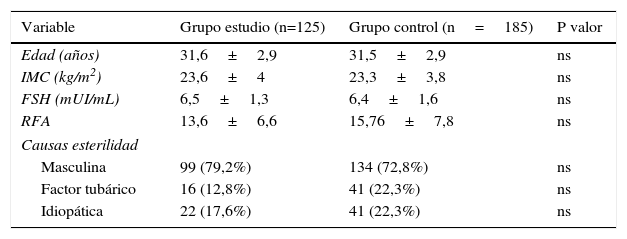
ResultadosEn la tabla 1 se muestran las características basales de ambos grupos. No encontramos diferencias estadísticamente significativas en la edad, el IMC, el RFA ni en el nivel de la FSH basal analizada. La causa de la esterilidad en ambos grupos fue similar, siendo el factor masculino la más frecuente (79 vs.73%).
Características epidemiológicas de ambos grupos
| Variable | Grupo estudio (n=125) | Grupo control (n=185) | P valor |
|---|---|---|---|
| Edad (años) | 31,6±2,9 | 31,5±2,9 | ns |
| IMC (kg/m2) | 23,6±4 | 23,3±3,8 | ns |
| FSH (mUI/mL) | 6,5±1,3 | 6,4±1,6 | ns |
| RFA | 13,6±6,6 | 15,76±7,8 | ns |
| Causas esterilidad | |||
| Masculina | 99 (79,2%) | 134 (72,8%) | ns |
| Factor tubárico | 16 (12,8%) | 41 (22,3%) | ns |
| Idiopática | 22 (17,6%) | 41 (22,3%) | ns |
De las 125 pacientes del grupo de corifolitropina alfa, un 44% (55 pacientes) recibieron 100 UI y 56% (70 pacientes) 150 UI, según el peso corporal menor o mayor de 60kg. En 99 de estas pacientes (79,2%) fueron necesarias dosis adicionales de FSH-r a partir del octavo día, siendo la dosis media de FSH-r añadida de 447 UI. En el 20,8% restante no se precisó más FSH-r para conseguir un desarrollo folicular adecuado.
En el grupo de FSH-r, la dosis media de inicio fue 212,5 UI (100-300).
La duración media del tratamiento en ambos grupos fue 9 días (9,3±1,8 en corifolitropina alfa vs. 9,3±2,7 en grupo control). Como cabe esperar, la dosis total administrada de FSH-r fue menor en el grupo corifolitropina alfa frente al grupo control, mostrando diferencias estadísticamente significativas (482±447 vs. 1883±671, p<0,05).
Las características del semen fueron similares en ambos grupos, expresado en motilidad progresiva en fresco (27 vs. 27%) y en capacitado (69 vs. 66%).
Al analizar la estimulación ovárica no encontramos diferencias estadísticamente significativas, siendo el número de folículos>16mm el día de HCG (6,5±2,9 vs. 6,7±2,8), el grosor endometrial (12,5±2,7mm vs. 10,63±2,2mm) y el valor del estradiol el día de la administración de la hCG (1708±708 vs. 2089±1786) similares.
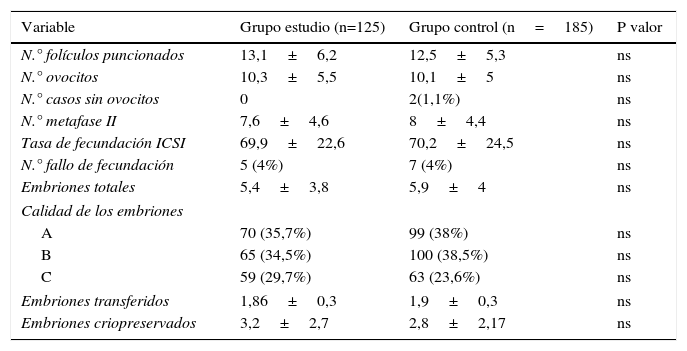
En la tabla 2 se muestran los resultados referidos al día de la punción y al desarrollo embrionario.
Variables referidas a la punción ovárica y embriones
| Variable | Grupo estudio (n=125) | Grupo control (n=185) | P valor |
|---|---|---|---|
| N.° folículos puncionados | 13,1±6,2 | 12,5±5,3 | ns |
| N.° ovocitos | 10,3±5,5 | 10,1±5 | ns |
| N.° casos sin ovocitos | 0 | 2(1,1%) | ns |
| N.° metafase II | 7,6±4,6 | 8±4,4 | ns |
| Tasa de fecundación ICSI | 69,9±22,6 | 70,2±24,5 | ns |
| N.° fallo de fecundación | 5 (4%) | 7 (4%) | ns |
| Embriones totales | 5,4±3,8 | 5,9±4 | ns |
| Calidad de los embriones | |||
| A | 70 (35,7%) | 99 (38%) | ns |
| B | 65 (34,5%) | 100 (38,5%) | ns |
| C | 59 (29,7%) | 63 (23,6%) | ns |
| Embriones transferidos | 1,86±0,3 | 1,9±0,3 | ns |
| Embriones criopreservados | 3,2±2,7 | 2,8±2,17 | ns |
El número de folículos puncionados (13,1±6,2 vs. 12,5±5,3), el número de ovocitos obtenidos (10,3±5,5 vs. 10,1±5) y el número de ovocitos metafases II (7,6±4,6 vs. 8±4,4) fue similar en ambos grupos.
En un total de 13 casos no se realizó la punción ovárica: 2 en el grupo corifolitropina alfa (1,6%) (uno por fallo en la administración de la hCG y otro por incumplimiento del tratamiento) y 11 pacientes en el grupo control (6%) (8 de ellas por falta de respuesta ovárica y las restantes por incumplimiento del tratamiento).
Como hemos comentado anteriormente se realizó ICSI en todos los casos, la media de embriones obtenidos (5,4±3,8 vs. 5,9±4) y la tasa de fecundación (69,9 vs. 70,2%) no presentaron diferencias significativas.
Una vez realizada la transferencia embrionaria, el porcentaje de embriones de calidad A (35,7 vs. 38%) y la media de embriones transferidos (1,86±0,3 vs. 1,9±0,3) fue similar en ambos grupos.
En un total de 47 casos (15,2%) se canceló la transferencia: 16 en el grupo de corifolitropina alfa (12,8%) y 31 en el grupo FSH-r (16,8%). Respecto a las causas de no transferencia destacamos el riesgo de hiperestimulación ovárica: 4 (3,2%) vs. 11 (6%) similar en ambos grupos, al igual que no presentar un útero apto, la detención del desarrollo embrionario y un fallo de fecundación. Ninguna paciente desarrolló posteriormente un SHO grave, ni otra complicación.
Se consiguieron un total de 109 gestaciones: 42 en el grupo estudio y 67 en el grupo control. No encontramos diferencias estadísticamente significativas en las tasas de gestación: por ciclo iniciado (33 vs. 36%), por punción (34 vs. 38%) y por transferencia (39 vs. 48%).
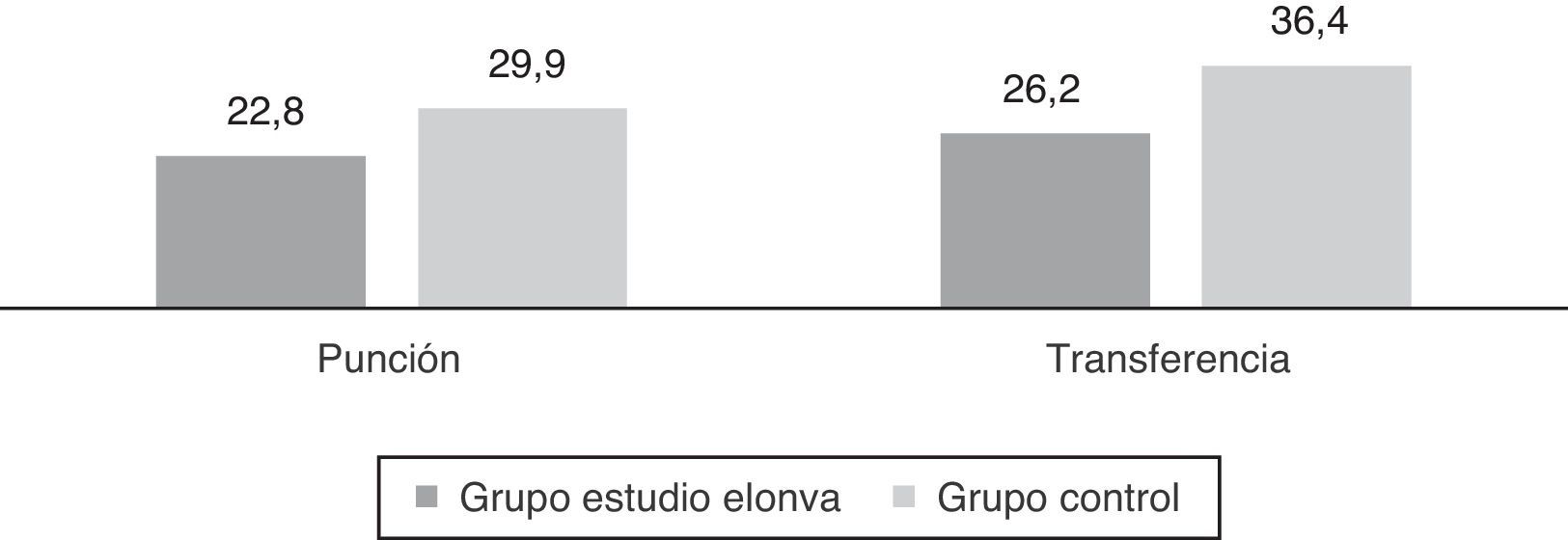
Finalmente analizamos la evolución de las gestaciones sin encontrar diferencias significativas. De las 42 pacientes que gestaron del grupo estudio, se consiguió un recién nacido vivo (RNV) en 28 casos (tasa de RNV por punción del 22,8% y por transferencia del 26,2%), 12 presentaron un aborto del primer trimestre (28,6%) y una paciente un aborto tardío en la semana 19 (2,4%), además se registró una gestación heterotópica (2,4%). En el grupo control 52 mujeres consiguieron un RNV (tasa RNV por punción del 29,9% y por transferencia del 36,4%), 13 casos de aborto del primer trimestre (19,4%) y dos gestaciones ectópicas (3%) (fig. 1).
DiscusiónEs bien conocido que las técnicas de reproducción asistida suponen un elevado coste emocional y estrés en la paciente, y que esto puede precipitar el abandono de los tratamientos antes de tiempo, disminuyendo las posibilidades de gestación. Siguiendo esta línea, Olivius et al. en 2004 informó de que un tercio de las parejas interrumpen el tratamiento debido a la carga psicológica.
Para mejorar la adhesión al tratamiento se ha de acortar el período de estimulación ovárica, por lo que disminuir el número de inyecciones es una herramienta útil para disminuir esta carga emocional y aumentar la adherencia al tratamiento.
La corifolitropina alfa tiene la ventaja de que una única inyección sustituye una semana entera de tratamiento. Un estudio reciente sobre las preferencias de las pacientes con el uso de FSH-r de acción prolongada, demuestra que estas prefieren pautas con el menor número de inyecciones posibles (Hyo Young Park et al., 2015). Van den Wijngaard et al., 2015 diseñó un estudio que consistía en la realización de un cuestionario a pacientes que iban a iniciar un ciclo de FIV. Este trataba de definir la preferencia en el número de inyecciones aunque eso pudiera conllevar un mayor riesgo de SHO y de cancelación del ciclo por riesgo de hiperestimulación ovárica. Analizó los ciclos de un total de 93 pacientes. El resultado fue que estas estaban dispuestas a someterse a un menor número de inyecciones si con eso reducían el riesgo de SHO y de cancelación del ciclo.
La farmacocinética de la molécula de corifolitropina permite el uso semanal. Igualmente la percepción inicial de comodidad para el paciente y de tranquilidad para el facultativo ha de ser establecida por el análisis de los resultados de la práctica diaria.
Nuestra población de estudio son pacientes en las que la valoración diagnóstica (analítica y ecográfica) previa al tratamiento ha determinado que sean calificadas de pacientes normorrespondedoras. Todo ello a pesar de no disponer de la valoración de los niveles de hormona antimulleriana en todas las pacientes del presente estudio, que nos permitirían conocer con más precisión la situación basal de su reserva ovárica. Por ello nos hemos basado, fundamentalmente, en la medición basal del número de folículos antrales, sin encontrar diferencias en ambos grupos.
La duración media de la estimulación en ambos grupos fue de 9 días, similar a cualquier otro tipo de estimulación ovárica, pero con la ventaja de menor número de inyecciones para la paciente. En el grupo corifolitropina alfa hasta un 20% (30% en estudio ENGAG, Devroey et al., 2009) de las pacientes no precisaron dosis extra de FSH para obtener una respuesta adecuada. En el resto de pacientes solo se necesitaron 2 días de media adicionales de FSHr.
El manejo diario de la corifolitropina, en nuestra Unidad, se ha realizado con control ecográfico el día 5 de la estimulación para adquirir práctica en la valoración del momento de comienzo del antagonista según el tamaño folicular y el nivel de estradiol, como hacemos con el resto de tratamientos, lo que implica que no ha supuesto disminución en el número de controles realizados a las pacientes durante el estudio, pero sí que hemos aprendido que se puede comenzar el antagonista de manera fija el día 5 de estimulación lo cual supondría todavía mayor comodidad para la paciente y disminuiría los controles ecográficos necesarios durante la estimulación.
No hemos encontrado diferencias estadísticamente significativas en los resultados de la punción ovárica, número de ovocitos metafase II, ni en número y calidad de embriones. El día de la punción obtuvimos una media de 10 ovocitos en ambos grupos, en contraposición de los 13,3 referidos en el estudio ENSURE (Obruca et al., 2010) a pesar de manejar pacientes similares. Con estos resultados es razonable pensar y reflexionar, para futuros trabajos, sobre el momento de indicar la inducción de la ovulación, sobre si es posible aumentar el número de ovocitos obtenidos, siempre que se controlen adecuadamente los niveles de estradiol para manejar el riesgo de hiperestimulación y los niveles de progesterona para valorar la repercusión de los mismos en la receptividad endometrial.
Es importante destacar que aunque en todas las pacientes se estableció el pronóstico de normorrespuesta, nos encontramos con 8 pacientes (4,3%) que hubo que cancelar por falta de respuesta en el grupo control y ninguna en el grupo estudio, lo cual apoya la predicción realizada de la respuesta ovárica con los datos basales recogidos.
La eficacia de la corifolitropina alfa, ha sido establecida en numerosos estudios (Devroey et al., 2009; Obruca et al., 2010; Boostanfar et al., 2015), quedando siempre pendiente la controversia sobre el posible aumento del número de cancelaciones por riesgo de hiperestimulación ovárica fundamentalmente. Nuestro estudio establece un 3,2% de cancelaciones por riesgo de hiperestimulación similar a lo publicado en el estudio ENGAGE (Devroey et al., 2009), frente a 11 casos (5,9%) del grupo control lo que se traduce en un riesgo de SHO similar.
Tras el análisis de los resultados del ciclo de estimulación, obtuvimos unas tasas de recién nacido vivo superiores en el grupo FSH-r (26,2 vs. 36,4%), debido en parte a la mayor tasa de aborto del primer trimestre en el grupo de la corifolitropina (28,6 vs. 19,4%) aunque sin alcanzar significación estadística.
Las tasas de gestación por ciclo iniciado (33 vs. 36%), por punción (34 vs. 38,7%) y por transferencia (39 vs. 48%) fueron similares en ambos grupos estudiados. Resultados similares a los obtenidos en estudios previos (Van den Wijngaard et al., 2015; Hyo Young Park et al., 2015), donde la tasa de embarazo clínico se situó en el 39% (ENGAGE).
Creemos que el conocimiento de estos datos es fundamental, para que la paciente pueda ser informada de las posibilidades de gestación desde el comienzo de su tratamiento, contribuyendo a mejorar la adhesión al mismo.
Con nuestros resultados y a partir de la experiencia en nuestro centro podemos concluir que ambos protocolos son equiparables en efectividad y eficacia, con similares tasas de gestación y tasa de RNV. Además dada la comodidad que supone una sola administración subcutánea en una semana de tratamiento, la corifolitropina alfa es una alternativa cómoda para la paciente normorrespondedora, ya que mejora la adherencia al tratamiento en este tipo de pacientes seleccionadas, sin aumentar el riesgo de hiperestimulación ovárica, mejorando, también lo que podríamos llamar la eficiencia social al disminuir los controles y, por lo tanto, los viajes, los permisos laborales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.