Los ciclos de fecundación in vitro (FIV) en los que se aprovecha el ciclo natural (CN) de la paciente se han convertido en una alternativa a los protocolos de estimulación ovárica controlada (EOC), siendo una opción más económica y sencilla. Nuestro objetivo es analizar los resultados clínicos y de laboratorio obtenidos en nuestro centro en los 287 ciclos realizados en ciclo natural puro.
Material y métodosAnálisis retrospectivo de 287 ciclos naturales realizados en nuestro centro entre septiembre de 2013 y mayo de 2016.
ResultadosSe realizaron un total de 287 ciclos en 108 pacientes. La media de edad fue de 40,7 años, la concentración de FSH de 12,2 mU/ml y el número de ciclos previos de FIV sin éxito, de 1,5. En los 194 ciclos en que se alcanzó la punción (67,6%) se obtuvieron 1,1 ovocitos por punción, con una tasa de fecundación del 69,6%. En 70 de los 287 ciclos se realizó transferencia embrionaria (24,4%), con una tasa de implantación del 23,7%. Analizados globalmente, las tasas de embarazo fueron del 6,9% por ciclo iniciado, del 10,3% por punción, del 28,6% por transferencia y del 18,5% por paciente.
DiscusiónUn porcentaje elevado de los ciclos de FIV realizados en ciclo natural son cancelados sin alcanzar la transferencia embrionaria. Sin embargo, analizando los resultados obtenidos por punción y transferencia, suponen una alternativa simple, económica y poca agresiva, con unos resultados aceptables si tenemos en cuenta su frecuente indicación en una población de mal pronóstico donde otras opciones más agresivas no mejoran sus expectativas.
In vitro fertilisation (IVF) cycles that take advantage of the natural cycle (NC) of the patient have become an alternative to the protocols of controlled ovarian stimulation (COS), and are a cheaper and easier option. Our objective is to analyse the clinical and laboratory results obtained in our centre on 287 cycles performed in pure natural cycles.
Material and methodsA retrospective analysis was carried out on 287 natural cycles performed in our centre between September 2013 and May 2016.
ResultsA total of 287 cycles were performed on 108 patients with a mean age of 40.7 years, a mean FSH of 12.2 mU/mL, and 1.5 previous cycles of unsuccessfully performed IVF. Egg retrieval (ER) was achieved in 194 cycles (67.6%), with a mean of 1.1 oocytes by (ER), and a fertilisation rate of 69.6%. Embryo transfer was achieved in 70 of the 287 cycles (24.4%) with an implantation rate of 23.7%. Analysed globally, the pregnancy rate was 6.97% per cycle started, 10.3% per ER, 28.6% per transfer, and 18.5% per patient.
DiscussionA high percentage of IVF cycles performed in natural cycle are cancelled without reaching embryo transfer. However, analysing the results obtained by ER and transfer, they are an alternative, simple, economical, and slightly aggressive, with acceptable results if we consider their frequent indication in a population of poor prognosis, where more aggressive options do not improve the expectations.
En 1978 los doctores Steptoe y Edwards (Steptoe y Edwards, 1978) consiguieron el primer nacimiento tras un ciclo de fecundación in vitro (FIV). Este hito se logró aprovechando el ciclo natural (CN) de la paciente, realizando la punción por laparoscopia y recuperando un único ovocito.
Desde entonces las técnicas han experimentado una transformación vertiginosa, donde el ciclo natural ha sido reemplazado progresivamente por el concepto de estimulación ovárica controlada (EOC). De esta forma se busca incrementar la recuperación de ovocitos, maximizar el número de embriones conseguidos y poder realizar una mejor selección del embrión a transferir. La EOC permite así alcanzar las mejores tasas de éxito optimizando el esfuerzo realizado por laboratorios y pacientes. Pero la hiperestimulación ovárica no está exenta de riesgos y ha generado dudas sobre sus posibles efectos colaterales: aumento exponencial de los costes económicos (Groen et al., 2013; Goverde y McDonnell, 2000), altas tasas de abandono (Osmanagaoglu y Tournaye, 1999), efecto perjudicial sobre la receptividad endometrial (Paulson et al., 1990; Lass et al., 1998), riesgo de síndrome de hiperestimulación ovárica (SHO) (Elchalal y Schenker, 1997; Beerendok y van Dop, 1998), aumento de los embarazos múltiples y sus complicaciones (Nygren y Andresen, 2001; Kauma, 1997; Elster, 2000) y un debate todavía abierto sobre la repercusión a largo plazo en la salud de las pacientes (Duckitt y Templeton, 1998).
En los últimos 20 años ha surgido una corriente de opinión en la que algunos profesionales (Edwards et al., 1996; Edwards, 2007) advierten de la necesidad de buscar técnicas alternativas a la EOC, más sencillas y menos agresivas, que aprovechen los avances conseguidos a nivel de laboratorio y el mayor conocimiento de la fisiología reproductiva de la mujer. Su objetivo es reducir la complejidad del proceso sin afectar a las posibilidades de éxito de los tratamientos.
Los tratamientos de FIV basados en ciclo natural o estimulación mínima han tenido un gran desarrollo en Japón y Estados Unidos, donde existen centros que aplican exclusivamente estos protocolos (Zhang y Chang, 2010; Kawachiya y Matsumoto, 2012). Desde nuestra apertura de 2013, nuestra clínica ha seguido esta misma línea y actualmente el 40% de los ciclos que realizamos se hacen en ciclo natural puro, utilizando exclusivamente un agonista de la GnRh o HCG para desencadenar la maduración ovocitaria.
Presentamos los resultados clínicos y de laboratorio obtenidos en nuestro centro entre septiembre de 2013 y mayo de 2016 en 287 ciclos de FIV realizados en ciclo natural.
Material y métodosSe ha llevado a cabo un análisis retrospectivo de 287 ciclos de FIV en protocolo de CN en 108 pacientes. La indicación del tratamiento se ha basado en el consejo médico y la decisión compartida con los pacientes, independientemente de la reserva ovárica o del número de ciclos de FIV/ICSI previos. Solo se han excluido del análisis los ciclos naturales realizados con el objetivo de acumular embriones para un posterior diagnóstico preimplantacional.
El análisis de los datos ha sido por intención de tratar, por lo que se incluyen también aquellos ciclos sin respuesta ovárica, con ovulación prematura antes de la punción, fallos de fecundación, o en los que la transferencia fue cancelada por ausencia de embriones viables.
Protocolo de tratamientoEl primer control ecográfico se realiza entre el día 6-10 de ciclo, dependiendo del patrón de los ciclos menstruales de la paciente. En nuestro Centro no introducimos ningún tipo de medicación para la estimulación ovárica, por lo que solo se lleva a cabo un seguimiento ecográfico cada 48-72h hasta objetivar un folículo dominante >16mm.
Una vez alcanzado este tamaño, se induce la maduración ovocitaria con 0,2μg de triptorelina subcutánea y la paciente, salvo contraindicación médica, inicia la toma de 600mg de ibuprofeno cada 8h hasta la noche previa a la punción. De esta forma se intenta minimizar el riesgo de ovulación previa a la punción.
La aspiración de los folículos tiene lugar a las 36h de la maduración ovocitaria mediante punción vaginal ecoguiada. Esta se realiza sin sedación al tratarse de un procedimiento simple y bien tolerado por las pacientes, permitiéndoles abandonar la clínica e incorporarse a su actividad laboral de forma inmediata.
La microinyección espermática (ICSI) de los ovocitos maduros se lleva a cabo a las 2-3h de la punción, valorando la fecundación a las 17-20h de la misma.
Para el soporte de fase lútea utilizamos 200mg cada 12h de progesterona micronizada por vía vaginal. La transferencia se realiza en el día2 o día3 de desarrollo embrionario, aunque en pacientes con fallo de implantación previo o calidad dudosa en las primeras 72h de evolución ofrecemos cultivo secuencial para la transferencia en estadio de blastocisto.
En aquellas pacientes en las que el endometrio no alcanza un patrón trilaminar y un diámetro anteroposterior en el corte sagital superior a los 6mm el día de la maduración folicular, se aconseja la vitrificación de los embriones para su posterior transferencia diferida en ciclo natural o sustituido. Se ha tenido en cuenta el resultado de la primera transferencia en los ciclos diferidos a la hora de analizar los resultados clínicos.
Los datos son presentados como media y rango. Dado el carácter retrospectivo del análisis, no se requirió consentimiento informado por parte de los pacientes. Realizamos el análisis estadístico mediante el test de chi cuadrado para variables cualitativas (o cuantitativas transformadas). p<0,05 fue considerado estadísticamente significativo. Todos los análisis se realizaron usando el programa estadístico SPSS 22.
Hemos realizado un análisis para comprobar si las diferencias en cuanto a tasas de gestación entre los grupos de edad y valores de FSH son estadísticamente significativas. Previamente analizamos las variables para comprobar que siguen la normalidad mediante la prueba de Kolmogorv-Smirnov. Ambas variables, edad y FSH basal, siguen una distribución normal (p<0,05) y pueden ser descritas a través de la media y la distribución estándar.
Se ha definido como gestación clínica la presencia de saco gestacional intrauterino a los 10-12días de la determinación positiva de BHCG sérica. Se ha considerado como gestación en curso la presencia de embrión con latido cardíaco positivo a partir de la semana 12 de embarazo.
ResultadosEntre septiembre de 2013 y mayo de 2016, 108 pacientes realizaron un total de 287 ciclos naturales de FIV sin estimulación.
En la tabla 1 se resumen las características basales y las indicaciones del tratamiento. La edad media de las pacientes fue de 40,7años, con un IMC de 22,6kg/m2, FSH media de 12,2mU/ml y 1,5 tratamientos de FIV previos sin éxito. El recuento de folículos antrales en la ecografía de la primera visita fue de 3,7 folículos.
Características basales e indicaciones del tratamiento en las 108 pacientes
| Pacientes | 108 |
| Media de edad | 40,7 (27-47) |
| Media IMC | 22,6 (9,2-49,6) (n = 220) |
| Media FSH basal | 12,2 (1,65-147) (n = 246) |
| Media FIV previas | 1,5 (0-7) (n = 284) |
| Media de folículos antrales | 3,7 (1-9) |
| Indicaciones | |
| Factor masculino | 34 (31,5%) |
| Baja reserva ovárica | 32 (29,6%) |
| Factor tubárico | 16 (14,8%) |
| Endometriosis | 4 (3,7%) |
| Esterilidad de origen desconocido | 8 (7,5%) |
| Multifactorial | 14 (12,9%) |
De los 287 ciclos, en 194 (67,6%) se llegó a la punción ovocitaria, recuperándose un total de 221 ovocitos, de los que el 171 (77,4%) fueron maduros en estadio de metafaseii.
Se realizó microinyección intracitoplasmática (ICSI) en el 100% de los casos con ovocitos maduros, con una tasa de fecundación (definida por la presencia en el ovocito de 2 pronúcleos y 2 corpúsculos polares) del 69,6%. De las pacientes con fecundación, 70 (24,4% de los ciclos) llegaron a tener embriones para transferir, con una media de 1embrión transferido. La tasa de cancelación global (ciclos sin transferencia) ha sido del 75,6%. De las 70 transferencias realizadas, 8 (11,4%) han sido diferidas.
La tasa de embarazo global fue del 6,97% por ciclo iniciado, 10,3% por punción y 28,6% por transferencia; la tasa de implantación alcanzó el 23,7% (tabla 2).
Datos globales de los 287 ciclos analizados
| Número de ciclos iniciados | 287 |
| Total de punciones | 194 |
| Total de transferencias | 70 |
| Ciclos cancelados | 217 (75,6%) |
| CICLOS que NO LLEGAN A PUNCIÓN | 93 (42,8%) |
| Punción SIN OVOCITOS | 44 (20,2%) |
| No ovocitos MADUROS (no MII) | 17 (7,8%) |
| No fecundación | 37 (17%) |
| No embriones evolutivos | 26 (11,9%) |
| Tasa de punción en la que no recuperan ovocitos maduros (punción sin ovocitos + punción sin MII) | 31,4% |
| Número total de ovocitos y media | 221 (1,1) |
| Número total de MII, media y porcentaje respecto al total del ovocitos | 171 (0,9) (77,4%) |
| Tasa de fecundación (2 PN + 2 CP) | 119/171 (69,6%) |
| Total de embriones transferidos y media por transferencia | 80 (1,1) |
| Tasa de gestación por ciclo iniciado (%) | 6,97% (20/287) |
| Tasa de gestación por punción (%) | 10,3% (20/194) |
| Tasa de gestación por transferencia (%) | 28,6% (20/70) |
| Tasas de gestación por paciente (%) | 18,5% (20/108) |
| Tasa de gestación clínica por ciclo iniciado (%) | 5,9% (17/287) |
| Tasa de gestación clínica por punción (%) | 8,8% (17/194) |
| Tasa de gestación clínica por transferencia (%) | 24,3% (17/70) |
| Tasas de gestación clínica por paciente (%) | 15,7% (17/108) |
| % aborto | 45% (9/20) |
| Tasa de gestación en curso por ciclo iniciado (%) | 3,8% (11/287) |
| Tasa de gestación en curso por punción (%) | 5,7% (11/194) |
| Tasa de gestación en curso por transferencia (%) | 15,7% (11/70) |
| Tasas de gestación en curso por paciente (%) | 10,2% (11/108) |
| Tasa de implantación (%) | 23,7% (19/80) |
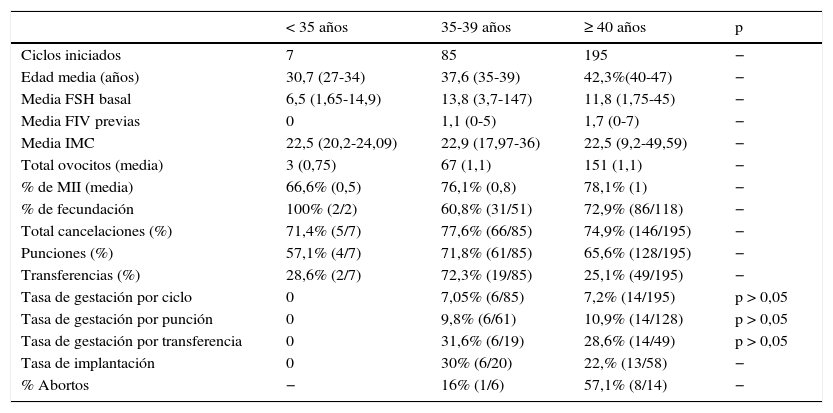
Hemos analizado los resultados clínicos por grupos de edad según las divisiones utilizadas para el registro anual de la Sociedad Española de Fertilidad (SEF) (tabla 3). En el grupo de menor edad, por debajo de los 35años, solo se realizaron 7 ciclos, cancelándose 5 de ellos (71,4%). No se logró embarazo en ninguna de las 2 transferencias.
Resultados clínicos por grupos de edad
| < 35 años | 35-39 años | ≥ 40 años | p | |
|---|---|---|---|---|
| Ciclos iniciados | 7 | 85 | 195 | − |
| Edad media (años) | 30,7 (27-34) | 37,6 (35-39) | 42,3%(40-47) | − |
| Media FSH basal | 6,5 (1,65-14,9) | 13,8 (3,7-147) | 11,8 (1,75-45) | − |
| Media FIV previas | 0 | 1,1 (0-5) | 1,7 (0-7) | − |
| Media IMC | 22,5 (20,2-24,09) | 22,9 (17,97-36) | 22,5 (9,2-49,59) | − |
| Total ovocitos (media) | 3 (0,75) | 67 (1,1) | 151 (1,1) | − |
| % de MII (media) | 66,6% (0,5) | 76,1% (0,8) | 78,1% (1) | − |
| % de fecundación | 100% (2/2) | 60,8% (31/51) | 72,9% (86/118) | − |
| Total cancelaciones (%) | 71,4% (5/7) | 77,6% (66/85) | 74,9% (146/195) | − |
| Punciones (%) | 57,1% (4/7) | 71,8% (61/85) | 65,6% (128/195) | − |
| Transferencias (%) | 28,6% (2/7) | 72,3% (19/85) | 25,1% (49/195) | − |
| Tasa de gestación por ciclo | 0 | 7,05% (6/85) | 7,2% (14/195) | p > 0,05 |
| Tasa de gestación por punción | 0 | 9,8% (6/61) | 10,9% (14/128) | p > 0,05 |
| Tasa de gestación por transferencia | 0 | 31,6% (6/19) | 28,6% (14/49) | p > 0,05 |
| Tasa de implantación | 0 | 30% (6/20) | 22,% (13/58) | − |
| % Abortos | − | 16% (1/6) | 57,1% (8/14) | − |
En el grupo de edad intermedia, entre los 35 y los 39años, la tasa de cancelación alcanzó el 77,6%, con un 60,8% de tasa de fecundación y unas tasas de gestación por ciclo del 7,05%, del 9,8% por punción y del 31,6% por transferencia. Para el grupo de mayor edad, por encima de los 40años, la cancelación por ciclo iniciado fue del 74,9%, con un 72,9% de tasa de fecundación, y tasas de gestación por ciclo, punción y transferencia del 7,2, del 10,9 y del 28,6% respectivamente.
La tasa de implantación fue del 30% para el grupo de edad intermedia y del 22% en las pacientes por encima de los 40años.
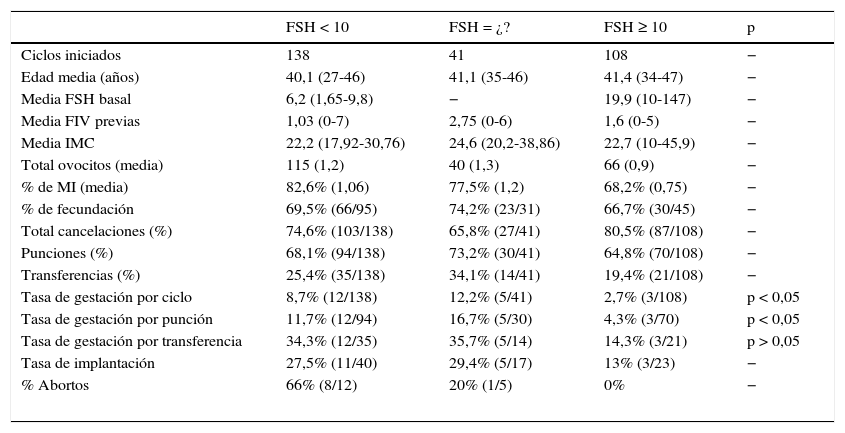
Hemos analizado los 287 ciclos según la concentración de FSH basal de la paciente (tabla 4). En los 138 ciclos con FSH<10 y los 41 de FSH desconocida se obtuvieron tasas similares de embarazo por ciclo iniciado (8,7 vs 12,2%), por punción (11,7 vs 16,7%) y por transferencia (34,3 vs 35,7%). Las tasas de implantación alcanzadas también fueron similares (27,5 con FSH<10 vs 29,4% con FSH desconocida). Sin embargo, en los 108 ciclos realizados en pacientes con FSH>10, los resultados cayeron hasta un 2,7% de embarazo por ciclo, un 4,3% por punción, un 14,3% por transferencia y un 13% por implantación.
Resultados clínicos según el rango de FSH basal
| FSH < 10 | FSH = ¿? | FSH ≥ 10 | p | |
|---|---|---|---|---|
| Ciclos iniciados | 138 | 41 | 108 | − |
| Edad media (años) | 40,1 (27-46) | 41,1 (35-46) | 41,4 (34-47) | − |
| Media FSH basal | 6,2 (1,65-9,8) | − | 19,9 (10-147) | − |
| Media FIV previas | 1,03 (0-7) | 2,75 (0-6) | 1,6 (0-5) | − |
| Media IMC | 22,2 (17,92-30,76) | 24,6 (20,2-38,86) | 22,7 (10-45,9) | − |
| Total ovocitos (media) | 115 (1,2) | 40 (1,3) | 66 (0,9) | − |
| % de MI (media) | 82,6% (1,06) | 77,5% (1,2) | 68,2% (0,75) | − |
| % de fecundación | 69,5% (66/95) | 74,2% (23/31) | 66,7% (30/45) | − |
| Total cancelaciones (%) | 74,6% (103/138) | 65,8% (27/41) | 80,5% (87/108) | − |
| Punciones (%) | 68,1% (94/138) | 73,2% (30/41) | 64,8% (70/108) | − |
| Transferencias (%) | 25,4% (35/138) | 34,1% (14/41) | 19,4% (21/108) | − |
| Tasa de gestación por ciclo | 8,7% (12/138) | 12,2% (5/41) | 2,7% (3/108) | p < 0,05 |
| Tasa de gestación por punción | 11,7% (12/94) | 16,7% (5/30) | 4,3% (3/70) | p < 0,05 |
| Tasa de gestación por transferencia | 34,3% (12/35) | 35,7% (5/14) | 14,3% (3/21) | p > 0,05 |
| Tasa de implantación | 27,5% (11/40) | 29,4% (5/17) | 13% (3/23) | − |
| % Abortos | 66% (8/12) | 20% (1/5) | 0% | − |
Realizamos el análisis estadístico (mediante el test de chi cuadrado) para comprobar si hay diferencias a nivel de las variables «FSH» y «EDAD» frente a las tasas de gestación. Para la variable EDAD no se encontraron diferencias estadísticamente significativas (p=0,969, p>0,05). Sin embargo, para la variable FSH sí obtuvimos diferencias a nivel estadístico (p=0,020, p<0,05). Esto nos llevó a analizar si había diferencias entre los grupos de FSH, encontrando diferencias estadísticamente significativas en las tasas de embarazo por punción entre las pacientes con FSH<10 o desconocida vs FSH≥10 (9,8% vs 10,9%, p=0,0048, IC [0,0459, 0,1795] y 9,8% vs 10,9%, p=0,0364, IC [−0,0177, −0,265] respectivamente) y en las tasas de embarazo por ciclo entre los grupos de FSH desconocida y FSH≥10 (10,9 vs 9,8%, p=0,0210, IC [−0,0097, 0,1997]) (tablas 3 y 4).
DiscusiónLos tratamientos de FIV en ciclo natural, aprovechando el único ovocito que genera la mujer en cada ciclo menstrual, dejaron paso rápidamente a la EOC en búsqueda de una mayor rentabilidad y menor cancelación de los ciclos. Así, la FIV en CN ha sido relegada muchas veces como una de las últimas opciones a ofrecer a las parejas con problemas de infertilidad, generalmente en casos de mal pronóstico (Jones, 2011; Schimberni y Morgia, 2009).
Sin embargo, lejos de desaparecer, en los últimos 20años ha resurgido una corriente en favor de los ciclos de FIV basados en estimulación suave, mínima o directamente ciclo natural. Así, se han publicado varios estudios en los que se defienden los beneficios de este tipo de protocolos frente a la FIV convencional: a)menor gasto de medicación, reduciendo al mínimo las dosis de medicación usadas para la estimulación y maduración ovocitaria (Edwards et al., 1996); b)menor estrés para los pacientes, con un protocolo más amigable y, por tanto, con menores tasas de abandono (Verberg et al., 2008); c)reducción del riesgo para la salud de las pacientes, desapareciendo el síndrome de hiperestimulación ovárica en estos protocolos (Zhang et al., 2016); d)menor incidencia de embrazo múltiple, al generar menos embriones o un único embrión en el ciclo natural (Pelinck et al., 2008); e)evitaría el efecto perjudicial que la hiperestimulación provoca sobre la receptividad endometrial (Paulson et al., 1990; Lass et al., 1998), y f) se ha descrito un mayor peso al nacimiento de los recién nacidos tras FIV en CN frente a los de la EOC (Mak y Kondapalli, 2016).
A nivel de laboratorio, se ha demostrado un patrón más favorable de marcadores de calidad ovárica en el ciclo natural: niveles más bajos de hormona antimulleriana (AMH), estradiol, testosterona y hormona luteinizante (LH) en el líquido folicular (Wolff y Kollmann, 2014), así como concentraciones de hormona antimulleriana (AMH) y progesterona superiores en las células de la granulosa procedentes de ovocitos recuperados sin estimulación ovárica (Kollmann y Bersinger, 2015).
En cuanto a los resultados clínicos, son muchos los trabajos que han analizado el ciclo natural, pero nos enfrentamos al gran problema de su heterogeneidad: poblaciones de estudio diferentes, distintos protocolos (ciclo natural puro, modificado) y alta variabilidad en los objetivos y resultados. La última revisión de la Cochrane (Allersma y Farquhar, 2013) sobre FIV en CN vs estimulación convencional no encuentra diferencias estadísticamente significativas en la tasa de recién nacido vivo entre ambos protocolos al analizar conjuntamente los resultados de 6 estudios con un total de 788 pacientes. La fiabilidad de este tipo de metaanálisis queda en entredicho si tenemos en cuenta que tampoco se encuentran diferencias significativas en cuanto al riesgo de SHO o embarazo múltiple, resultados poco plausibles en esta comparación.
Las diferencias tan marcadas entre los estudios que han analizado el ciclo natural hacen que las tasas de embarazo observadas varíen entre el 0 y el 50% por ciclo, lo que dificulta el poder ofrecer este protocolo como una alternativa fiable y con una indicación clara en un determinado grupo de pacientes (Pelinck, 2009; Bodri y Kawachiya, 2014; Zayed et al., 1997; Daya y Gunby, 1997; Roesner y Pflaumer, 2014; Aksoy y Yakin, 2016; MacDougall y Tan, 1994; DiMattina, 2014).
Pero sin duda, la gran desventaja por la que se ha criticado a los ciclos de FIV en CN es su pobre rendimiento debido fundamentalmente a las altas tasas de cancelación al trabajar habitualmente con un único ovocito maduro, de forma que hasta un 70% de los ciclos pueden no alcanzar la transferencia embrionaria (Schimberni y Morgia, 2009). Esto implica que para los pacientes puede suponer más esfuerzo alcanzar el embarazo al ser necesario repetir el tratamiento (Hojgaard, 2001; Verberg et al., 2008;), por lo que se perderían en parte algunas de las ventajas con las que se ha defendido el ciclo natural.
En nuestro estudio, 217 de los 287 ciclos analizados no han alcanzado la transferencia embrionaria (75,6%), lo que lastra las tasas de embarazo por ciclo iniciado de forma similar a como se ha descrito en otros trabajos (Schimberni y Morgia, 2009). Sin embargo, 46 de estas cancelaciones han sido por ovulación prematura antes de la punción (21,1% de todas las cancelaciones, 16% de los ciclos). Esto se debe en parte a que en nuestro centro el protocolo por el que se ha optado es el ciclo natural puro, de forma que las pacientes reciben exclusivamente triptorelina para la maduración ovocitaria e ibuprofeno para intentar retrasar la ovulación. La aplicación de una estimulación suave a partir de folículos de 13-14mm permite añadir un antagonista de la GnRH y reducir estos porcentajes de cancelación (ciclo natural modificado), pero perdiendo por otro lado una parte de las ventajas asociadas a la sencillez del proceso (Leroy y d’Acremont, 1994).
Por otro lado, un 67,9% de los ciclos en nuestro estudio se han realizado en pacientes mayores de 40años, con una FSH basal superior a 11,8 y más de 2 ciclos previos de FIV sin éxito. De cara a poder comparar resultados respecto a la FIV convencional, quizá las preguntas a responder serían: ¿realmente supone una ventaja la estimulación ovárica en este grupo de pacientes? ¿Cuáles son las tasas reales de cancelación y embarazo por ciclo iniciado, y no por transferencia? Según el último registro de la SEF publicado del año 2014 (Registro de la SEF, 2014), la cancelación total de ciclos de FIV/ICSI ascendió al 10,2%, porcentaje que sube hasta un 14,4% en el grupo de edad >40años. Las tasas de embarazo por ciclo, punción y transferencia registradas en este último año han sido del 24,4, del 27,1 y del 36,6%, respectivamente. De nuevo los resultados empeoran en el grupo de mayor edad, descendiendo las tasas de embarazo hasta un 13% por ciclo iniciado, un 15,2% por punción y un 22,8% por transferencia. Pese a la considerable diferencia en cuanto al porcentaje de ciclos cancelados, los resultados clínicos en nuestro protocolo en ciclo natural puro no se alejan de los publicados en este grupo de edad (tabla 3); además, en el Registro no se analizan los resultados según reserva ovárica o número de ciclos previos.
La influencia de la reserva ovárica sobre los resultados de la FIV en CN ha sido analizada recientemente (Gonzalez-Foruria y Peñarrubia, 2016). En un análisis retrospectivo de 947 ciclos naturales puros, encuentran que solo la edad de la paciente, y no la reserva ovárica, influye en los resultados del tratamiento. Aunque las tasas de cancelación son inferiores a las de nuestro trabajo (62,1%), las tasas globales de embarazo por ciclo (10,6 vs 6,9%) y transferencia (27,8 vs 28,6%) han sido similares.
Nosotros hemos analizado los datos según la concentración basal de FSH (tabla 4). Los 3 grupos analizados (FSH<10, FSH≥10mUI/ml o desconocida) presentan una media de edad similar, por encima de los 40años. Los resultados clínicos son similares, con concentraciones bajas o desconocidas de FSH basal, para caer drásticamente en el grupo de FSH>10. De esta forma, la reserva ovárica sí parecer un factor predictivo de éxito en los ciclos naturales de nuestro estudio. Estas contradicciones respecto a los factores pronósticos en diferentes estudios (Schimberni y Morgia, 2009; Shaulov y Velez, 2015; Polyzos y Blockeel, 2012; Kolibianakis y Zikopoulos, 2004; Kedem y Tsur, 2014) pueden deberse en parte a los diferentes criterios de inclusión o protocolos aplicados (CN puro, CN modificado). En nuestro estudio, por ejemplo, el número de ciclos realizados en pacientes <35años ha sido prácticamente anecdótico (2,4%).
Para muchas pacientes y profesionales, un tratamiento de fertilidad con >70% de tasa de cancelación puede ser inaceptable. Pero debemos tener en cuenta que en muchas ocasiones, como ocurre en nuestra población, se aplica en mujeres de mal pronóstico extremo, con baja reserva y muchos ciclos previos de FIV convencional sin resultado y en las que la alternativa con más posibilidades de embarazo es la ovodonación. Para las pacientes que no acepten esta alternativa y quieran continuar intentándolo con gametos propios, parece obligatorio la búsqueda de protocolos más sencillos y menos agresivos, que reduzcan en la medida de lo posible el desgaste físico, anímico y económico.
En nuestro estudio la tasa de gestación por transferencia ha sido del 28,6%. Este dato no debe ser analizado de forma aislada, sino teniendo en cuenta que la edad media es de 40,7años, su FSH basal superior a 12 y que un 93% de las mismas tenían tratamientos de FIV convencional previos sin resultado. Las tasas de cancelación son muy altas, pero debemos recordar cómo consiguen llegar estas pacientes a transferencia (un único pinchazo, punción sin anestesia, 2-3 controles ecográficos) y si realmente el aumento de la complejidad del tratamiento (estimulación ovárica, sedación, gasto en medicación) mejora el pronóstico en estas pacientes, algo que no parece tan evidente a la vista de los resultados del último Registro de la SEF.
Es evidente que los protocolos de CN puro no pueden competir con la estimulación convencional en cuanto a tasa de embarazo por ciclo iniciado. Pero quizás el debate deba centrarse en si existen alternativas más seguras, sencillas y económicas a la EOC para un subgrupo de pacientes en las que los tratamientos convencionales no aumentan la rentabilidad del ciclo. Individualizando el tratamiento de cada paciente, y explicando las diferentes alternativas, con las ventajas e inconvenientes de cada protocolo, el ciclo natural parece ser una opción válida y con posibilidades reales de embarazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
María del Carmen Nogales. Laboratorio FIV. MSC, Clínica IVI-Madrid. Madrid. España