Existe evidencia actual de que los resultados perinatales de los recién nacidos de pacientes sometidas a fecundación in vitro (FIV) con transferencia de embriones en fresco (TEF) son peores en comparación con la transferencia de embriones congelados (TEC). Existen dudas sobre si la causa estaría relacionada con la técnica de vitrificación o con la estimulación ovárica realizada previo a la FIV. El objetivo de este estudio es comparar el riesgo de parto prematuro en pacientes sometidas a FIV según si realizaron TEF o TEC.
Material y métodosEstudio de cohorte retrospectivo con datos del Registro Nacional de Actividad de Técnicas de Reproducción Asistida-Registro de la Sociedad Española de Fertilidad entre 2010 y 2015, incluyendo a las mujeres con un embarazo único obtenido por FIV autóloga (FIV-AO) y FIV con donación de ovocitos (FIV-DO).
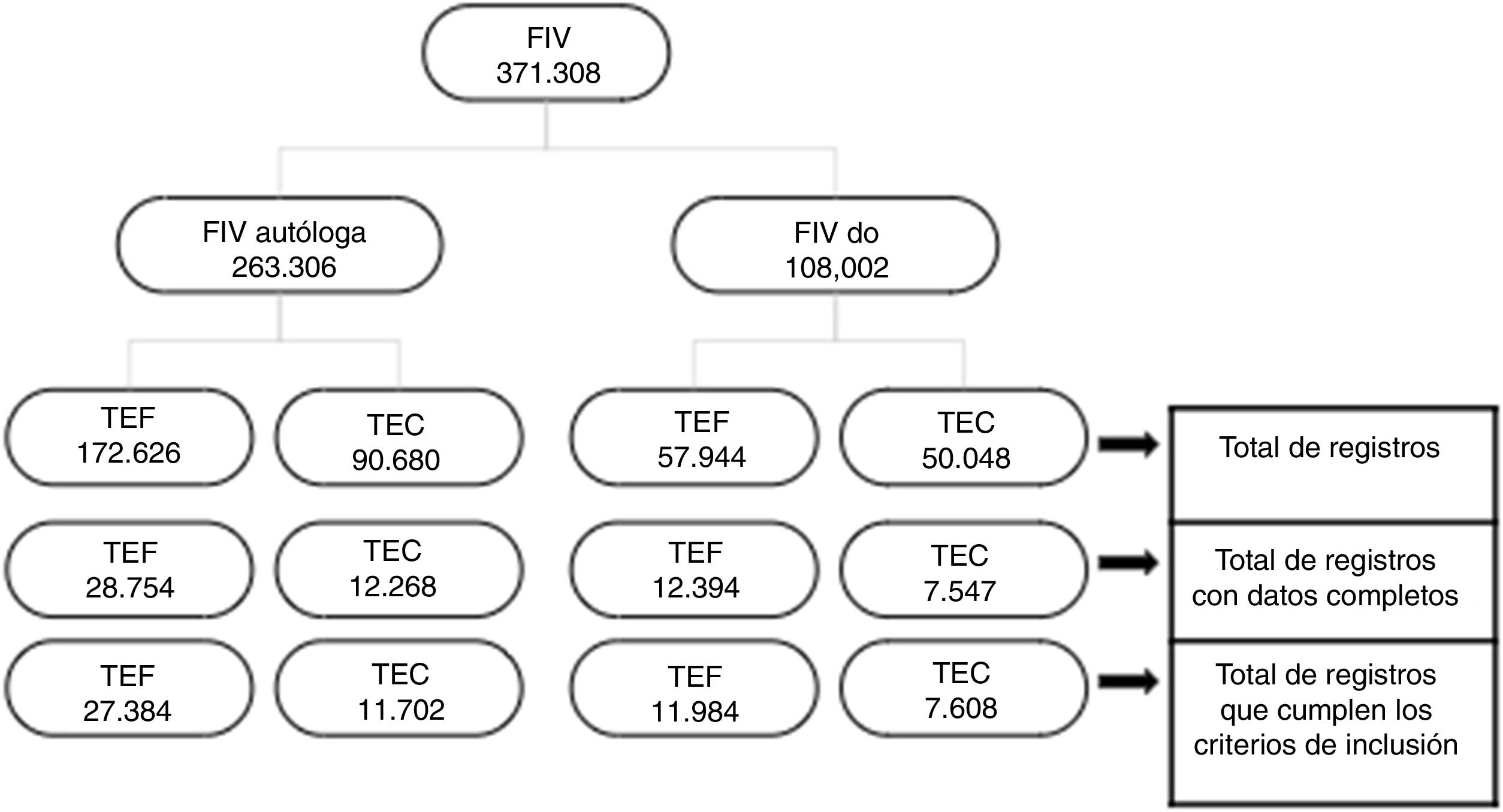
ResultadosSe registraron 371.308 ciclos de FIV: 263.306 FIV-AO (172.626 TEF y 90.680 TEC) y 108.002 FIV-DO (57.944 TEF y 50.048 TEC). La prevalencia de parto prematuro fue del 12% en FIV-AO y del 18,6% en FIV-DO. Se observó una disminución del riesgo de parto prematuro temprano después de la TEC solo en FIV-AO (OR: 0,87; IC 95%: 0,75-0,99), mientras que un aumento del riesgo de presentar parto prematuro tardío y moderado después de la TEC, tanto en FIV-AO (OR: 1,12; IC 95%: 1,04-1,20) como FIV-DO (OR: 1,17; IC 95%: 1,08-1,26).
ConclusionesTanto FIV-AO como FIV-DO presentan una elevada prevalencia de parto prematuro. La criopreservación se asocia con un menor riesgo de parto prematuro temprano en comparación con la TEF en pacientes sometidas a FIV-AO; no obstante, se observó un aumento del riesgo de parto prematuro tardío y moderado tanto en FIV-AO como en FIV-DO. Estos hallazgos deben ser analizados con precaución debido a las limitaciones metodológicas.
Current evidence suggest that perinatal outcomes of children of patients subjected to in vitro fertilisation (IVF) with fresh embryo transfer (ET) are worse compared to frozen embryo transfer (FET). There are doubts if the cause might be related to the technique of vitrification or ovarian stimulation performed in IVF. The aim of this study is to assess the risk of preterm delivery in patients undergoing IVF with fresh ET versus FET.
Material and methodsRetrospective cohort study using data from the National Registry of Assisted Reproduction Techniques Activity - Registry of the Spanish Fertility Society (RNATRA) from 2010 to 2015, including women with a singleton pregnancy following autologous IVF (IVF-AO), or IVF with donation of oocytes (IVF-DO).
ResultsA total of 371,308 cycles of IVF were performed, of which 263,306 followed IVF-AO (172,626 fresh ET, and 90,680 FET), and 108,002 underwent IVF-DO (57,944 fresh ET and 50,048 FET). The prevalence of preterm delivery was 12% in IVF-AO group and 18.6% in IVF-DO group. A decreased risk of early preterm delivery was observed after FET only in IVF-AO (OR: 0.87; 95% CI: 0.75-0.99), while an increased risk of late and moderate preterm delivery was found after FET, both in IVF-AO (OR: 1.12; 95% CI: 1.04-1.20) and IVF-DO (OR: 1.17; 95% CI: 1.08-1.26).
ConclusionsBoth IVF-AO and IVF-DO have a high prevalence of preterm delivery. Cryopreservation is associated with a lower risk of early preterm delivery compared to fresh ET in patients undergoing IVF-AO; however, an increased risk of late and moderate preterm delivery was observed in both IVF-AO and IVF-DO. These findings should be analysed with caution due to methodological limitations.
En la actualidad, uno de cada 50 recién nacidos en Europa, se conciben a través de técnicas de reproducción asistida (TRA) (De Geyter et al., 2018). Se ha sugerido que las TRA se relacionan con peores resultados perinatales al comparar con embarazos espontáneos (Pinborg et al., 2013).
Sin embargo, estos hallazgos no estarían asociados a la alta incidencia de embarazos múltiples en pacientes que se someten a fecundación in vitro (FIV). Estudios recientes demuestran que también los embarazos únicos luego de una FIV tienen un riesgo aumentado de parto prematuro, bajo peso al nacer, feto pequeño para la edad gestacional y un incremento en la tasa de malformaciones congénitas (Pinborg et al., 2013; Helmerhorst et al., 2004; Sazonova et al., 2011). Existe evidencia de que la estimulación ovárica controlada (EOC) podría estar asociada con estos resultados adversos (Helmerhorst and Keirse, 2016).
Se considera que los efectos de la EOC influyen negativamente sobre el ambiente uterino y endometrial, causando alteraciones en la implantación, decidualización y placentación en embarazos obtenidos luego de una FIV con transferencia de embriones en fresco (TEF). Aunque la TEF es la norma habitual en TRA, con el desarrollo de nuevas técnicas de criopreservación de embriones humanos, la proporción de ciclos con transferencia de embriones congelados (TEC) ha aumentado en la última década (Wong et al., 2014).
A diferencia de la TEF, la TEC se desarrollaría sobre un ambiente más fisiológico; pues al realizarse la transferencia embrionaria de manera diferida, el desarrollo embrionario precoz no estaría influido por la EOC. Por esta razón, se podría postular que los embarazos tras una FIV con TEC obtendrían mejores resultados perinatales al comparar con la transferencia en fresco (Roque et al., 2015).
Sin embargo, la evidencia ha revelado resultados contradictorios. Con respecto a la efectividad, un reciente ensayo clínico aleatorizado reportó una mayor chance de tener un recién nacido vivo por parte de los embarazos únicos con FIV-TEC en comparación con FIV-TEF (Wei et al., 2019); a diferencia de un metaanálisis de otros (Roque et al., 2019) ensayos clínicos aleatorizados que solo observó diferencias significativas en la tasa de nacidos vivos en el subgrupo de pacientes hiperrespondedoras (Roque et al., 2019).
Al examinar los resultados perinatales, también existe controversia, puesto que se han publicado resultados disímiles en cuanto al riesgo de presentar parto prematuro, bajo peso al nacer, síndrome hipertensivo del embarazo y mortalidad perinatal al comparar TEF versus TEC (Pinborg et al., 2013; Wei et al., 2019; Roque et al., 2019; Pelkonen et al., 2010; Pinborg et al., 2010; Sazonova et al., 2012; Maheshwari et al., 2012; Shih et al., 2008; Westergaard et al., 1999).
De los resultados perinatales adversos, el parto prematuro es la primera causa de mortalidad neonatal y la más común de hospitalización antenatal. Su incidencia varía de un 12% en EE. UU. a un 5-10% en Europa, y se asocia con un 70% de la muertes neonatales y un 36% de la muerte infantil, además de un 25-50% de los casos de niños con daño neurológico a largo plazo (Wapner and Jobe, 2011; American, 2016; American College of Obstetricians and Gynecologists, 2012; Delnord et al., 2015).
El parto prematuro es uno de los resultados perinatales adversos más estudiados dentro de los últimos reportes que comparan tanto embarazo espontáneo con FIV (Pinborg et al., 2013), como aquellos que comparan FIV con TEF versus TEC (Wei et al., 2019; Roque et al., 2019; Pelkonen et al., 2010; Pinborg et al., 2010; Sazonova et al., 2012; Maheshwari et al., 2012) y FIV con donación de ovocitos (FIV-DO) (Storgaard et al., 2017), siendo posible observar de manera generalizada una incidencia mayor de parto prematuro en los embarazos obtenidos por TRA.
El objetivo de este estudio fue evaluar si existen diferencias en cuanto al riesgo de parto prematuro en embarazos únicos tras FIV autóloga (FIV-AO) o FIV-DO comparando TEF versus TEC.
Material y métodoDiseño y settingSe realizó un estudio de cohortes retrospectiva utilizando datos del Registro Nacional de Actividad de Técnicas de Reproducción Asistida-Registro de la Sociedad Española de Fertilidad (RNATRA-Registro SEF) entre el año 2010 y 2015.
Este registro es gestionado por la Sociedad Española de Fertilidad (SEF) y cuenta con el apoyo de otras organizaciones como ASEBIR, ASESA y SEGO. La base de datos se compone de la información aportada por los centros de reproducción asistida de todo el país desde el año 2002. Durante el periodo en estudio, el número de centros colaboradores se incrementó de 103 en 2010 a 233 en 2015, y el número de ciclos de FIV de 45.025 a 82.056, respectivamente. La obtención de los datos se obtuvo por centro colaborador, directamente del RNATRA. Este estudio fue aprobado por los miembros del comité del RNATRA y del Ministerio de Sanidad, Servicios Sociales e Igualdad y se realizó de acuerdo a los Principios éticos para las investigaciones médicas en seres humanos de la Declaración de Helsinki de la Asociación Médica Mundial y el de las guías «Strengthening the Reporting of Observational Studies in Epidemiology» (STROBE) para estudios de cohorte (STROBE and The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) Statement, 2014).
Selección de participantes y recolección de datosSe identificaron 2 poblaciones para el estudio: mujeres sometidas a FIV-AO y a FIV-DO. En ambos grupos se realizó una subclasificación de acuerdo al tipo de transferencia embrionaria realizada: TEF o TEC.
Se incluyeron en el estudio solo aquellos casos en que se obtuvo un embarazo único y un parto después de las 22 semanas. Dentro de los criterios de exclusión se incluyeron aquellos embarazos con parto posterior a las 42 semanas, con información incompleta de edad gestacional al parto y embarazos múltiples. Se analizaron los números de transferencias realizadas por centro y la edad gestacional al parto.
No fue posible obtener características como la edad materna, la duración de la infertilidad, el número de embriones transferidos, el hábito tabáquico y el índice de masa corporal (IMC). Las TRA utilizadas durante el estudio fueron FIV, intracytoplasmic sperm injection (ICSI) o FIV-ICSI combinadas. La variable de resultado principal fue la edad gestacional al parto medida en semanas. Se obtuvieron los datos de edad gestacional estratificados en los siguientes subgrupos: parto a término (entre 37 y 42 semanas), prematuro moderado y tardío (32 a 37 semanas) y prematuro temprano (menor a 32 semanas). Se consideró que las 2 poblaciones en estudio, FIV-AO y FIV-DO, presentan teóricamente diferencias importantes entre sí, y al no contar con datos relacionados con variables de confusión fundamentales para poder ajustar los 2 grupos, se decidió por no compararlos.
Analisis estadisticoSe realizó la comparación entre TEF y TEC en cada grupo por separado (FIV-AO y FIV-DO), estimando la razón de probabilidades u odds ratio (OR) con un intervalo de confianza (IC) del 95%. Se consideró una p<0,05 como una mejor significación estadística. Todos los análisis estadísticos fueron realizados con el software STATA® (Stata/IC 13.1).
ResultadosPoblación en estudioUn total de 371.308 ciclos de FIV se realizaron durante el periodo de estudio. En el grupo de FIV-AO cumplieron con los criterios de inclusión 263.306 (172.626 y 90.680 después de TEF y TEC, respectivamente); y un total de 108.002 ciclos de FIV-DO cumplieron con los criterios de inclusión (57.944 y 50.048 después de TEF y TEC, respectivamente). En segunda instancia se eliminaron los casos con información incompleta. El total de pacientes se aprecia en la figura 1. Finalmente se excluyeron los partos posteriores a las 42 semanas.
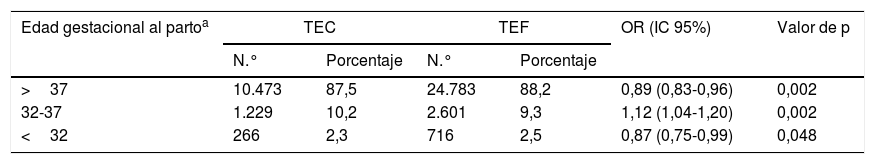
Resultados perinatalesEn el grupo de pacientes sometidas a FIV-AO se obtuvo una prevalencia de parto prematuro del 12%. Las pacientes con TEC presentaron una menor prevalencia de partos a término, un riesgo significativamente mayor de presentar parto prematuro moderado y tardío (OR: 1,12; IC 95%: 1,04-1,20) y un riesgo significativamente menor de presentar parto prematuro temprano (OR: 0,87; IC 95%: 0,75-0,99) (tabla 1).
Edad gestacional al parto de los recién nacidos según el tipo de transferencia embrionaria en FIV-AO
| Edad gestacional al partoa | TEC | TEF | OR (IC 95%) | Valor de p | ||
|---|---|---|---|---|---|---|
| N.° | Porcentaje | N.° | Porcentaje | |||
| >37 | 10.473 | 87,5 | 24.783 | 88,2 | 0,89 (0,83-0,96) | 0,002 |
| 32-37 | 1.229 | 10,2 | 2.601 | 9,3 | 1,12 (1,04-1,20) | 0,002 |
| <32 | 266 | 2,3 | 716 | 2,5 | 0,87 (0,75-0,99) | 0,048 |
OR y los IC al 95% se calcularon utilizando el grupo TEF como referencia.
FIV: fecundación in vitro; FIV-AO: FIV autóloga; IC: intervalo de confianza; OR: odds ratio; TEC: transferencia de embriones congelados; TEF: transferencia de embriones en fresco.
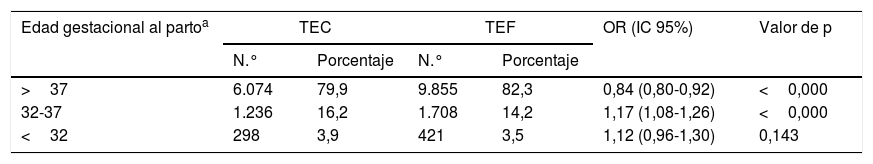
En las pacientes sometidas a FIV-DO se obtuvo una prevalencia de parto prematuro del 18,6%. Las pacientes con TEC presentaron una menor prevalencia de partos a término y un riesgo significativamente mayor de presentar parto prematuro moderado y tardío (OR: 1,17; IC 95%: 1,08-1,26). No se observaron diferencias al evaluar el riesgo de parto prematuro temprano (tabla 2).
Edad gestacional al parto de los recién nacidos según tipo de transferencia embrionaria en FIV-DO
| Edad gestacional al partoa | TEC | TEF | OR (IC 95%) | Valor de p | ||
|---|---|---|---|---|---|---|
| N.° | Porcentaje | N.° | Porcentaje | |||
| >37 | 6.074 | 79,9 | 9.855 | 82,3 | 0,84 (0,80-0,92) | <0,000 |
| 32-37 | 1.236 | 16,2 | 1.708 | 14,2 | 1,17 (1,08-1,26) | <0,000 |
| <32 | 298 | 3,9 | 421 | 3,5 | 1,12 (0,96-1,30) | 0,143 |
OR y los IC al 95% se calcularon utilizando el grupo TEF como referencia.
FIV: fecundación in vitro; FIV-DO: FIV con donación de ovocitos; IC: intervalo de confianza; OR: odds ratio; TEC: transferencia de embriones congelados; TEF: transferencia de embriones en fresco.
Para la población en estudio, existe una menor prevalencia de parto a término en las pacientes después de una TEC, tanto en el grupo de FIV-AO como de FIV-DO. En FIV-AO, la TEC se asoció a un mayor riesgo de tener un parto prematuro tardío y moderado, y un menor riesgo de tener un parto prematuro temprano. En FIV-DO, la TEC también se asoció a un mayor riesgo de tener un parto prematuro tardío y moderado, pero no se encontraron diferencias en el riesgo de tener un parto prematuro temprano comparado con TEF.
Nuestros resultados están de acuerdo con lo publicado en algunos estudios (Belva et al., 2008; Aflatoonian et al., 2016); y en discordancia con otros (Wei et al., 2019; Roque et al., 2019; Wennerholm et al., 2013). La prevalencia de parto prematuro fue elevada en ambos grupos, observándose un 12% en FIV-AO y un 18,6% en FIV-DO, similar a lo reportado en otras publicaciones (Ishihara et al., 2014; Rodriguez-Wallberg et al., 2019). Nuestro estudio requiere de más datos demográficos y obstétricos a fin de poder estimar un OR ajustado a variables de confusión.
Un reciente metaanálisis reportó un menor riesgo de parto prematuro bajo las 37 semanas en TEC comparado con TEF en embarazos únicos (OR: 0,90; IC 95%: 0,84-0,97) (Maheshwari et al., 2018), sin embargo en nuestro estudio el riesgo solo fue menor para los partos menores de 32 semanas.
Existen diversas hipótesis que podrían explicar este hallazgo en pacientes sometidas a FIV-AO. Algunos argumentan que la congelación y la descongelación eliminaría los embriones «débiles» y permitiría solo a los más «fuertes» sobrevivir, optimizando los resultados perinatales (Shih et al., 2008; Van Landuyt et al., 2013; Wada et al., 1994). Sin embargo, la teoría que cobra más fuerza propone que el efecto de los niveles supra fisiológicos de estradiol durante la EOC podría generar diversas alteraciones en en el endometrio, las que se relacionarían posteriormente con una decidualización y placentación defectuosa (Pinborg et al., 2010; Shih et al., 2008; Kalra et al., 2011; Healy et al., 2010).
Por otra parte, si bien el parto prematuro es reconocido como un síndrome multifactorial, estudios recientes postulan que en aquellos catalogados como «espontáneos», una entidad conocida como «insuficiencia placentaria» podría contribuir con una gran proporción de los casos (Morgan et al., 2013). La insuficiencia placentaria se caracteriza por un desarrollo anómalo de la placenta, perfusión defectuosa y un transporte deficiente de nutrientes, asociándose además con el desarrollo de preeclampsia y la restricción de crecimiento fetal (Misra et al., 2009; Morgan, 2016). Muchos de los resultados perinatales adversos relacionados con las TRA, especialmente aquellos ciclos con EOC y TEF, forman parte de los síndromes obstétricos asociados a insuficiencia placentaria. En este caso, los niveles supra fisiológicos de estradiol al momento de la implantación contribuirían con la génesis de una placentación anómala (Shih et al., 2008; Kalra et al., 2011; Healy et al., 2010).
Estudios en animales han relacionado las concentraciones elevadas de estrógenos con una afectación de la invasión trofoblástica y la remodelación de las arterias espirales uterinas 39,40, y posteriores estudios en humanos los han vinculado con resultados obstétricos adversos relacionados con insuficiencia placentaria; aunque esta asociación no ha sido demostrada aún para parto prematuro (Imudia et al., 2012), o no ha sido incluido como variable en las investigaciones (Farhi et al., 2010; Hu et al., 2014; Royster et al., 2016; Pereira et al., 2017).
Dado que la acción de las TRA sobre la función placentaria podría explicar los peores resultados perinatales, diversos marcadores del primer trimestre, como la proteína plasmática asociada al embarazo (PAPP-a) y la subunidad B de HCG (BHCG), han sido estudiados como predictores de insuficiencia placentaria (Morris et al., 2017), incluyendo al parto prematuro (Pornwattanakrilert et al., 2018), con resultados dispares. Por un lado, un estudio de cohorte retrospectiva reportó que en embarazos obtenidos por FIV existen niveles más bajos de PAPP-A y B-HCG que aquellos con gestación espontánea, observándose una mayor incidencia de parto prematuro bajo las (Van Landuyt et al., 2013; Healy et al., 2010; Misra et al., 2009) semanas en el grupo FIV (Zhong et al., 2011). En contraste, otro estudio de cohorte retrospectivo, no encontró asociación entre las concentraciones suprafisiológicas de estradiol en TRA y el parto prematuro (Wang et al., 2017); y un segundo estudio que relacionó las 3 variables, PAPP-A, estradiol y parto prematuro, tampoco encontró ninguna asociación (Dunne et al., 2017).
Recientemente ha sido publicada una revisión sistemática con metaanálisis de 15 estudios que reportó mayor incidencia de parto prematuro en TRA, y mayor incidencia en el subgrupo de TEF comparado con TEC, concluyendo que la posible disfunción placentaria a partir de la EOC es una clave fundamental en la etiología del parto prematuro espontáneo en FIV (Cavoretto et al., 2018).
En nuestro estudio, al incluir a la población de pacientes con FIV-DO, se puede aislar el posible efecto perjudicial de la EOC, puesto que las pacientes receptoras no son sometidas a los niveles supra fisiológicos de estradiol. Dos estudios que consideraron este modelo reportaron diferencias en el peso al nacer solo en pacientes FIV-AO (con EOC) y no en pacientes FIV-DO (sin EOC), restando importancia al factor vitrificación y desvitrificación de embriones sobre los resultados perinatales (Galliano et al., 2015; Vidal et al., 2017). Sin embargo, la elevada prevalencia de parto prematuro en las pacientes FIV-DO, en comparación con la FIV-AO, permite concluir que existen otros factores relacionados con este resultado perinatal adverso.
Un metanálisis de 14 estudios publicado recientemente por nuestro equipo, reportó un elevado riesgo de presentar resultados perinatales adversos en pacientes FIV-DO, destacando el síndrome hipertensivo del embarazo y preeclampsia. Se ha postulado que el riesgo de presentar parto prematuro en este grupo de pacientes podría estar influido por la elevada prevalencia de preeclampsia, puesto que al ajustar por esta variable las pacientes FIV-DO no presentaron diferencias en el riesgo de parto prematuro en comparación con FIV-AO54.
Fortalezas y debilidadesNuestro reporte tiene el mérito de que al tratarse de un registro nacional, cuenta con una gran cohorte para observar por un periodo de 5 años. Además, es uno de los pocos reportes que han estudiado FIV-DO y su asociación con el parto prematuro.
Dentro de las limitaciones podemos incluir que se trata de un estudio de cohortes retrospectivo. Además, hay datos relevantes que no estaban disponibles en la base de datos como la edad materna, la paridad, el tabaco, el IMC, por lo tanto, no se pudieron ajustar los grupos con estas variables de confusión, ni comparar tampoco entre ambos grupos. Por tratarse de una base de datos a lo largo de varios años con anonimato de los registros, algunos casos podrían corresponder a embarazos subsecuentes de la misma paciente usando sus embriones congelados. No existen datos sobre la preparación endometrial, aunque según la literatura no habrían diferencias en cuanto a la forma de preparar el endometrio (Ghobara and Vandekerckhove, 2008).
No sabemos si todos los embriones congelados fueron por vitrificación o también hay congelación lenta. Las diferentes etiologías de parto prematuro no han sido clarificadas en este estudio, y tampoco existe un registro a largo plazo del desarrollo de los pacientes y sus secuelas.
Implicaciones para la práctica clínica y futuros estudiosLa prematuridad es uno de los resultados perinatales adversos con mayor impacto en el sistema sanitario, y efectos a largo plazo que incluyen secuelas a nivel neurológico y de comportamiento, lo cual explica la importancia de realizar estudios que permitan ahondar en su epidemiología y prevención (Jarjour, 2015). Es de importancia el poder generar una clasificación clara del parto prematuro, generando una distinción objetiva entre las formas espontáneas o iatrogénicas (vanʼt Hooft et al., 2016).
Nuestro estudio muestra una elevada prevalencia de parto prematuro tanto en embarazos obtenidos por FIV-AO como por FIV-DO. Una vez conocido esto, es muy importante el cribado en este grupo específico de pacientes, a fin de poder aplicar estrategias preventivas. Se requiere más investigación sobre el efecto que tienen la esterilidad y las TRA sobre los resultados perinatales.
Por el lado de los ciclos con TEF, futuros estudios deben intentar dilucidar la asociación entre los niveles supra fisiológicos de estradiol, insuficiencia placentaria y parto prematuro espontáneo. Si bien existe evidencia que demuestra asociación entre marcadores del primer trimestre alterados y malos resultados perinatales, futuros estudios bien diseñados deben enfocarse en dilucidar si aquella asociación está mediada por la EOC y los niveles de estrógenos elevados. Nuevos marcadores placentarios se encuentran en proceso de validación y deben incorporarse paulatinamente al cribado de pacientes sometidas a TRA con y sin EOC a fin de evaluar su impacto en los resultados perinatales (Sahraravand et al., 2016; Sun et al., 2019; Senapati et al., 2018).
Por otra parte, la evidencia actual muestra que la transferencia diferida se relaciona con mejores tasas de éxito, costos reducidos (Roque et al., 2015; Wei et al., 2019; Roque et al., 2019) y posiblemente mayor seguridad tomando en cuenta la reducción de algunos riesgos obstétricos en comparación con la TEF; como por ejemplo el parto prematuro temprano. Se necesitan ensayos clínicos aleatorios que evalúen aspectos específicos de la transferencia diferida, como la preparación endometrial con ciclo natural versus artificial y la criopreservación de embriones, y su efecto sobre el parto prematuro.
ConclusionesLos recién nacidos únicos de pacientes que consiguen un embarazo con FIV-AO y FIV-DO presentan una elevada prevalencia de parto prematuro.
La criopreservación se asocia con un menor riesgo de parto prematuro temprano en comparación con la TEF en pacientes sometidas a FIV-AO; no obstante, se observó un aumento del riesgo de parto prematuro tardío y moderado tanto en FIV-AO como en FIV-DO.
Nuestros hallazgos deben ser analizados con precaución debido a las limitaciones metodológicas. Se requiere de futuros estudios, idealmente ensayos clínicos randomizados o meta análisis de datos individuales a fin de obtener una mejor calidad de evidencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.