En esta última década se ha cuestionado el rol de la mamografía como método de screening para el cáncer de mama, relativizando su impacto en la disminución de la mortalidad por esta enfermedad.
Los ensayos clínicos randomizados se iniciaron en la década de los sesenta y los primeros metaanálisis mostraron el beneficio de la mamografía con una reducción de la mortalidad cercana al 30% en las mujeres sometidas a la intervención versus las que no, lo que justificaría la implementación de programas poblacionales masivos.
El énfasis de algunos científicos ha estado puesto en la crítica a los ensayos publicados, respecto a su falta de rigurosidad metodológica y a la revisión de estos, con estrictos estándares. Revisiones sistemáticas de la literatura y un metánalisis reciente han mostrado un menor beneficio de la mamografía y abierto la discusión sobre el costo beneficio de los programas de pesquisa precoz del cáncer de mama mediante mamografía.
Paralelamente se ha focalizado la atención en los daños asociados a los programas de screening, siendo el más importante el sobrediagnóstico y el subsecuente sobretratamiento.
Se revisa en este artículo los puntos más críticos de estas publicaciones, considerando el nuevo escenario que enfrentan médicos y pacientes frente a la decisión de incorporarse a un programa de screening mamográfico. Es imperativo que las mujeres estén debidamente informadas sobre la evidencia actual del beneficio y daños del screening.
Como contraparte, continúan los programas y en especial el seguimiento mamográfico a más largo plazo, que podría entregar nueva información, mejora la tecnología, el control de calidad de los procesos y conocimiento sobre la genética y biología molecular de los tumores, todos factores que podrían mejorar la pesquisa precoz del cáncer de mama.
During the last decade, the role of the mammography has been questioned as a screening method for breast cancer and its impact in mortality, reduction due to this illness. Randomized clinical essays began during the sixties and the first meta-analyses showed the benefits of a mammography in the decrease of mortality, nearly 30% in women under treatment, against the one who were not treated; therefore, this reduction justifies the implementation of large and massive programs for women.
Some scientists criticized the lack of methodology quality of the published essays, using high standards review. Current systematic reviews and a new meta-analysis have given less advantages for mammography, and have opened a discussion between the costs- benefits of programs focused on screening and early detection through mammography.
Parallel to this, it has been studied the damages associated with the screening programs being the over-diagnosis and the over-treatment the most important ones.
In this article, the most critical topics of the publications are revised, taking into consideration the new “scenario” that doctors and patients face, whether deciding to be part of a screening mammographic program. It is mandatory that women should know about the existing benefits and damages of the screening.
On the other side, programs continue to be developed specially the long-range tracing mammographic one, which can give new data, can improve technology and can control the high standards of these processes. Also allowed the acquisition of new concepts on genetics and molecular biology of tumors. All these factors could improve the screening of early breast cancer.
El cáncer de mama es actualmente, una causa importante de mortalidad entre las mujeres, y en Chile ocupa el primer lugar en las causas de muerte por cáncer.
La mamografía ha sido considerada la herramienta básica para el screening de cáncer de mama y el único método diagnóstico que ha tenido impacto en la disminución de la mortalidad por esta enfermedad (1-4). Esto, considerando que la mamografía tiene una sensibilidad que va desde el 77 al 95%, con una especificidad de 94 a 97% (5).
Las condiciones que debe satisfacer un programa de screening para cáncer son:
- 1.
Contar con un tratamiento adecuado para el cáncer, y este debe ser más eficaz para los casos identificados por screening.
- 2.
El cáncer debe tener una prevalencia alta que justifique el screening.
- 3.
Tener un impacto grave en la morbimortalidad por la enfermedad (6).
El propósito del screening es disminuir la mortalidad, detectando el cáncer de mama en cualquier estadio más precoz y potencialmente más curable que el encontrado en ausencia de screening.
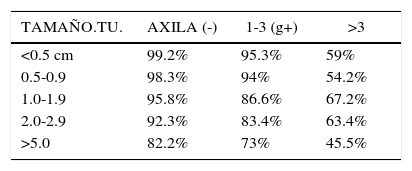
El pronóstico del cáncer mamario está directamente relacionado con el tamaño tumoral, por lo tanto para disminuir la tasa de mortalidad hay que encontrarlos y tratarlos cuando son pequeños. La sobrevida a 5 años en tumor de 1 cm. sin compromiso axilar es de 98.3% (7). (Tabla 1).
Sobrevida a 5 años dependiendo del tamaño tumoral y compromiso axilar
| TAMAÑO.TU. | AXILA (-) | 1-3 (g+) | >3 |
|---|---|---|---|
| <0.5 cm | 99.2% | 95.3% | 59% |
| 0.5-0.9 | 98.3% | 94% | 54.2% |
| 1.0-1.9 | 95.8% | 86.6% | 67.2% |
| 2.0-2.9 | 92.3% | 83.4% | 63.4% |
| >5.0 | 82.2% | 73% | 45.5% |
Modificado de: Carter. Relation of tumor size, lymph node status, and survival in 24,740 breast cancer cases. Cancer 1989;63:181.
Desde 1990 en adelante aumentó la incidencia de cáncer mamario, con un significativo aumento de los cánceres en estadios iniciales. El riesgo de desarrollar un cáncer de mama en 10 años es:
1 en 69 a los 40 años
1 en 42 a los 50 años
1 en 29 a los 60 años. (8)
El riesgo de cáncer de mama a lo largo de la vida es 1 en 12 en 1980 y 1 en 8 en 2009.
En 2002 empezó a disminuir el cáncer mamario en EE.UU. lo que se atribuyó principalmente a la disminución en el uso de terapia de sustitución hormonal (9) y también a la estabilización en el uso del screening con mamografía.
La tabla siguiente muestra el número de cánceres esperables de encontrar cada mil mamografías de screening según las distintas décadas de la población estudiada. (Tabla 2).
Tasa de incidencia de cáncer mamario en programas de screening
| 40-49 años | 1.6 × 1000 mamografías/año |
| 50-59 años | 2.5 × 1000 mamografías/año |
| 60-69 años | 3.8 × 1000 mamografías/año |
| 70-79 años | 4.3 × 1000 mamografías/año |
Modificado de Sickles EA. Medical Audit of mammography screening practice. Radiology 1990; 175: 323-327
La aceptación del screening se basa en la evidencia del beneficio de la exploración mediante ensayos clínicos randomizados, que impliquen:
- 1.
La disminución del tamaño y etapa de los cánceres al momento del diagnóstico
- 2.
Aumento de la sobrevida atribuible a la exploración (10).
Para lograr estos objetivos, los dos requisitos claves de un programa de screening son la sensibilidad del método para la detección y el tiempo de intervalo entre el inicio del estadio preclínico detectable y el punto de progreso al estadio clínico, causante de los signos que son detectables por el examen físico.
Este intervalo se llama sojourn time.
El sojourn time es una medida de cuán precoz puede ser detectada la enfermedad mediante el screening (Tabla 3).
Si el intervalo es mayor al promedio del sojourn time, aumentan los cánceres de intervalo y empeora el pronóstico de los cánceres incidentalmente detectados.
El lead time se define como el tiempo ganado al hacer el diagnóstico antes de que el paciente presente síntomas. Puede variar desde la mitad del sojourn time en el estadio preclínico hasta el sojourn time completo.
Mientras más largo sea el lead time, mayor probabilidad de detectar la enfermedad en un estadio temprano.
Respecto a la sensibilidad, es primordial el uso de tecnología de excelencia, control de calidad de los procesos según las normas estándares vigentes y que el programa sea realizado por tecnólogos y radiólogos experimentados y debidamente acreditados.
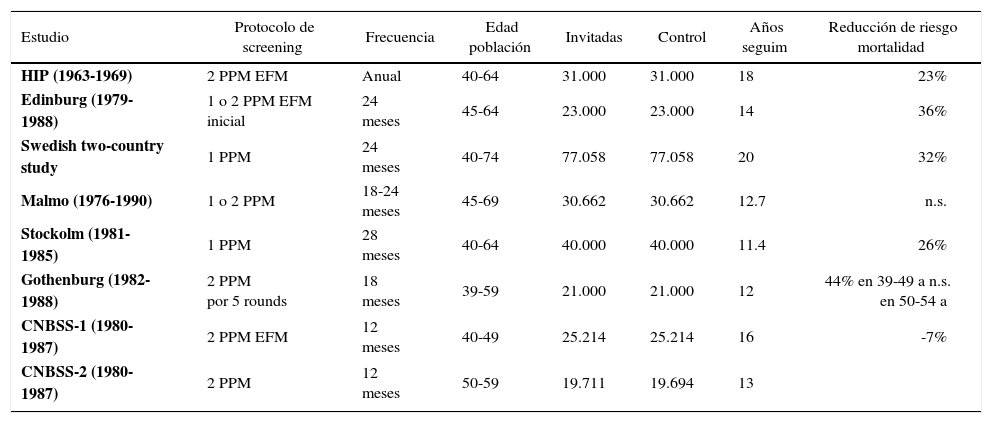
Evidencia científica sobre la efectividad del screening mamográficoPara estimar la efectividad de manera confiable, es necesario realizar estudios de screening en el marco de ensayos clínicos aleatorios. (Tabla 4).
Resumen de estudios controlados randomizados en screening de mama
| Estudio | Protocolo de screening | Frecuencia | Edad población | Invitadas | Control | Años seguim | Reducción de riesgo mortalidad |
|---|---|---|---|---|---|---|---|
| HIP (1963-1969) | 2 PPM EFM | Anual | 40-64 | 31.000 | 31.000 | 18 | 23% |
| Edinburg (1979-1988) | 1 o 2 PPM EFM inicial | 24 meses | 45-64 | 23.000 | 23.000 | 14 | 36% |
| Swedish two-country study | 1 PPM | 24 meses | 40-74 | 77.058 | 77.058 | 20 | 32% |
| Malmo (1976-1990) | 1 o 2 PPM | 18-24 meses | 45-69 | 30.662 | 30.662 | 12.7 | n.s. |
| Stockolm (1981-1985) | 1 PPM | 28 meses | 40-64 | 40.000 | 40.000 | 11.4 | 26% |
| Gothenburg (1982-1988) | 2 PPM por 5 rounds | 18 meses | 39-59 | 21.000 | 21.000 | 12 | 44% en 39-49 a n.s. en 50-54 a |
| CNBSS-1 (1980-1987) | 2 PPM EFM | 12 meses | 40-49 | 25.214 | 25.214 | 16 | -7% |
| CNBSS-2 (1980-1987) | 2 PPM | 12 meses | 50-59 | 19.711 | 19.694 | 13 |
Modificado de: Welch HG, Black WC. Evaluating randomized trials of screening. J Gen Intern Med 1997: 12: 118-24.
La información inferida de los primeros metaánalisis mostraba una disminución de la mortalidad por cáncer de mama de aproximadamente 25-30%, lo que impulsó la implementación de más programas y en especial, a considerar el screening mamográfico como el pilar fundamental en la reducción de la mortalidad por esta enfermedad.
Se han realizado numerosos ensayos clínicos de gran tamaño en Norteamérica y Europa, que incluyen en conjunto, unas quinientas mil mujeres aproximadamente.
Todo este gran número de estudios y evaluaciones ha generado controversias respecto al screening mamográfico, en gran parte debido a las diferentes estrategias que han utilizado en los estudios, o bien por la gran diversidad de políticas de screening existentes en los distintos países.
Hay 8 ensayos publicados que han sido reevaluados (Nueva York en EE.UU, Malmo en Estocolmo, Goteborg y Two County en Suecia, Edimburgo y UK Age Trial en el Reino Unido, y NBSS en Canadá.), dos revisiones sistemáticas de la literatura (Deck W, AETMIS 2006), y US PREVENTIVE TASK FORCE (2009); y un metanálisis (Gotzsche PC, Nielsen M. 2008. The Cochrane Library, actualizada en 2011).
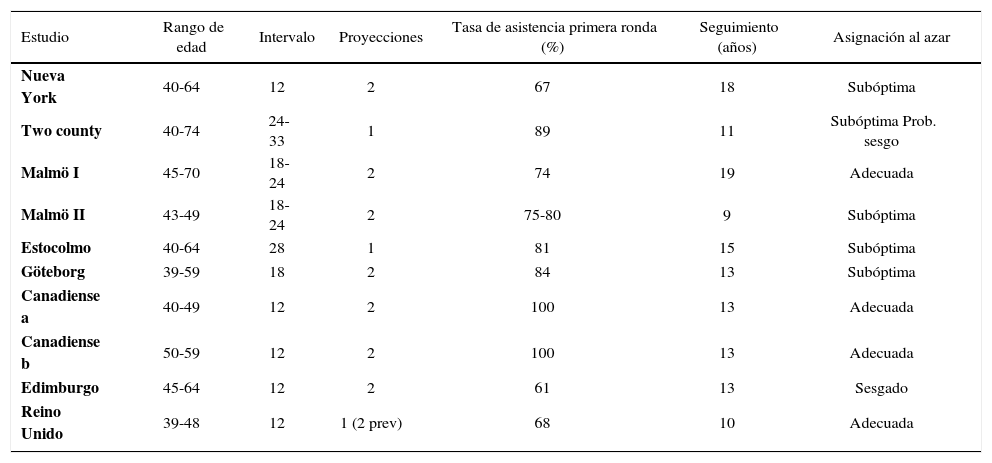
La revisión Cochrane (11) incluyó siete ensayos ramdomizados, en algunos de los cuales, importante información metodológica y tipo de tratamientos efectuados a las mujeres con cáncer, no fueron publicados hasta muchos años después.
Se midió si la asignación al azar fue adecuada (Tabla 4) identificando grupos comparables, con criterios estándares lo más estrictos posibles, extrayendo posteriormente los datos para estimar la efectividad de los ensayos: número de mujeres randomizadas, método de randomización, exclusiones, tipo de mamografía, número de screenings, intervalo entre los mismos, número de cánceres identificados, mortalidad por cáncer de mama, cáncer en general y mortalidad por cualquier otra causa. Así mismo se investigó posibles daños de la mamografía, utilización de intervenciones quirúrgicas, quimioterapia, radioterapia y hormonoterapia. (Tabla 5).
Características de los ensayos
| Estudio | Rango de edad | Intervalo | Proyecciones | Tasa de asistencia primera ronda (%) | Seguimiento (años) | Asignación al azar |
|---|---|---|---|---|---|---|
| Nueva York | 40-64 | 12 | 2 | 67 | 18 | Subóptima |
| Two county | 40-74 | 24-33 | 1 | 89 | 11 | Subóptima Prob. sesgo |
| Malmö I | 45-70 | 18-24 | 2 | 74 | 19 | Adecuada |
| Malmö II | 43-49 | 18-24 | 2 | 75-80 | 9 | Subóptima |
| Estocolmo | 40-64 | 28 | 1 | 81 | 15 | Subóptima |
| Göteborg | 39-59 | 18 | 2 | 84 | 13 | Subóptima |
| Canadiense a | 40-49 | 12 | 2 | 100 | 13 | Adecuada |
| Canadiense b | 50-59 | 12 | 2 | 100 | 13 | Adecuada |
| Edimburgo | 45-64 | 12 | 2 | 61 | 13 | Sesgado |
| Reino Unido | 39-48 | 12 | 1 (2 prev) | 68 | 10 | Adecuada |
Modificado de: Gotzsche PC, Nielsen M.Screening for breast cancer with mammography. Cochrane Database for Systematic Reviews 2009.
La reevaluación de los ensayos mostró una disminución de un 19% de la mortalidad por cáncer de mama a los 13 años: RR 0,81 (IC 95% 0,67 a 0,83) considerando todos los estudios.
Hubo 3 ensayos con asignación al azar adecuada que mostraron una disminución del 10%: RR 0,90 (0,79 a 1,02) y 4 ensayos con asignación al azar subóptima, un 25%: RR 0,75 (0,67).
La conclusión de los autores fue que: “el screening mamográfico probablemente reduce la mortalidad por cáncer de mama. Sobre la base de todos los ensayos, la reducción es de un 20%, pero como el efecto es menor en los ensayos de calidad más alta, una estimación más razonable es de una reducción del 15% en el riesgo relativo. La reducción del riesgo absoluto fue del 0.05%”.
Se analiza y detalla además el efecto adverso, o dañino del screening respecto al sobrediagnóstico, entendiendo por éste, el diagnóstico establecido desde el punto de vista histológico, de un cáncer intraductal o invasor que nunca se habría convertido en un tumor clínicamente manifiesto durante la esperanza de vida normal de una paciente si no se hubiese efectuado el screening.
El 21% de los cánceres identificados solo por mamografía son in situ y la mayoría de ellos no progresaría hacia un invasor.
Por lo tanto, el screening provoca sobrediagnóstico y sobretratamiento, con un aumento del 30% en la estimación o un aumento del 0.5% en el riesgo absoluto. Lo anterior significa que por cada 2.000 mujeres a las que se les recomienda realizarse el screening durante 10 años, en una se prolongará su vida. Además, diez mujeres sanas, que no se hubieran diagnosticado si no se les hubiera realizado el screening, se diagnosticarán como pacientes con cáncer de mama y recibirán tratamiento innecesariamente.
“Por lo tanto, no está claro si el screening presenta más beneficios que daños. Las mujeres a las que se les recomienda realizarse el screening deben estar completamente informadas sobre los beneficios y los daños”.
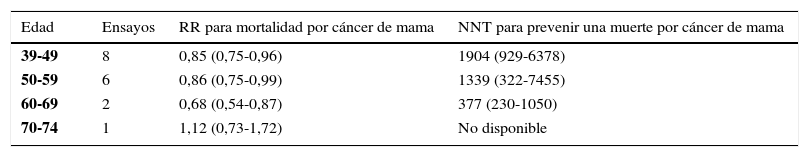
Otra importante revisión sistemática fue efectuada en Norteamérica en 2009: Preventive Service Task Force (12, 13) evaluó 8 estudios clínicos ramdomizados, catalogados de calidad aceptable, evaluando la mortalidad en las mujeres entre 39 y 69 años. Los datos para las mujeres mayores fueron insuficientes. (Tabla 6).
Ensayos de screening con mamografía
| Edad | Ensayos | RR para mortalidad por cáncer de mama | NNT para prevenir una muerte por cáncer de mama |
|---|---|---|---|
| 39-49 | 8 | 0,85 (0,75-0,96) | 1904 (929-6378) |
| 50-59 | 6 | 0,86 (0,75-0,99) | 1339 (322-7455) |
| 60-69 | 2 | 0,68 (0,54-0,87) | 377 (230-1050) |
| 70-74 | 1 | 1,12 (0,73-1,72) | No disponible |
Modificado de: Gotzsche PC, Nielsen M. Screening for breast cancer with mam-mography. Cochrane Database for Systematic Reviews 2009.
Los autores sugieren:
- 1.
Eliminar el screening con mamografía rutinaria entre los 40 a 49 años debido a que el beneficio absoluto es pequeño (es necesario realizar 1.904 mamografías para salvar 1 vida según se observa en la tabla 6).
- 2.
Efectuar el screening con mamografía bianual desde los 50 a 74 años. Los efectos adversos de falsos positivos (recomendación de proyecciones adicionales, ultrasonido o biopsia que resultarán negativas para cáncer) son menos frecuentes que en las mujeres menores de 40 años.
- 3.
Extender el screening rutinario de los 70 a los 74 años (basado en estimaciones derivadas de modelos estadísticos).
A su vez, consideraron que las experiencias adversas son comunes, transitorias y no afectan la práctica del screening.
Los beneficios y daños del screening siguen siendo un importante tópico de investigación, pues la evidencia muestra que aumenta la detección de cánceres “indolentes”, probablemente no diagnostica los cánceres más agresivos (screening sin suficiente frecuencia: cánceres de intervalo).
El screening es sensible, pero no tiene la habilidad para distinguir entre los cánceres de alto y bajo riesgo, lo que aumenta la posibilidad de sobretratamientos.
Es posible que sea ventajoso efectuar el screening de forma más personalizada, identificando a las mujeres que combinen algunos factores de riesgo como mamas densas, uso de terapia hormonal de reemplazo (estrógeno más progestina por más de 5 años), obesidad postmenopáusica, historia familiar de cáncer de mama, historia de biopsias mamarias previas y otros; de modo tal de equilibrar los beneficios respecto de los daños (14-17).
Las pacientes portadoras de los genes BRCA 1 y BRCA 2 constituyen un grupo de particular alto riesgo que debe iniciar su screeening mamográfico antes de los 40 años e incluir seguimiento con resonancia mamaria (18).
Aunque un metaanálisis de ECR haya mostrado una reducción de la mortalidad de 15%, publicaciones recientes han mostrado cifras considerablemente más altas como un estudio sueco en el que hubo 29% menos de muertes por cáncer de mama en las mujeres sometidas a screening, después de 16 años, respecto de las mujeres sin el screening (19).
Respecto al alto riesgo de falsos positivos reportados, tan altos como el 50% a lo largo de una década de screening, acompañados de ansiedad temporal (20), existen también reportes de mujeres que los aceptan en favor del hallazgo de un cáncer en un estadio precoz (21).
Una serie reciente mostró que las mujeres cuyos cánceres fueron diagnosticados sin mamografía presentaron mayor cantidad de cánceres en estadio II o tumores más grandes que las mujeres que fueron diagnosticadas por la mamografía (66% vs. 27%), mayor número de mastectomías (47% vs. 25 %), tratamiento quirúrgico, radio y quimioterapia (59% vs. 31%) y tuvieron menor sobrevida a los 5 años (22).
SíntesisEl tema continúa siendo controversial, y si bien es posible que se haya magnificado el beneficio absoluto del screening mamográfico, minimizado el sobre diagnóstico y que se cuente en la actualidad con mejores tratamientos para el cáncer (que han impactado también en la disminución de la mortalidad incluso en los estados avanzados), la decisión respecto a someterse al screening dependerá del balance entre los beneficios y daños que haga cada mujer debidamente informada.
Es común en nuestra práctica como radiólogos de mama, ver mujeres que aceptan el alto riesgo de falsos positivos y la ansiedad que les genera el screening en favor del hallazgo de un cáncer en estadio precoz.
Parece plausible que el seguimiento mamográfico a más largo plazo, el avance de la tecnología y mejoramiento del control de la calidad de los procesos puedan entregar nueva información que permita reanalizar el rol que va a tener la mamografía.
Por otro lado, el conocimiento sobre la genética y biología molecular de los tumores, son factores que apuntan a mejorar la pesquisa precoz del cáncer de mama, y puede ser que se transformen en una nueva herramienta de screening.
La autora declara no tener conflictos de interés, con relación a este artículo.