La enfermedad inflamatoria intestinal pediátrica (EIIP) es una patología inflamatoria crónica de origen multifactorial. Su incidencia está en aumento a nivel mundial y nuestro país estaría experimentando este cambio. Se puede iniciar en edades muy precoces o más tardía en la adolescencia. Clásicamente se manifiesta con diarrea con o sin sangre, dolor abdominal, baja de peso y falla en el crecimiento, también puede tener síntomas extraintestinales los cuales pueden ser la única manifestación inicialmente. El diagnóstico se realiza en base a la historia clínica, examen físico, imágenes y endoscopia con biopsia, estas últimas permitirán confirmar el diagnóstico. Se han descrito dos estrategias de tratamiento top down y step up, en ambas el objetivo es la curación de la mucosa. La clave del manejo se centra en el control de síntomas y de la inflamación evitando las complicaciones de la enfermedad y los efectos secundarios de los tratamientos.
Pediatric inflammatory bowel disease (PIBD) is a chronic inflammatory disease of multifactorial origin. Its incidence is increasing worldwide and our country would be experiencing this change. It can start at very early ages or later in adolescence. Classically manifested with diarrhea with or without blood, abdominal pain, weight loss and failure to grow, and may also have extraintestinal symptoms which may be the only manifestation initially. The diagnosis is made based on the clinical history, physical examination, images and endoscopy with biopsy, the latter will allow confirming the diagnosis. Two treatment strategies; top down and step up have been described, in both the goal is the healing of the mucosa. The key to management is focused on the control of symptoms and inflammation, avoiding the complications of the disease and the side effects of the treatments.
La enfermedad inflamatoria intestinal (EII) es una enfermedad crónica que comprende la enfermedad de Crohn (EC), la colitis ulcerosa (CU) y la colitis indeterminada. La EC afecta desde la boca hasta el ano y la CU afecta solo el colon, por otro lado, la colitis indeterminada es aquella que no logra clasificarse en ninguna de las dos anteriores y en este caso, es la evolución de la enfermedad la que permitirá su diferenciación. Las implicancias que la Enfermedad inflamatoria intestinal pediátrica (EIIP) trae son particularmente importantes dado efectos negativos en el crecimiento, desarrollo y bienestar del niño. Esta revisión entrega una puesta al día en los conceptos más relevantes de esta patología, para así ayudar al control y tratamiento de nuestra población con EIIP.
2EpidemiologíaLas tasas de EII están aumentando a nivel mundial tanto en países desarrollados como en desarrollo. Canadá tiene las mayores tasas de incidencia de EII, siendo en adultos en Nueva Escocia 54.6 x 100000, la prevalencia en pediatría ha aumentado en un 50% en los últimos 15 años, haciendo notar un aumento del 8% en los menores de 5 años1. En Escocia se ha visto un aumento en el diagnóstico de EIIP del 76% desde la década del 90 y el diagnóstico, además, se realizó a edades más tempranas2. Un estudio realizado en Singapur en los últimas dos décadas, demostró un aumento dramático de casi 10 veces en la incidencia media anual de EII pediátrica3. Estos cambios en la epidemiología se han asociado entre otros, a cambios ambientales como la occidentalización de la sociedad.
Las tasas reportadas en la literatura son variables para la EIIP. La incidencia por 100000 reportada va desde 2.4 en Texas hasta 12.8 en Suecia4,5. Un estudio realizado en Nueva Zelanda registró una prevalencia puntual al 2015, para EII pediátrica, de 21.7 por 100000 niños menores de 16 años, siendo 16.5 para CU y 3.3 para EC, este estudio demostró además diferencias en las tasas de prevalencia para el norte y sur del país6. Actualmente no existen datos epidemiológicos de la realidad de la EIIP en Chile. La mortalidad en la EIIP es rara, pero las tasas acumuladas no son insignificantes, la mortalidad se relaciona principalmente con infecciones, en particular en pacientes con dos o más agentes inmunosupresores7.
La EII se presenta en adultos y niños de todas las edades, cerca de un 25% de EC y 20% de CU se presentan antes de los 20 años. El peak de inicio de la enfermedad es en la adolescencia tardía, un 4% de la EII pediátrica se diagnostica antes de los 5 años8, pudiendo presentarse incluso antes del año de vida. La presentación de la enfermedad en la niñez suele ser más extensa fenotípicamente, puede tener un curso más agresivo y con mayores complicaciones al compararlo con la presentación de la adultez.
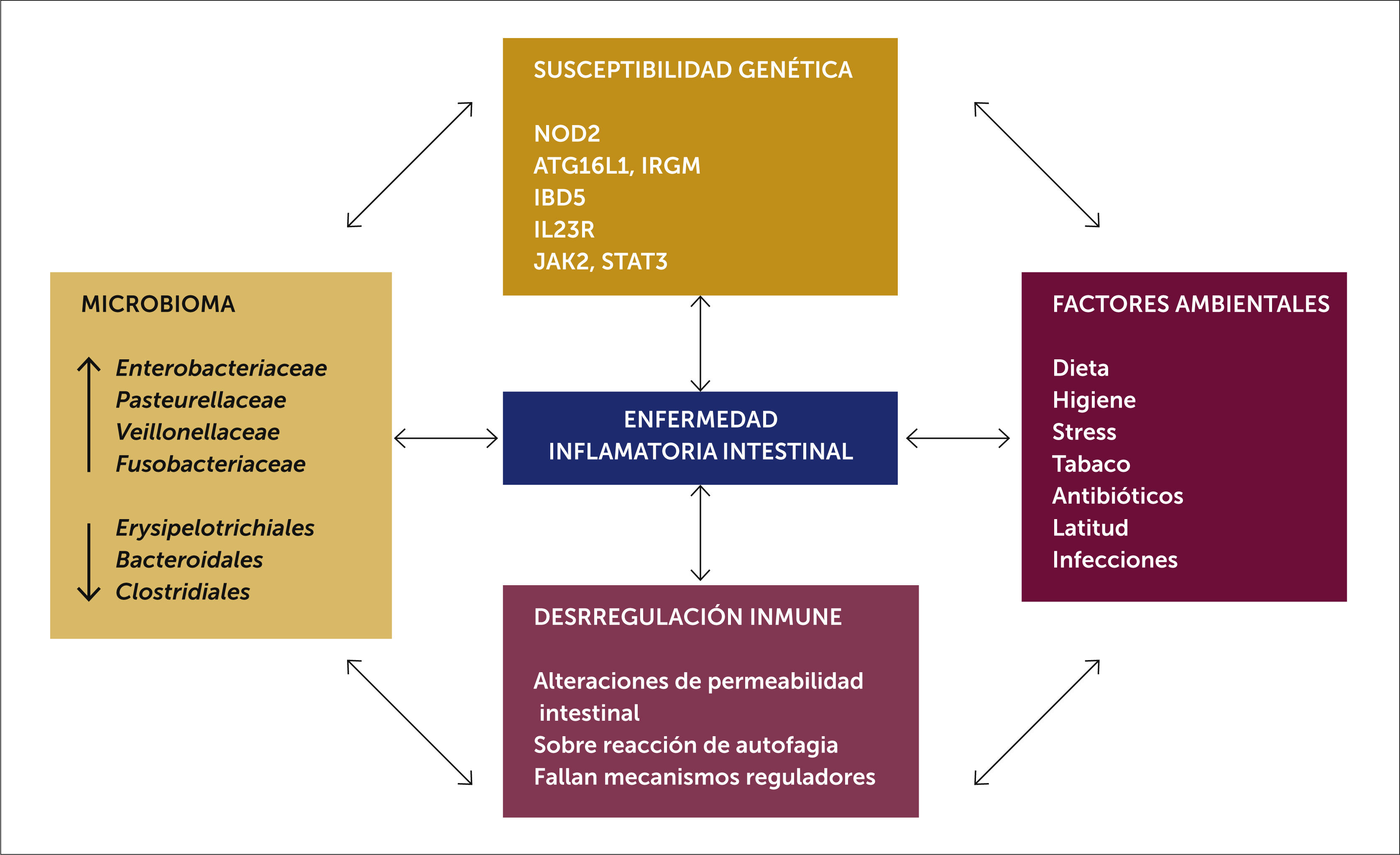
3PatogénesisEn la patogénesis de la EIIP están involucrados defectos genéticos e inmunes del paciente, que bajo la influencia de factores ambientales resulta en una respuesta inflamatoria crónica afectando a la microbiota comensal presente en la mucosa intestinal. Un estudio de genética aplicada ha descubierto más de 200 loci genéticos asociados a EII9. Dentro de los defectos genéticos identificados están los genes de respuesta inmune innata y adaptativa (NOD2, IBD5, ATG16L, IL23R entre otros) que codifican para proteínas de reconocimiento bacteriano intracelular, canales catiónicos, autofagia y señalética de la citoquina IL-23, estos asociado a defectos inmunes en la integridad de la barrera epitelial, la influencia del medio ambiente y la microbiota intestinal terminan produciendo inflamación crónica10 (ver fig. 1). Especial valor en la patogenia tiene la influencia del medio ambiente, algunas demostraciones claras de esto es la concordancia genética entre gemelos monocigóticos para la EII que es de un máximo de 50% y por otro lado el rápido aumento de la tasa de incidencia de EII no alcanza a ser explicada por cambios genómicos17; por último, pacientes que emigran de países en vías de desarrollo a áreas desarrolladas adoptan la epidemiología de la EIIP del país en que se establecen11.
Otros factores que se asocian al desarrollo de EIIP son el parto por cesárea, ausencia leche materna, uso de antibióticos en los primeros años de vida y la dieta rica en grasa, entre otros. Con respecto a la microbiota, existe evidencia en estudios animales con modelos de EII (ej. IL-10-/-) que ratones criados en áreas libres de gérmenes mantienen colon sano, pero desarrollan una colitis severa al exponerse al medio ambiente. Por otro lado, en pacientes con enfermedad perianal severa, la ileostomía que deriva la materia fecal, permite mejorar la inflamación perianal significativamente. Aún no se ha podido identificar un microorganismo causante de la enfermedad, pero si se han identificado algunas Escherichia coli adherente- invasiva patógena, presentes mayormente en biopsias de resección intestinal ileal de pacientes con EC en que la enfermedad recurre12. Estudios de secuenciación masiva han demostrado que tanto adultos como niños con EII presentan disbiosis, con una reducción general en la diversidad bacteriana; con disminución de los anaerobios obligados del phylum Firmicutes que son productores de butirato (Faecalibacterium prausnitzii) acompañado de un aumento de los facultativos anaerobios del phylum proteobacteria, en especial las Enterobacterias, siendo el mayor representante Escherichia coli13. El concepto de disbiosis también se ha visto en otras enfermedades inflamatorias como obesidad, diabetes mellitus, autismo y cáncer de colon14.
4DiagnósticoEl diagnóstico de EII se hace en base a la historia clínica del paciente, examen físico, laboratorio, imágenes y obligatoriamente se requiere el estudio endoscópico y colonoscópico con biopsias. No existe un criterio único ni patognomónico para diagnóstico de EC o CU, por lo que se requiere un conjunto de condiciones para su diagnóstico.
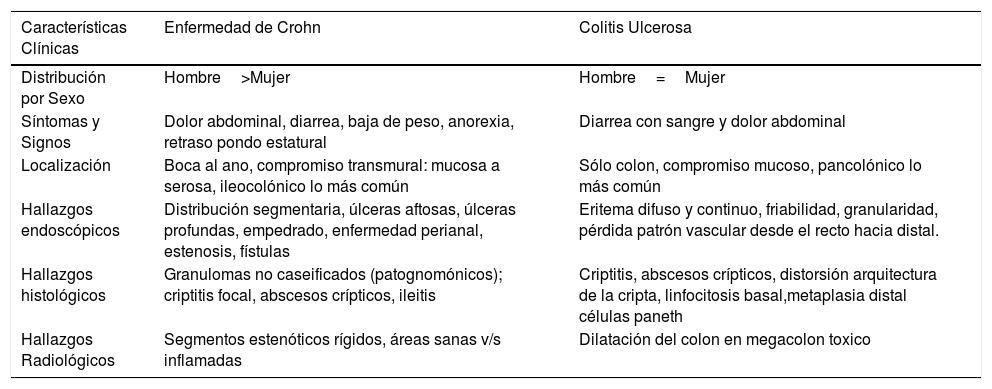
Presentación Clínica: La EII se puede presentar con una gran variedad de síntomas y signos tanto intestinales como extraintestinales. La CU se manifiesta clásicamente con dolor abdominal y diarrea con sangre, mientras que la EC puede presentarse con dolor abdominal y diarrea con o sin sangre y más característicamente con baja de peso o retraso del crecimiento. Otros síntomas gastrointestinales que pueden estar presentes son náuseas, vómitos, distensión abdominal, aftas orales y el compromiso perianal que es exclusivo de la EC15. En la tabla 1, se resumen aspectos clínicos y de estudio endoscópico y biopsia16.
Características Clínicas
| Características Clínicas | Enfermedad de Crohn | Colitis Ulcerosa |
|---|---|---|
| Distribución por Sexo | Hombre>Mujer | Hombre=Mujer |
| Síntomas y Signos | Dolor abdominal, diarrea, baja de peso, anorexia, retraso pondo estatural | Diarrea con sangre y dolor abdominal |
| Localización | Boca al ano, compromiso transmural: mucosa a serosa, ileocolónico lo más común | Sólo colon, compromiso mucoso, pancolónico lo más común |
| Hallazgos endoscópicos | Distribución segmentaria, úlceras aftosas, úlceras profundas, empedrado, enfermedad perianal, estenosis, fístulas | Eritema difuso y continuo, friabilidad, granularidad, pérdida patrón vascular desde el recto hacia distal. |
| Hallazgos histológicos | Granulomas no caseificados (patognomónicos); criptitis focal, abscesos crípticos, ileitis | Criptitis, abscesos crípticos, distorsión arquitectura de la cripta, linfocitosis basal,metaplasia distal células paneth |
| Hallazgos Radiológicos | Segmentos estenóticos rígidos, áreas sanas v/s inflamadas | Dilatación del colon en megacolon toxico |
Traducido de: BMJ 2017;357:j2083
En aproximadamente un 30% de los pacientes pediátricos, las manifestaciones extraintestinales pueden ser la manifestación inicial de la enfermedad, se presentan más frecuentemente en niños que en adultos y es más habitual su presencia en la EC que en la CU17. Puede haber fiebre, anemia, astenia y anorexia. Por sistemas lo más frecuente es el compromiso articular, pudiendo presentar artralgias, artritis periférica, espondilitis anquilosante, además, puede haber osteoporosis17. El compromiso ocular se puede manifestar con uveítis o epiescleritis; el compromiso cutáneo con eritema nodoso, pioderma gangrenoso, sindrome de Sweet y psoriasis18. Hasta un 50% de los paciente puede tener compromiso hepático durante el curso de la enfermedad, con esteatosis, colelitiasis, colestasia, hepatitis granulomatosa o asociarse a hepatitis autoinmune y colangitis esclerosante primaria19. Las manifestaciones pancreáticas son poco frecuente, pero se ha descrito pancreatitis aguda y crónica, pancreatitis autoinmune e insuficiencia pancreática20.
La CU, en general, afecta exclusivamente al colon siendo la presentación más frecuente pancolónica. A diferencia de los adultos, solo un porcentaje menor de pacientes se limita al recto; además, se han descrito formas atípicas de presentación con compromiso colónico en parche, compromiso del tracto gastrointestinal superior como erosiones y pequeñas úlceras gástricas, duodenitis, esofagitis y también formas graves con compromiso transmural y úlceras profundas21. La EC puede afectar desde la boca hasta el ano y la localización más frecuente es ileocolónica15.
Un grupo especial de pacientes son los menores de 6 años o Very Early Onset Inflammatory Bowel Disease (VEOIBD), en estos al igual que lo descrito en edades mayores, lo más frecuente es que sea una enfermedad de origen poligénico, pero se ha descrito un subgrupo de pacientes con formas monogénicas como el déficit de XIAP, defectos en la señalización de IL-10, entre otros22. En cuanto a la forma de presentación hay hallazgos inconsistentes, se han descrito fenotipos más severos, pero también se han descrito presentaciones más leves al momento del diagnóstico y que podrían evolucionar de forma más agresiva en el tiempo.
Laboratorio: Frente a la sospecha de EII se debe realizar al paciente un hemograma completo, proteína C reactiva (PCR) y/o velocidad de hemosedimentación (VHS), enzimas hepáticas y albúmina. En estos pacientes es habitual encontrar anemia, leucocitosis, trombocitosis, hipoalbuminemia, disminución de proteínas totales, elevación de transaminasas, elevación de VHS y PCR; pero un laboratorio normal no es suficiente para descartar el diagnóstico de EII23.
La calprotectina fecal es una proteína que se encuentra principalmente en neutrófilos, tiene una acción protectora en procesos inflamatorios, infecciosos y proliferativos. Su elevación es un marcador de inflamación colónica, pero no es específico de EII. Requiere una muestra de deposiciones, es simple de obtener y útil para diferenciar trastornos funcionales de trastornos orgánicos. Se utiliza para evaluar respuesta a tratamiento y en el seguimiento de la EII, pudiendo predecir el riesgo de recidivas. La calprotectina normal es un indicador de curación de la mucosa, valores de calprotectina <150μg/gr tiene un alto valor predictivo para curación mucosa24. Otro marcador fecal es la lactoferrina, es una proteína de neutrófilos, sensible y específica para inflamación intestinal25 que, al igual que la calprotectina, se ha utilizado en el diagnóstico y seguimiento de los pacientes con EII. La Calgranulina-C es también un marcador fecal de inflamación, el cual sería más específico que la calprotectina ya que es liberado por granulocitos activados. Estudios recientes han demostrado que tendría características similares a la calprotectina para predecir EII26. Pese a que se han descrito una gran cantidad de marcadores fecales de inflamación el único actualmente disponible y utilizado en la práctica clínica es la calprotectina.
Del punto de vista serológico, los anticuerpos más utilizados son los anticuerpos anti citoplasma de neutrófilos con patrón de fluorescencia perinuclear o pANCA y anticuerpo anti Saccharomyces cerevisiae o ASCA, entre otros. Estos tienen un bajo valor predictivo para el tamizaje de EIIP27. Su uso es complementario y no de rutina, pero en ocasiones tendrían un rol pronóstico, por ejemplo, niños con EC ASCA IgA/IgG (+) tienen alta prevalencia de enfermedad de íleon terminal e ileocecal y más riesgo de necesitar cirugía, pero, si un paciente con EC es pANCA (+), es más probable que tenga pancolitis o colitis izquierda respetando el íleon y con esto menor riesgo de cirugía28.
En niños con sospecha de EII es importante hacer el diagnóstico diferencial con infecciones gastrointestinales, preferentemente antes de realizar el estudio endoscópico. Es de utilidad realizar coprocultivo, PCR y/o toxina para Clostridium difficile y si está disponible, realizar PCR en deposiciones para diferentes agentes infecciosos. El hallazgo de un agente infeccioso no descarta que sea una EII ya que podría ser el gatillante de ésta.
Endoscopía: La colonoscopía completa hasta íleon terminal con toma de biopsias escalonadas, es esencial para diferenciar EC de CU e identificar la localización y extensión de la enfermedad. La inflamación aislada de íleon y colon normal puede verse en un 9% niños con EC, de ahí la importancia de intentar siempre la intubación ileal29. La endoscopía también debe ser considerada de primera línea en el estudio de la EIIP. Hay trabajos que señalan que la ausencia de síntomas altos no elimina la posibilidad de tener una inflamación alta, es más, datos del registro de PIBD indican que la endoscopía ayudó a definir el diagnóstico en 10% niños con EIIP30. La cápsula endoscópica también es una herramienta en el estudio de la enfermedad. Un estudio terciario demostró que la cápsula afectó el manejo y mejoró el outcome de pacientes con EIIP, sin embargo, tiene riesgo de causar obstrucción si hay estenosis y además, no permite la toma de muestras para biopsia, por lo que se considera como un estudio diagnóstico complementario31.
Biopsia: En la EC la histología se caracteriza por la presencia de granulomas no caseosos, lo cual es característico de la enfermedad, alteración focal de la arquitectura de las criptas (segmentaria o discontinua), inflamación crónica focal o en parches y preservación de la mucina en sitios activos. La ausencia de granulomas no descarta la EC, ya que solo están presentes en un 20-40% de los casos. En la CU la inflamación se limita a la mucosa. Se puede observar edema, congestión y aumento del número de células plasmáticas, hay distorsión de las vellosidades y criptas, daños sugerentes de cronicidad, presencia de agregados linfoides basales e infiltrado inflamatorio crónico y depleción de mucina en células caliciformes. Se puede observar criptitis, abscesos crípticos o destrucción de las criptas32.
Imágenes: Los distintos métodos imagenológicos entregan información valiosa para evaluar la ubicación, extensión y la gravedad de la enfermedad, así como para reconocer las complicaciones en el momento del diagnóstico y durante la evolución. Se debe evaluar, según disponibilidad y características de cada paciente, la mejor imagen a realizar.
-Ecografía abdominal: La ecografía realizada por un radiólogo infantil con experiencia en la patología es una herramienta diagnóstica muy útil en el estudio inicial y seguimiento del paciente. Se puede observar engrosamiento intestinal con hiperemia, pared intestinal irregular, estrechamiento luminal, mesenterio engrosado, peristalsis alterada, rigidez de asas, linfadenopatías, colecciones o abscesos y se puede evaluar la vascularización de la pared intestinal con el uso de doppler33. Dentro de sus ventajas está el bajo costo, ser ampliamente accesible, no requiere sedación, en general es bien tolerada por los niños y no irradia, pero es operador dependiente y no logra visualizar el tracto gastrointestinal completo especialmente rectosigmoides34. No requiere preparación del paciente, pero el ayuno y el uso de contraste oral, como una solución de polietilenglicol, mejoran el rendimiento del examen.
-Tomografía computada (TC): Las ventajas de esta técnica son un costo moderado y mejor acceso en comparación a la RM, permite evaluar el compromiso intestinal y extraintestinal, entrega imágenes en múltiples planos, es una técnica rápida que se puede realizar en pacientes gravemente enfermos. Una de sus principales complicaciones es la radiación y que puede requerir contraste oral y/o endovenoso34. El contraste enteral utilizado puede ser agua o una solución de polietilenglicol, sorbitol o manitol, el cual puede ser administrado vía oral (enterografía) o por sonda nasoyeyunal (enteroclisis) dependiendo de la tolerancia del paciente, el contraste permite distender la pared intestinal entregando una visualización óptima de esta. Estudios han demostrado que no habrían diferencias en cuanto a rendimiento para la enterografía al comparar con la enteroclisis35. La TC con contraste nos puede mostrar engrosamiento de la pared intestinal, realce de la mucosa, depósito de grasa en la submucosa, edema, inflamación del mesenterio, adenopatías, pseudopólipos, vasa recto prominentes, se pueden observar complicaciones como fístulas, abscesos, estenosis y además permite estadificar la enfermedad33.
-Resonancia magnética (RM): La RM se ha ido convirtiendo en el método imagenológico de elección al momento del diagnóstico en EIIP. Permite evaluar el compromiso de todo el intestino, especialmente de intestino delgado el cual queda, en general, fuera del alcance endoscópico. Identifica cambios en la pared intestinal y complicaciones de la enfermedad como fístulas, abscesos, flegmones y estenosis36. La RM es un buen indicador de actividad en la EC por lo que se está utilizando como un marcador de curación de la mucosa, tanto en niños como en adultos37. Dentro de sus ventajas está el que no produce radiación ionizante, entrega imágenes de alta resolución en diferentes planos y además es útil para evaluar el compromiso extraintestinal como el compromiso de grasa mesentérica, linfonodos, líquido libre, entre otros. Como desventajas de este método está el alto costo, no está ampliamente disponible, en niños pequeños requiere sedación y requiere la administración de contraste el cual puede ser difícil de tolerar en niños pequeños34. Al igual que en la TC el contraste puede ser administrado vía oral o por una sonda nasoentérica. El rendimiento de una enterografía por RM sería similar a la enterografía por TC, con la ventaja de no irradiar al paciente38.
-Tránsito intestinal o radiografía con Bario: Pese a la aparición de técnicas como TC y RM se sigue utilizando en diagnóstico y seguimiento. Es una técnica ampliamente disponible y de bajo costo, no requiere sedación, permite una buena evaluación de la mucosa intestinal e identificar complicaciones como estenosis y fístulas. Como desventaja está la radiación y que no permite evaluar complicaciones transmurales ni extraluminales34.
5TratamientoClásicamente, el objetivo de tratamiento en la EEIP fue reducir los síntomas, pero con el advenimiento de los biológicos que tienen la capacidad de curar la mucosa, promover crecimiento y de esta forma modificar la historia natural de la enfermedad, los nuevos objetivos en el tratamiento de la EIIP son:
- 1)
Eliminar síntomas y restaurar la calidad de vida.
- 2)
Restaurar el crecimiento normal.
- 3)
Eliminar las complicaciones.
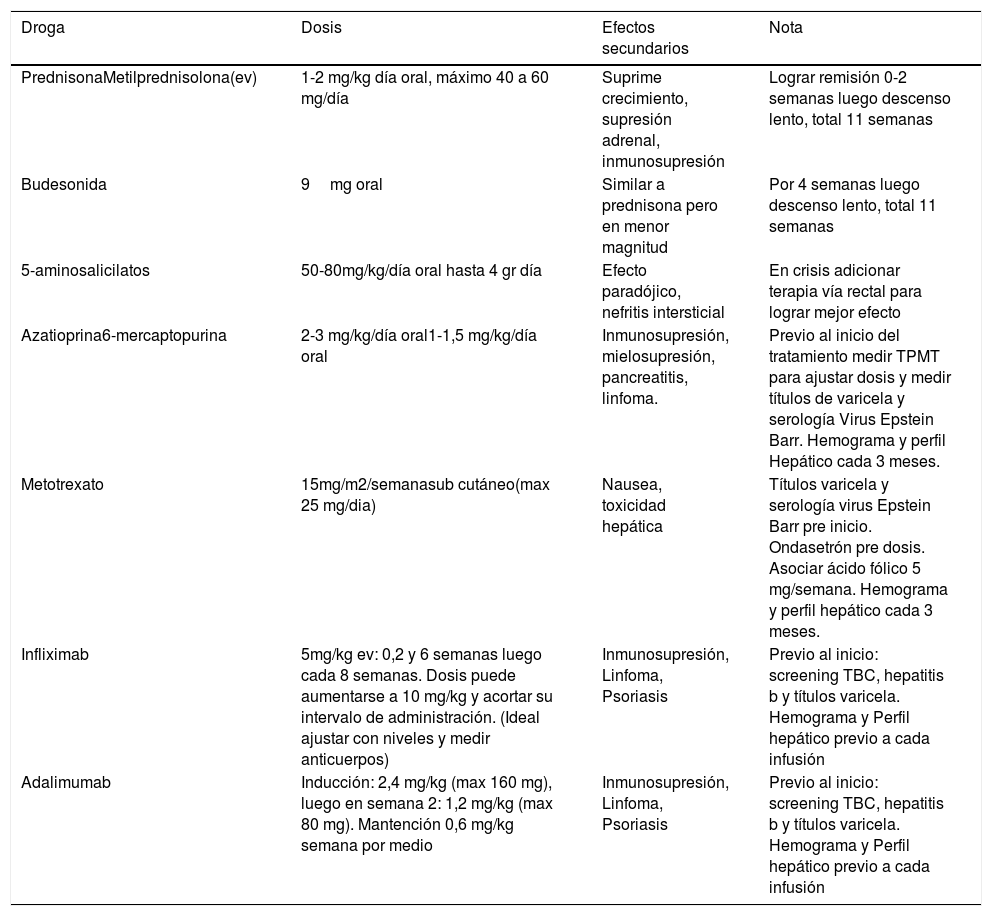
El tratamiento actual tiene dos formas de enfrentamiento, el “top down” o “step up”. El step up se inicia con aminosalicilatos, corticoides, antibióticos o nutrición enteral y escala a inmunomoduladores, biológicos o cirugía si el paciente empeora. El top down se inicia con biológicos dada la severidad del cuadro y luego se desciende a drogas menos agresivas. Una vez que tenemos el diagnóstico debemos decidir en forma individual con cada paciente que tratamiento le ofreceremos de inducción y luego de mantención. La iniciativa STRIDE (Selecting Therapeutic Targets In Inflammatory Bowel Disease) propuso el término Target to treat, que incluye 12 recomendaciones como curación mucosa, mejora de la calidad de vida, restaurar el desarrollo puberal y crecimiento, entre otros39. La tabla 2 resume el tratamiento de la EIIP, con las drogas usadas, sus dosis, efectos adversos y notas de manejo.
Tratamiento Farmacológico de la Enfermedad inflamatoria intestinal pediátrica
| Droga | Dosis | Efectos secundarios | Nota |
|---|---|---|---|
| PrednisonaMetilprednisolona(ev) | 1-2 mg/kg día oral, máximo 40 a 60 mg/día | Suprime crecimiento, supresión adrenal, inmunosupresión | Lograr remisión 0-2 semanas luego descenso lento, total 11 semanas |
| Budesonida | 9mg oral | Similar a prednisona pero en menor magnitud | Por 4 semanas luego descenso lento, total 11 semanas |
| 5-aminosalicilatos | 50-80mg/kg/día oral hasta 4 gr día | Efecto paradójico, nefritis intersticial | En crisis adicionar terapia vía rectal para lograr mejor efecto |
| Azatioprina6-mercaptopurina | 2-3 mg/kg/día oral1-1,5 mg/kg/día oral | Inmunosupresión, mielosupresión, pancreatitis, linfoma. | Previo al inicio del tratamiento medir TPMT para ajustar dosis y medir títulos de varicela y serología Virus Epstein Barr. Hemograma y perfil Hepático cada 3 meses. |
| Metotrexato | 15mg/m2/semanasub cutáneo(max 25 mg/dia) | Nausea, toxicidad hepática | Títulos varicela y serología virus Epstein Barr pre inicio. Ondasetrón pre dosis. Asociar ácido fólico 5 mg/semana. Hemograma y perfil hepático cada 3 meses. |
| Infliximab | 5mg/kg ev: 0,2 y 6 semanas luego cada 8 semanas. Dosis puede aumentarse a 10 mg/kg y acortar su intervalo de administración. (Ideal ajustar con niveles y medir anticuerpos) | Inmunosupresión, Linfoma, Psoriasis | Previo al inicio: screening TBC, hepatitis b y títulos varicela. Hemograma y Perfil hepático previo a cada infusión |
| Adalimumab | Inducción: 2,4 mg/kg (max 160 mg), luego en semana 2: 1,2 mg/kg (max 80 mg). Mantención 0,6 mg/kg semana por medio | Inmunosupresión, Linfoma, Psoriasis | Previo al inicio: screening TBC, hepatitis b y títulos varicela. Hemograma y Perfil hepático previo a cada infusión |
TPMT: Tiopurina Metiltransferasa.
Adaptada de Acta gastroenterol Latinoam 2018, 48(3): 226-241.
Nutrición enteral: La nutrición enteral exclusiva (NEE) se define como la que provee el 100% de calorías por fórmula líquida, y es tan efectiva como los corticoides en inducir la remisión clínica en niños con EC. La fórmula elemental no ha mostrado superioridad a las poliméricas por lo que ambas se pueden utilizar. La duración va de 8 a 12 semanas y entre sus ventajas está que carece de los efectos adversos del corticoide, promueve el crecimiento y produce curación de la mucosa. Una de las desventajas que presenta es que debe ser estrictamente líquida, por lo que puede ser difícil de tolerar y muchas veces requerirá una sonda nasogástrica para alimentación nocturna40. Siempre después de la NEE se debe complementar o escalar a alguna droga que permita la mantención como un inmunomodulador o biológico.
Corticoides: Sólo se deben usar para inducir remisión, sin embargo, un 50% de los pacientes se hará dependiente o requerirá cirugía. Su uso en remisión está limitado por los numerosos y conocidos efectos adversos de los esteroides. Si los pacientes necesitan un tiempo prolongado de esteroides o presentan dependencia, es de regla el paso a terapia de mantención con un inmunomodulador, biológico o cirugía41. La Budesonida está formulada para su liberación en íleon o colon, presenta una primera metabolización hepática lo que limita sus efectos sistémicos y es capaz de inducir remisión en EC y CU pero no es efectiva en la mantención42.
Aminosalicilatos (5-ASA): Estas drogas ejercen un efecto anti-inflamatorio tópico en la mucosa intestinal. Pueden ser usados en CU leve a moderada para inducir remisión así como para la mantención. En EC no tienen rol en la inducción ni para la remisión, pero si puede usarse como terapia adyuvante si hay compromiso colónico. El compuesto original fue la Sulfasalazina pero fue dejada atrás por efectos adversos de la sulfa. Los nuevos 5-ASA logran mantener una buena concentración en el intestino sin efectos adversos. Existen preparaciones tópicas de gran utilidad para el manejo de proctitis o colitis distales que pueden usarse en complemento a la terapia oral43.
Antibióticos: Antibióticos como el ciprofloxacino y el metronidazol pueden utilizarse para la inducción en la enfermedad perianal fistulizante, especialmente cuando no se pueden iniciar inmunomoduladores si hay infección concomitante o necesidad de cirugía. La rifaximina logra inducir remisión en EC con enfermedad colónica44.
Inmunomoduladores: Las tiopurinas son inhibidoras de las purinas; azatioprina y su metabolito mercaptopurina (6-MP) son drogas de lento inicio de acción (10-12 semanas) pero muy efectivas en mantener remisión en EC y CU en niños45. Dentro de sus efectos adversos se incluyen la mielosupresión, elevación de transaminasas y pancreatitis. Una manera de evitar los efectos adversos es medir la actividad de la enzima Tiopurina Metiltransferasa (TPMT) la que inactiva los metabolitos tóxicos de la Azatioprina. El paciente con baja actividad TPMT tiene riesgo de toxicidad elevada, entonces se debe iniciar tratamiento con dosis bajas del fármaco. Existe un leve aumento del riesgo de linfoma con el uso de inmunomoduladores vs población general (4.5 por 10000 pacientes año v/s 0.6 por 10000)46. El metotrexato es un inmunomodulador que puede ser usado en mantención en la EC luego de falla a tiopurinas, pero puede producir hepatotoxicidad, náuseas, mielosupresión y está contraindicado en el embarazo, además los pacientes deben recibir ácido fólico diario o semanal cuando están bajo tratamiento con este fármaco47.
Biológicos: La introducción de anticuerpos monoclonales contra Factor de necrosis tumoral (anti-TNF) revolucionó el tratamiento de la EII. Existen dos anticuerpos anti-TNF aprobados en niños: Infliximab y Adalimumab, estos pueden ser usados en infusión o subcutáneo respectivamente. El estudio REACH de niños con EC moderada a severa, mostró para Infliximab una respuesta de 88% y remisión de 56% a 1 año48. Similares tasas logró en CU, con 73% de respuesta y remisión de 39% a 1 año49. Adalimumab también demostró tasas similares en EC moderada a severa activa50.
La falla del tratamiento a anti-TNF puede resultar de una baja concentración de la droga dada por una dosis inadecuada o por la formación de anticuerpos, por lo que se recomienda una postura proactiva con medición de niveles y anticuerpos lo cual se encuentra disponible en nuestro país. Concentraciones de Infliximab entre 3 y 7μg/mL se asocian con una buena respuesta clínica. El uso de terapia combinada de Anti-TNF con azatioprina/6 MP o Metotrexato por al menos 6 meses a 1 año previene la formación de anticuerpos, dando mayor concentracion del fármaco y mejores beneficios a largo plazo51.
Los anti-TNF son superiores a las tiopurinas para producir curación de la mucosa además son las únicas drogas con la habilidad de curar las fístulas perianales en la EC52. También mejoran el crecimiento en pacientes con retraso crecimiento. Por esta razón son de primera línea en niños con EC con úlceras profundas, enfermedad perianal, falla crecimiento, osteoporosis y compromiso panenterico53. En CU aguda grave, los anti-TNF son de segunda línea cuando hay falla a corticoides al quinto día de tratamiento54.
Desde el año 1996 se han reportado casos de linfoma hepatoesplénico de células T con alta mortalidad, esto en hombres con EII tratados con anti-TNF y tiopurinas. Hasta la fecha se han descrito unos 40 casos, todos habían recibido combinación de anti-TNF y tiopurina, o solo tiopurina y ninguno recibiendo unicamente anti-TNF, de esta manera se debe evaluar la elección de terapia combinada en hombres jóvenes considerando riesgos y beneficios55.
Los efectos adversos a los biológicos son reacciones a la infusión o de la inyección. Elevan el riesgo de infección por hongos, micobacterias y virus. Todos los pacientes deben ser estudiados para infección latente de micobacteria antes de iniciar anti-TNF. Así mismo se deben chequear títulos de varicela, virus hepatitis B y esperar al menos 4 semanas de la administracion vacunas vivas para su inicio.
Cirugía: La cirugía es una alternativa terapéutica para CU y EC en niños. En CU refractaria a tratamiento médico, la colectomía total con pouch ileal con anastomosis al ano realizada en un centro especializado y por cirujanos entrenados en la técnica, resulta ser curativa para la CU. Niños con este procedimiento tienen buen resultado a largo plazo y tienen una buena calidad de vida que no difiere de la población general56. En EC la inflamación transmural con complicaciones como fístulas, abscesos y estenosis puede requerir cirugía. Hay que destacar que la recurrencia de la EC es alta post cirugía (ejemplo resección ileocólica) hay estudios que muestran que la azatioprina no previene las complicaciones, siendo actualmente los biológicos una alternativa para evitar la recurrencia post procedimiento57.
6SeguimientoEn el seguimiento de la EIIP, se cuenta con escalas que incorporan variables clínicas y de laboratorio, en algunos casos nos dan una referencia del estado de actividad de la enfermedad. Actualmente en pediatría se cuenta con el Pediatric Crohn Disease Activity Index (PCDAI) en EC58 y el Pediatric Ulcerative Colitis Activity Index (PUCAI) en la CU59 (ver tablas 3 y 4), estas son una herramienta útil en el seguimiento de nuestros pacientes con las que podemos evaluar la respuesta a la terapia que indicamos (target to treat).
Índice de actividad PUCAI
| Dolor abdominal | |
| Sin dolor | 0 |
| Puede ser ignorado | 5 |
| No puede ser ignorado | 10 |
| Rectorragia | |
| Ausente | 0 |
| Pequeño sangrado (<50% deposición) | 10 |
| Pequeño sangrado en la mayoría de las deposiciones | 20 |
| Sangrado abundante (>50% deposición) | 30 |
| Consistencia | |
| Formadas | 0 |
| Parcialmente formadas | 5 |
| Completamente deshechas | 10 |
| Número de deposiciones al día | |
| 0-2 | 0 |
| 3-5 | 5 |
| 6-8 | 10 |
| > de 8 | 15 |
| Deposiciones nocturnas | |
| Ausentes | 0 |
| Presentes | 10 |
| Grado de actividad | |
| Sin limitación | 0 |
| Restricción ocasional | 5 |
| Restricción importante | 10 |
PUCAI<10: remisión. PUCAI 10-34: brote leve.
PUCAI 35-64: brote moderado. PUCAI≥65: brote grave.
PCDAI abreviado (historia de 7 días+examen)
| Dolor abdominal | |
| Sin dolor | 0 |
| Leve, puede ser ignorado | 5 |
| Moderado a severo, no puede ser ignorado | 10 |
| Grado de actividad | |
| Sin limitación | 0 |
| Ocasional | 5 |
| Limitación frecuente | 10 |
| Número de deposiciones al día | |
| 0-1 líquida sin sangre | 0 |
| <2 semiformada con poca sangre ó 2-5 líquidas | 5 |
| Abundante sangre, 2-6 líquidas o diarrea nocturna | 10 |
| Abdomen | |
| Sin dolor, sin masa | 0 |
| Dolor o masa sin dolor | 5 |
| Dolor involuntario o masa palpable | 10 |
| Enfermedad perirrectal | |
| Tags asintomáticos | 0 |
| 1-2 fístulas, indoloras, escaso drenaje | 5 |
| Fístula activa, drenaje, dolor de absceso | 10 |
| Peso | |
| Ganancia de peso, mantener peso voluntario o | 0 |
| pérdida voluntaria | |
| Mantener peso involuntario, baja peso 1-9% | 5 |
| Pérdida peso>10% | 10 |
| Manifestaciones Extraintestinales | |
| Fiebre ≥38.5°C por 3 días, artritis, uveítis, eritema nodoso, pioderma gangrenoso: | |
| Nada | 0 |
| 1 | 5 |
| ≥2 | 10 |
PCDAI<10: remisión. PCDAI 10-27.5: brote leve.
PCDAI 30-37.5: brote moderado. PCDAI>40: brote grave.
Además de la evolución clínica debemos poner atención a deficiencias nutricionales y de micronutrientes. La pérdida de sangre, la malabsorción intestinal, mala ingesta e inflamación presentes frecuentemente en esta patología, puede llevar a deficiencias de hierro, folatos, vitamina B12 y vitamina D. Respecto esta última y su sabido rol en la inmunidad se recomienda mantener niveles de 25 OH vitamina D >30 ng/mL60.
Otro punto importante a considerar es el crecimiento, un 40% de niños con EC y un 10% con CU tendrán falla de crecimiento por factores ya nombrados, y los corticoides son un factor clave a considerar. Debemos evaluar en cada visita peso y talla junto a la velocidad de crecimiento61. En pacientes con EIIP y falla crecimiento, pubertad retrasada, uso prolongado de corticoides o inflamación severa se recomienda realizar una densitometría ósea y suplementar entre 1000 a 1600mg calcio con 800 a 1000 UI de vitamina D al día62.
Dado la inflamación crónica pacientes con EC y CU tienen un riesgo aumentado de cáncer de colon. Estudios poblacionales de pacientes con CU la incidencia de cáncer de colon es 13 por 1000 pacientes y se recomienda que en pediatria luego de 7 a 10 años del diagnóstico, iniciar screening cada 1 a 2 años63.
Por último, la EII puede afectar muchas áreas del funcionamiento psicosocial del niño o adolescente. Tienen mayor riesgo de depresión, ansiedad, problemas sociales, mala calidad de vida y dificultades relacionadas con el funcionamiento escolar. Además pueden tener una disfunción familiar importante, pudiendo afectar a padres y hermanos del paciente quienes frecuentemente reportan angustia la cual suele acentuarse durante los períodos de brote de la enfermedad64. Es importante evaluar de qué manera el paciente y su familia enfrentan la enfermedad y debemos estar atentos a la presentación de los problemas descritos para intervenir de forma oportuna y derivar en caso de necesidad.
7ConclusiónLa EIIP se puede presentar a cualquier edad pediátrica con un compromiso más extenso que en adultos y de curso en ocasiones más agresivo. El diagnóstico oportuno y la elección de tratamiento individualizado por especialistas es crucial, así como la monitorización del desarrollo y crecimiento del niño durante toda la edad pediátrica, y de la minimización de efectos adversos de la terapia.
8Declaración conflicto de interesesAmbos autores declaran no tener ningún conflicto de intereses.