Los tumores hipofisiarios son un conjunto de lesiones que ocupan la silla turca, siendo el adenoma hipofisiario por lejos la lesión más frecuente. Los adenomas hipofisiarios se manifiestan clínicamente por compresión de las estructuras vecinas y por hiper o hipofunción hormonal. Dependiendo de estas características, su manejo puede ser variable desde la observación, pasando por el manejo médico y la cirugía. En la siguiente monografía se analizará los principales aspectos clínicos, del diagnóstico y tratamiento de estas lesiones.
Pituitary tumors include a set of different lesions located at sella turcica, the pituitary adenoma is by far the most frequent type of lesion. Pituitary adenomas present clinically by compression of neighborhood structures, and hyper or hypo secretion of pituitary hormones. Depending on these characteristics, they can be observed, managed medically or by surgery. In this monograph, we will discuss the clinical aspects, diagnostic and treatment strategies of pituitary adenomas.
El término Tumor de Hipófisis, agrupa a una serie de patologías misceláneas de la silla turca, cuyo representante más frecuente e importante es el Adenoma Hipofisiario. Para efectos de esta monografía nos concentraremos en este último ya que representa el 90% de las lesiones selares 1 y discutiremos en el apartado de diagnósticos diferenciales el resto de las lesiones.
Los Adenomas Hipofisiarios (AH) corresponden a lesiones tumorales primarias del parénquima de la glándula hipofisiaria.
EPIDEMIOLOGÍAAnalizados desde el punto de vista epidemiológico, en las últimas décadas se ha observado un aumento de la prevalencia de estas lesiones, dado principalmente por el aumento de los estudios con imágenes – especialmente la Resonancia Nuclear Magnética (RM)- y el consecuente diagnóstico de lesiones en estadío subclínico 2–4.
La prevalencia estimada en un meta-análisis reciente fue de 16.7%, que fluctuó entre 14.4 y 22.5%, dependiendo si el análisis fue realizado en series post-mortem o de imágenes 4.
PATOGENIAEn su patogénesis, los adenomas hipofisiarios corresponden a neoplasias benignas originadas por proliferación monoclonal, que se originan en una célula del parénquima de la adeno-hipófisis. Del punto de vista de la tumorogénesis, el oncogen gsp es el más relevante. Existe una lista de oncogenes y genes supresores de tumores que se han demostrado influir en el proceso de génesis tumoral (AIP, MEN1, p53, PRKAR1A, etc.) 5.
En forma ocasional, 4-5% de los casos, los adenomas hipofisiarios pueden presentarse en un contexto de enfermedad familiar. Los síndromes clínicos más reconocidos son la Neoplasia endocrina múltiples tipo I (NEM-1), Complejo de Carney y los Adenomas Pituitarios Familiares Aislados (FIPA) 5.
Existen diferentes formas de clasificar los adenomas hipofisiarios. La primera tiene su origen en la característica sui generis de estos tumores de secretar hormonas. Por lo tanto la primera forma de dividirlos es en funcionantes y no funcionantes. El término de adenoma funcionante se refiere a la producción en exceso de hormonas hipofisiarias que producen los Síndromes de Hipersecreción. Los clínicamente más frecuentes son el Síndrome de amenorrea-galactorrea, la acromegalia y la Enfermedad de Cushing. Otros síndromes menos frecuentes son el hipertiroidismo secundario y el hipergonadismo secundario (excepcional). El otro grupo de tumores se catalogan como no funcionante o no secretores. En estricto rigor, eso no es tan cierto, ya que la mayoría de estos tumores secretan hormonas, pero que del punto de vista molecular, son biológicamente inactivas por lo que no se expresan clínicamente 1.
Otra forma de clasificar estos tumores es por su tamaño. El término microadenomas se refiere a los tumores cuyo tamaño es menor a 10mm, y los macroadenomas aquellos cuyo tamaño es mayor a 10mm 1.
Muy recientemente, la Sociedad Americana de Neurocirugía (Congress of Neurological Surgeons), publicó en la revista Neurosurgery las guías de manejo de los adenomas no funcionantes, basadas en una revisión de la literatura según los criterios de medicina basada en la evidencia. Algunas de las recomendaciones son de nivel II y la mayoría de nivel III 6, correspondiendo a un Grado de Recomendación C. Se procederá a comentar los diferentes aspectos del manejo de esta patología basado en la práctica del autor 7 y se incluirán las recomendaciones entregadas por estas guías 4.
PRESENTACIÓN CLÍNICALa presentación clínica de los adenomas hipofisiarios es muy variable y va a depender del tamaño de la lesión, su configuración y si es o no secretor de hormonas hipofisiarias.
En el caso de los adenomas no funcionantes, muchas veces estas lesiones son asintomáticas y se pesquisan en el contexto de un estudio por imágenes de cefalea o de trauma craneal 8,9. A medida que el tumor crece, los síntomas están relacionados con el efecto de masa del tumor sobre las estructuras vecinas. La cefalea es un síntoma frecuente de presentación, sin embargo, no siempre existe correlato entre el tamaño del tumor y la magnitud de la cefalea. Posteriormente, al crecer, el tumor comprime la glándula hipofisiaria, tallo hipofisiario, el quiasma óptico y las estructuras del seno cavernoso. Al comprimir la glándula hipofisiaria, produce hipofunción de las hormonas que esta secreta. La alteración es progresiva, y hay un relativo orden de vulnerabilidad de los diferentes ejes. De esta forma, en orden creciente, los ejes que se afectan son el somatotropo, gonadal, tiroideo y finalmente adrenal 1. El eje mamotropo es el único que se estimula con el crecimiento del tumor, ya que al comprimirse el tallo hipofisiario, se suprime la inhibición hipotalámica de los prolactotropos, con un aumento secundario de la prolactina (efecto tallo). En este caso, cuando la compresión del tallo es por un macroadenoma no funcionante, la hiperprolactinemia no supera los 200ng/dl. Por lo tanto, los síntomas de compresión y relacionado con la disminución de las hormonas son: amenorrea en las mujeres, baja de la líbido, cansancio, fatigabilidad, intolerancia al frío. En el caso de la hiperprolactinemia, el efecto es amenorrea y galactorrea en las mujeres y en lo hombres produce hipogonadismo debido a la inhibición de la liberación de la GnRH en el hipotálamo.
En el caso de la neurohipófisis, esta es bastante resiliente a la compresión, de manera tal, que la aparición de diabetes insípida es excepcional como manifestación de un macroadenoma de hipófisis y debiera sospecharse otra etiología (hipofisitis, craneofaringioma, entre otros) 1.
En el caso de hipersecreción, nos referiremos a los prolactinomas, acromegalia y Enfermedad de Cushing.
En el caso de los prolactinomas, los síntomas son idénticos al los de la hiperprolactinemia producida por la compresión del tallo hipofisiario.
En el caso de la Enfermedad de Cushing - es decir el Síndrome de Cushing de origen hipofisiario-, los síntomas y signos se adjuntan en la tabla 1. La expresión clínica de esta enfermedad es extremadamente variable, con casos muy sutiles y de inicio insidioso, lo que asociado a casos cíclicos, hace que el diagnóstico sea extremadamente difícil en muchas oportunidades, requiriendo un alto índice de sospecha por parte del clínico.
SÍNTOMAS Y SIGNOS SÍNDROME DE CUSHING
| SÍNTOMAS/SIGNOS | PREVALENCIA |
|---|---|
| Obesidad central Cara de Luna Pletora facial Disminución de la líbido | 90-100% |
| Estrías Púrpuras Alteraciones menstruales Hirsutismo Disfunción eréctil Hipertensión | 70-90% |
| Debilidad muscular Lomo de Búfalo Diabetes Osteoporosis Depresión Fragilidad capilar | 50-70% |
| Cefalea Lumbago Edema extremidades Infecciones recurrentes Alcalosis Hipokalémica Nefrolitiasis | 20-50% |
| Acné Alopecia | 0-20% |
Adaptado de Cushing Syndrome, Endocrinol Metab Clin N Am 37 (2008) 135–149.
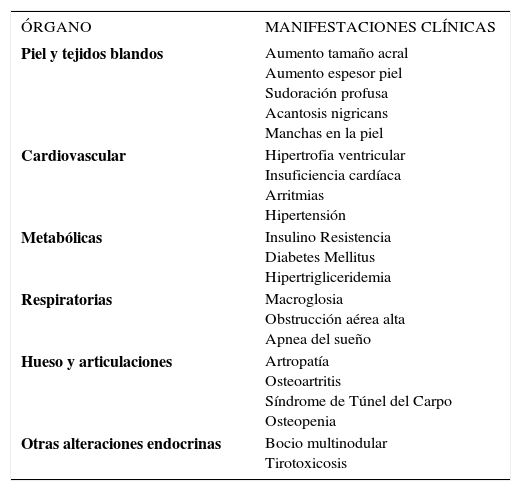
Los síntomas y signos de la acromegalia son igualmente característicos debido al efecto de la hormona del crecimiento y de la IGF1 en los diferentes órganos y se presentan en la tabla 2.
SÍNTOMAS Y SIGNOS DE LA ACROMEGALIA
| ÓRGANO | MANIFESTACIONES CLÍNICAS |
|---|---|
| Piel y tejidos blandos | Aumento tamaño acral Aumento espesor piel Sudoración profusa Acantosis nigricans Manchas en la piel |
| Cardiovascular | Hipertrofia ventricular Insuficiencia cardíaca Arritmias Hipertensión |
| Metabólicas | Insulino Resistencia Diabetes Mellitus Hipertrigliceridemia |
| Respiratorias | Macroglosia Obstrucción aérea alta Apnea del sueño |
| Hueso y articulaciones | Artropatía Osteoartritis Síndrome de Túnel del Carpo Osteopenia |
| Otras alteraciones endocrinas | Bocio multinodular Tirotoxicosis |
Adaptado de Systemic complications of acromegaly: Epidemiology, Pathogenesis and Management. Endocrine Reviews 25(1):102–152, 2004 DOI: http://dx.doi.org/10.1210/er.2002-0022
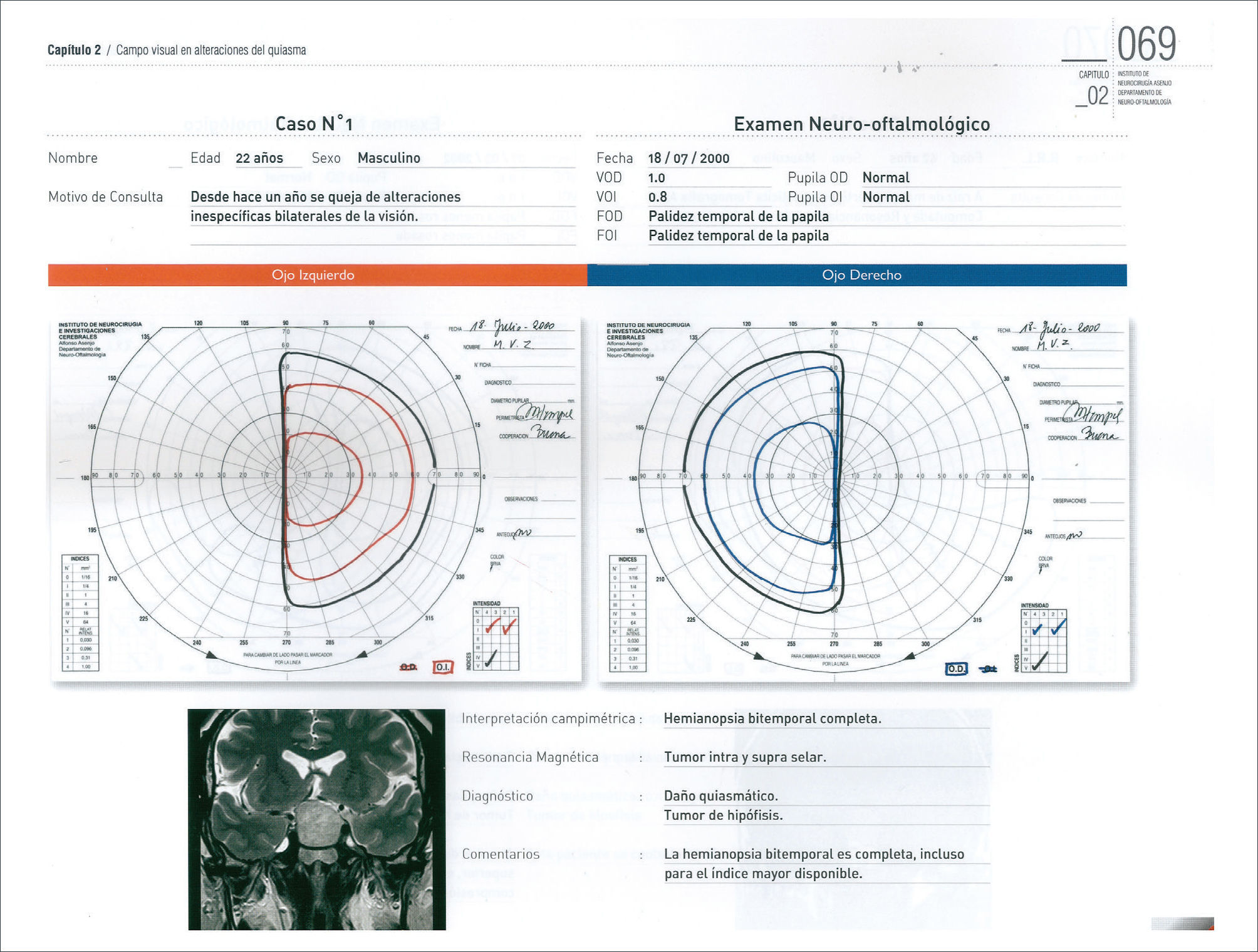
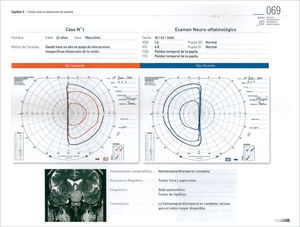
Los otros síntomas producidos por los adenomas hipofisiarios, son la compresión del quiasma óptico y defecto visual secundario. En forma clásica, la compresión desde abajo del quiasma, produce inicialmente una disminución de campo visual, comprometiendo inicialmente los cuandrantes superiores (cuadrantopsia bitemporal), a medida que progresa, compromete los dos hemicampos temporales (hemianiopsia bitemporal) (Figura 1), finalmente los campos nasales inferiores, hasta comprometer la visión central y eventualmente llegar a la amaurosis 10,11.
Es muy raro que el crecimiento de un adenoma hipofisiario produzca un compromiso de los nervios oculomotores, independiente del tamaño del tumor, tanto así que el debut de esos síntomas hacen dudar del diagnóstico de adenoma hipofisiario. Una de las excepciones a esto es un cuadro clínico particular: la apoplejía hipofisiaria.
La apoplejía hipofisiaria (AH) es el infarto del adenoma hipofisiario, que produce un cuadro de inicio brusco, de intensidad muy variable. Su etiopatogenia está dada por una insuficiencia de la irrigación del tumor en relación a las demandas metabólicas del tumor 12,13. Este es un hallazgo imagenológico frecuente, que puede encontrarse en mayor o menor magnitud hasta en un 20% de las RM de pacientes asintomáticos 13. El cuadro clínico es caracterizado por cefalea intensa, asociado a nauseas, vómitos, puede acompañarse de defecto visual agudo y compromiso oculomotor, rigidez de nuca y en los casos severos, compromiso de conciencia, compromiso hemodinámico y la muerte 13,14.
DIAGNÓSTICO DIFERENCIALESLos diagnósticos diferenciales más importantes son dentro de las lesiones de la silla turca 15:
Craneofaringioma
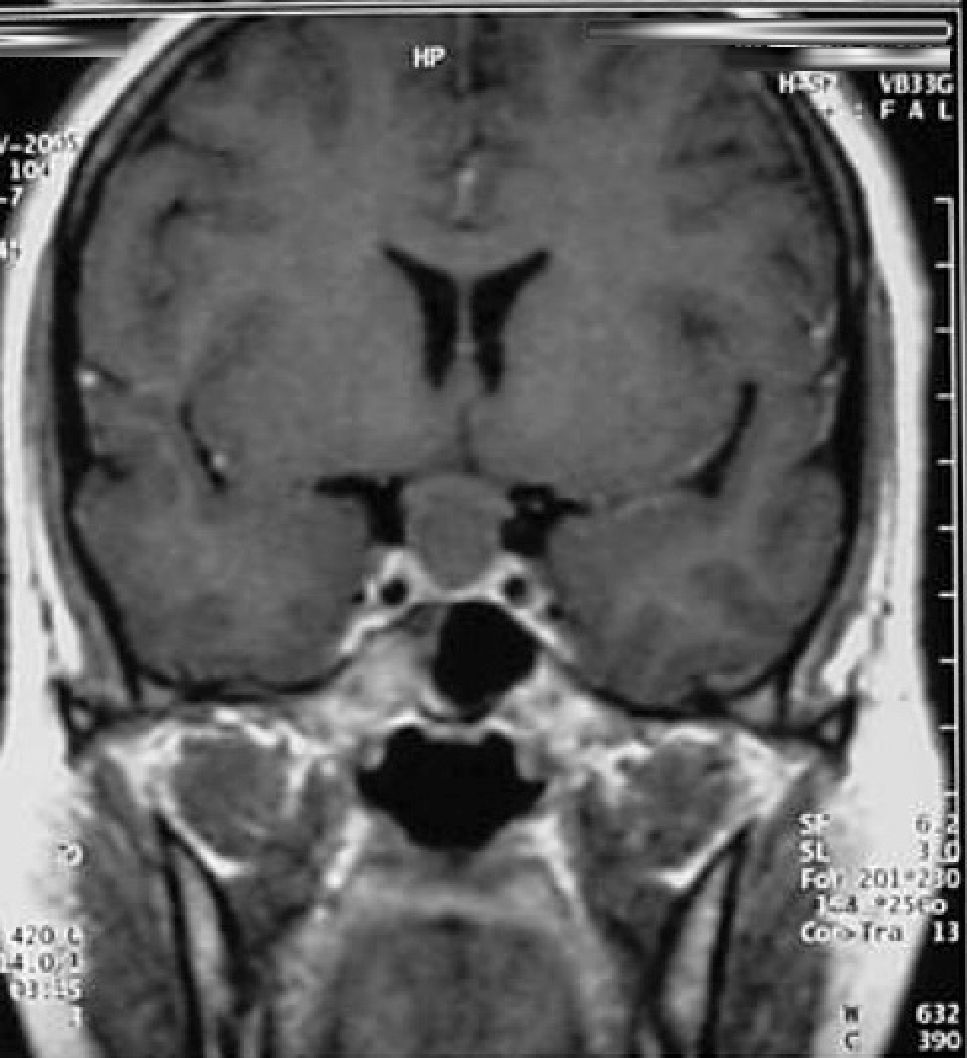
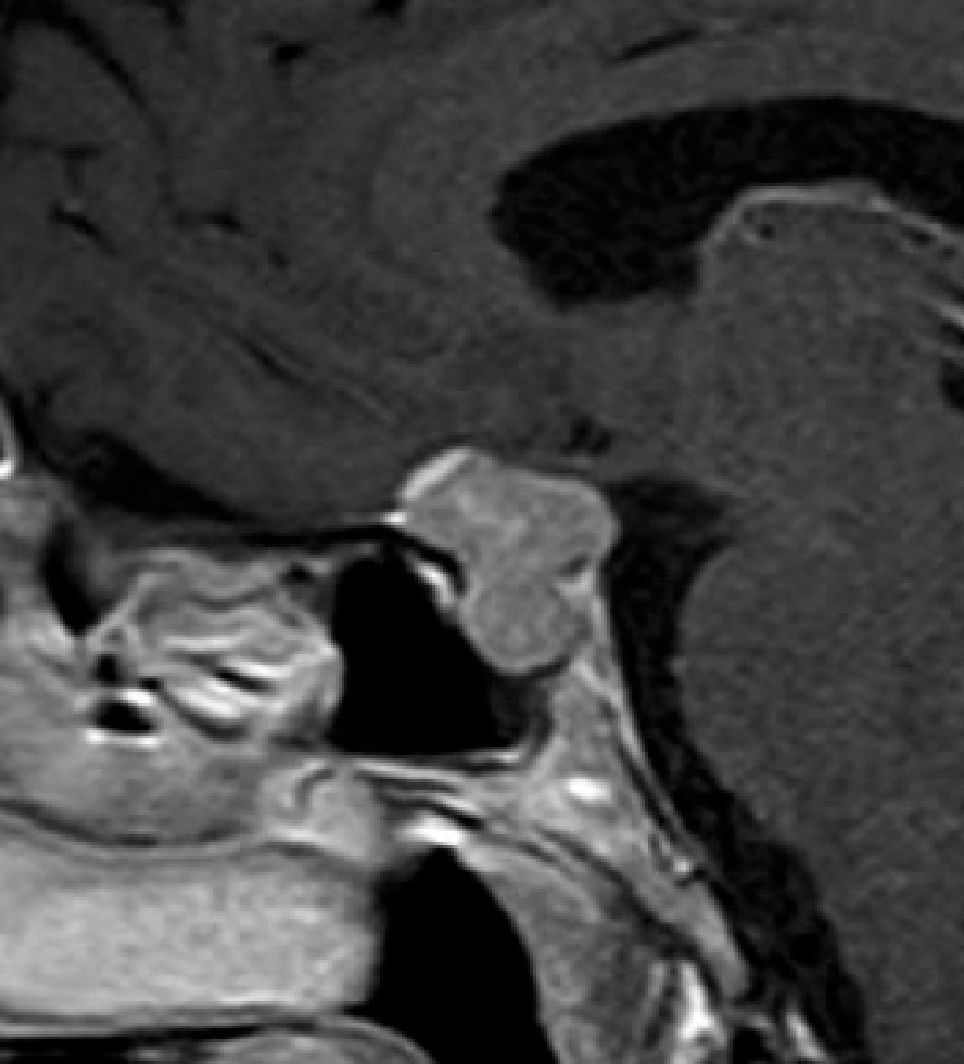
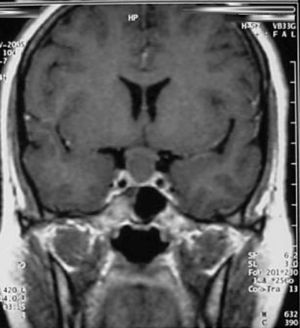
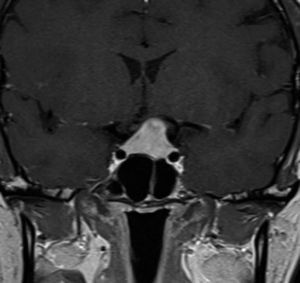
Quiste de la Bolsa de Rathke (Figura 2)
Hiperplasia fisiológica de la glándula
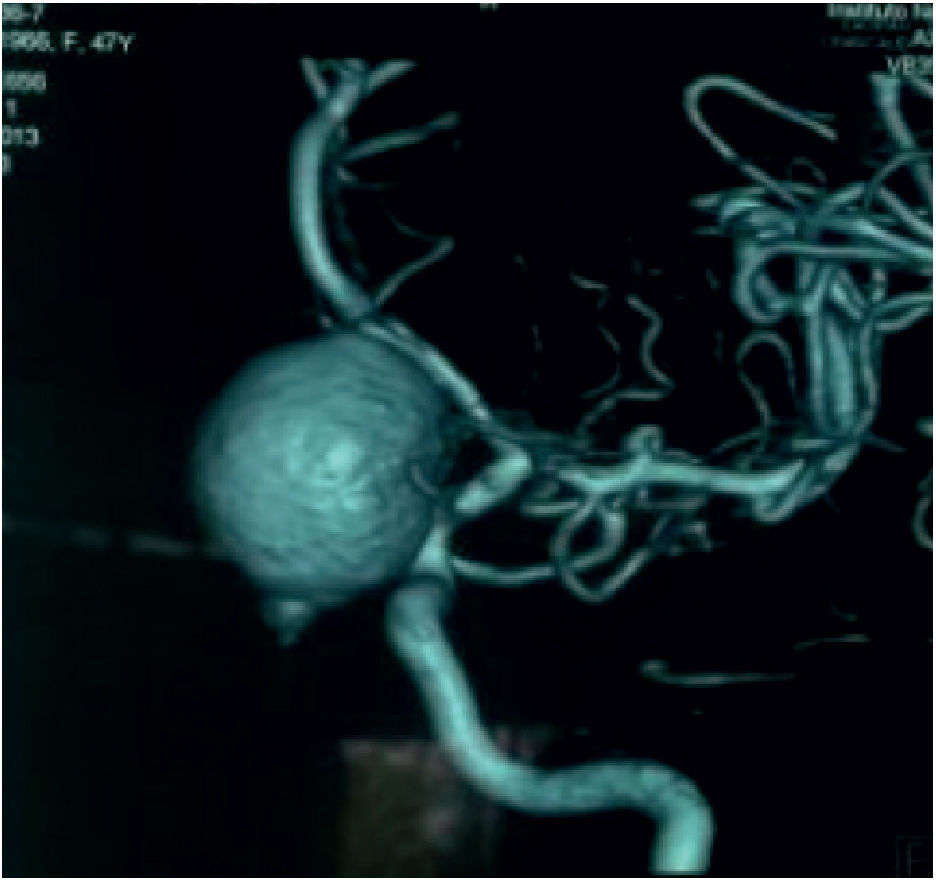
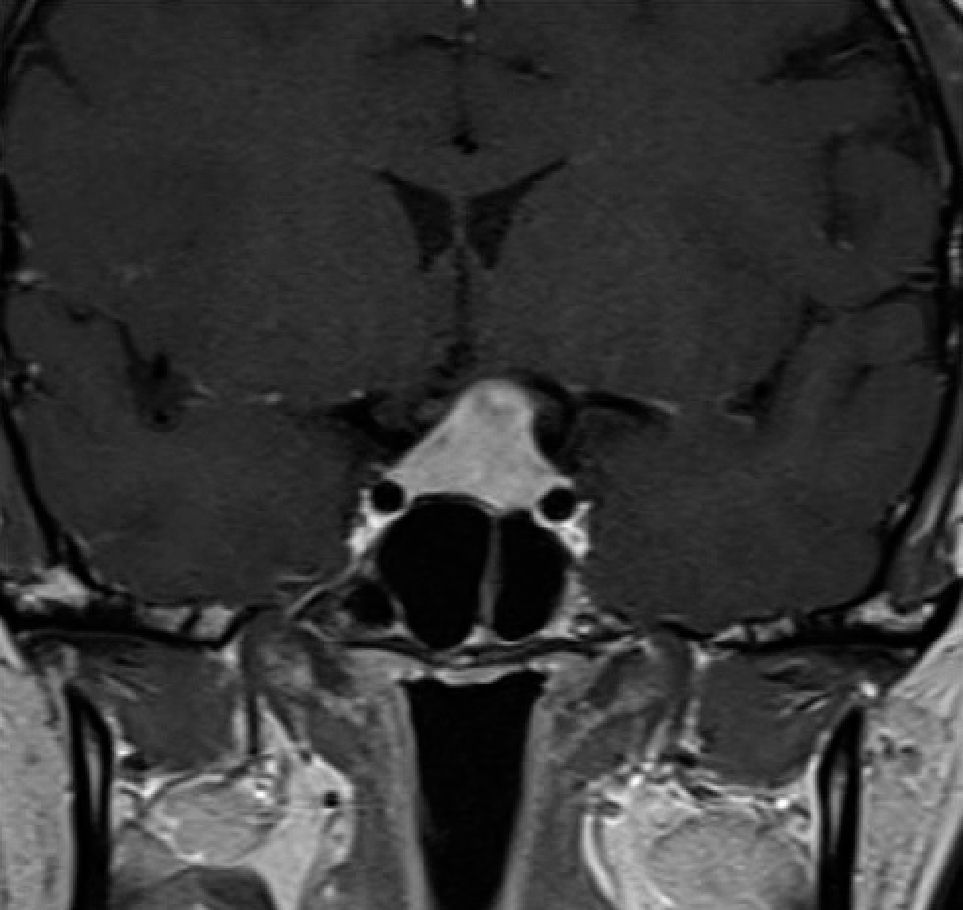
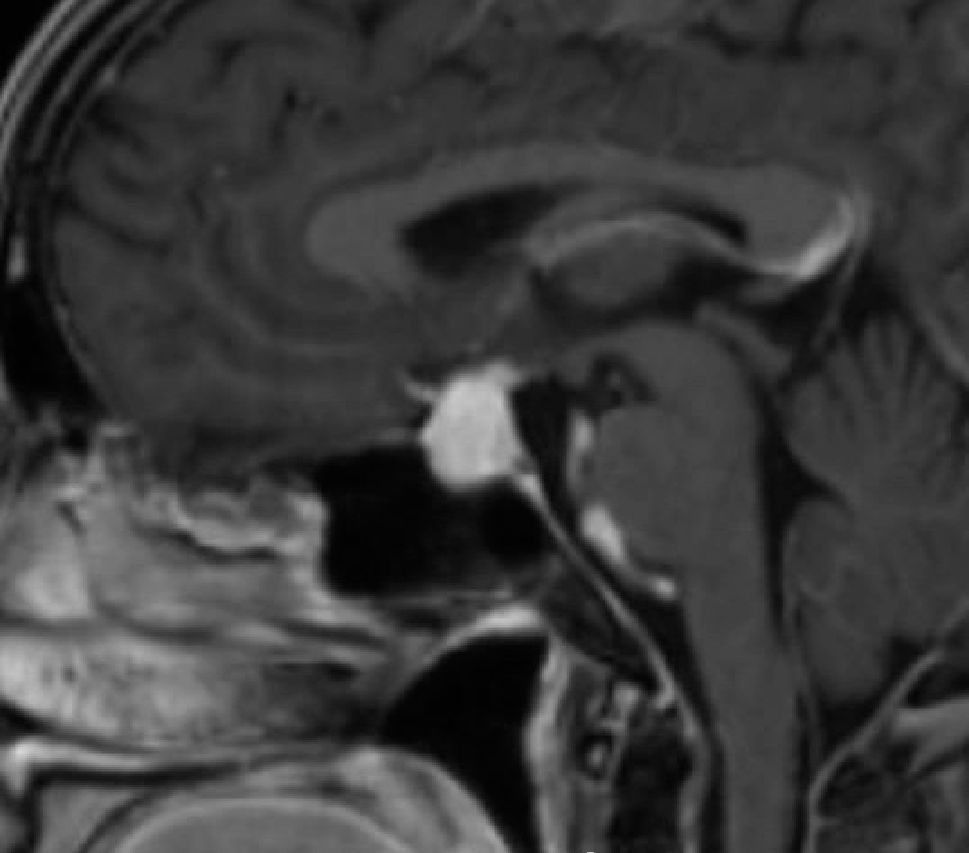
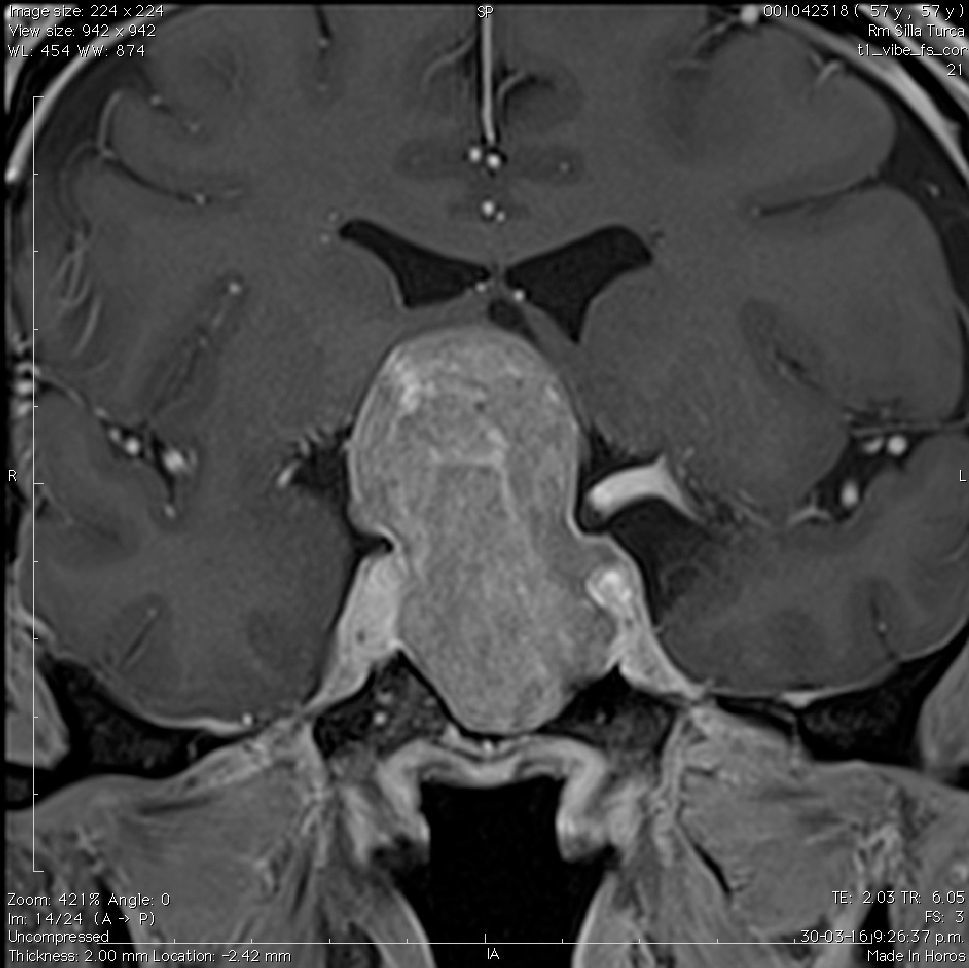
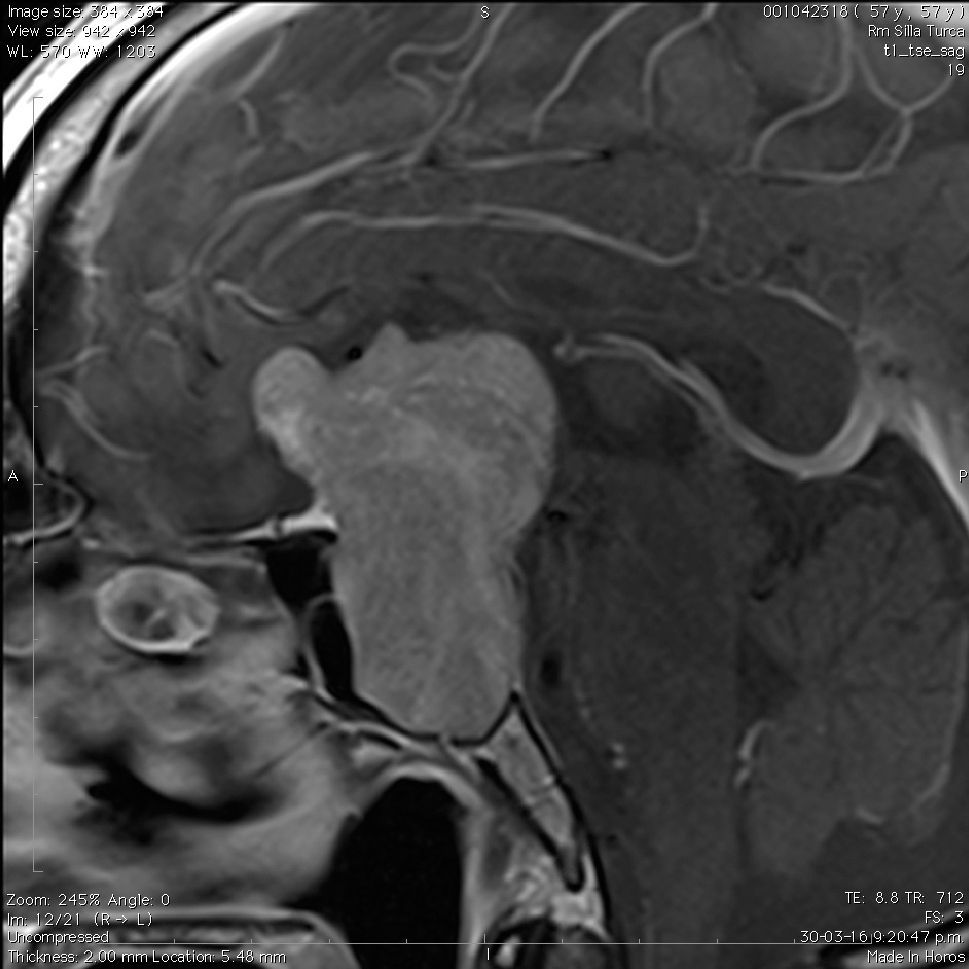
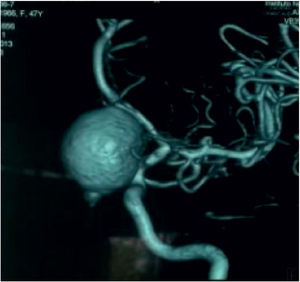
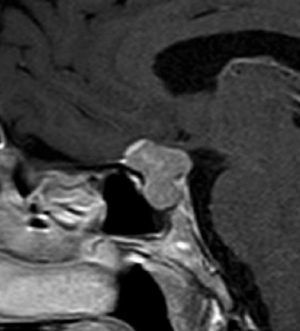
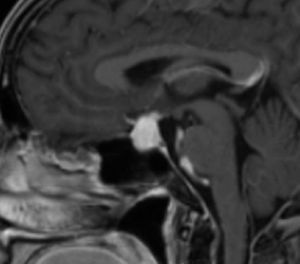
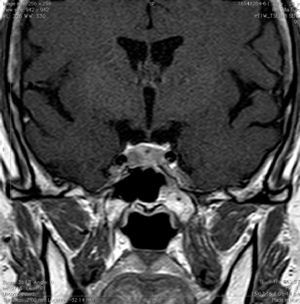
Aneurismas de la región selar (Figura 3a y 3b)
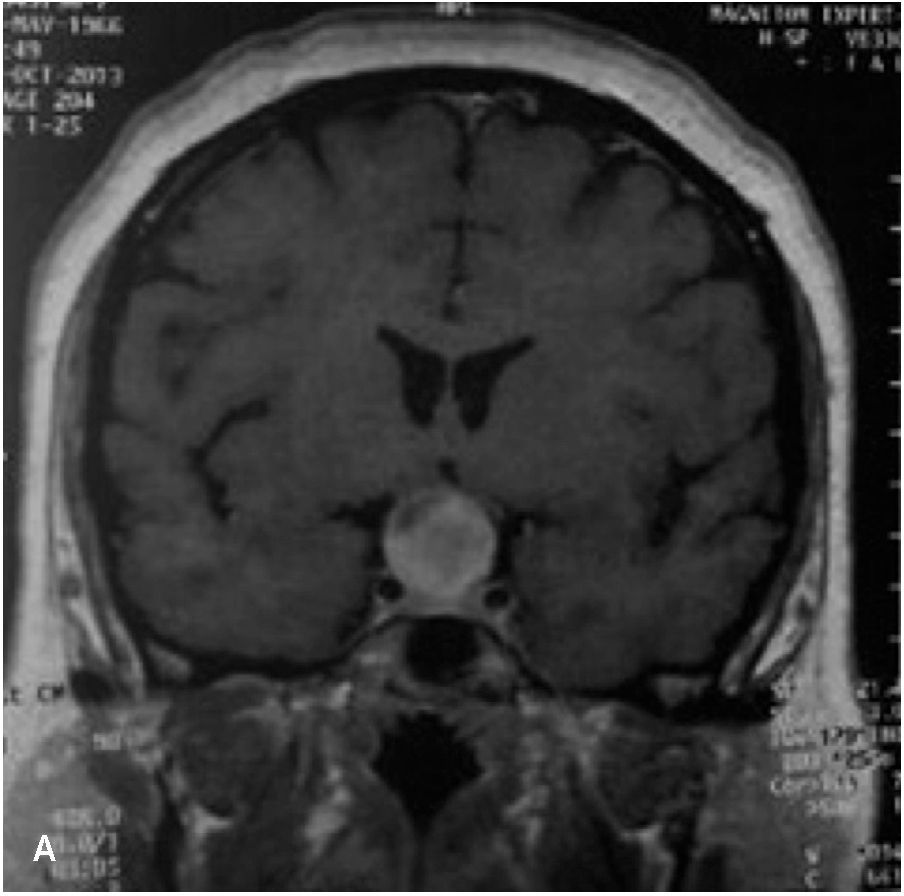
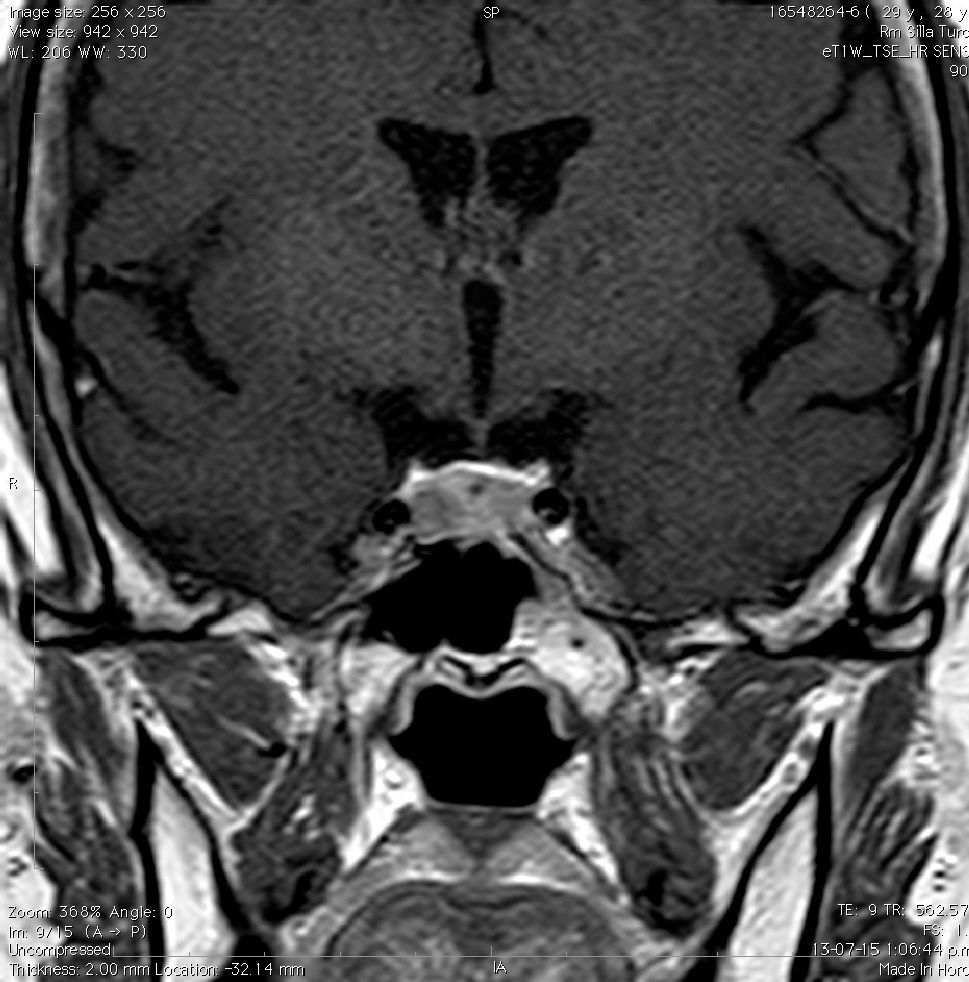
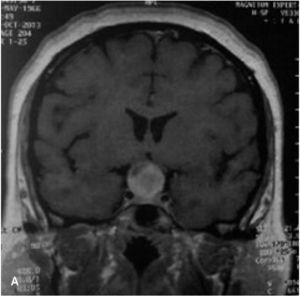
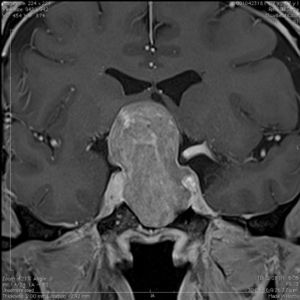
Meningioma (Figura 4)
En la Tabla 3 se compara el comportamiento de las diferentes lesiones en la RM.
CARACTERÍSTICAS EN LA RM DE LAS DIFERENTES LESIONES SELARES
| T1 | T1Gadolinio | T2 | Otras características | |
|---|---|---|---|---|
| Macroadenoma | Isointenso respecto a substancia gris Lesiones grandes pueden ser heterogéneas y quísticas | Componente sólido se refuerza con Gadolinio | Isointenso respecto a substancia gris. Puede tener cambios quísticos y necrosis | Puede demostrar hemorragia |
| Microadenoma | Isointenso respecto a substancia gris | Lesión hipointensa en la mayoría de los casos. Aumenta la sensibilidad con técnicas dinámicas o SPGR en caso de Enfermedad de Cushing | Isointenso substancia gris Puede ser quístico | Puede demostrar hemorragia |
| Craneofaringioma | Iso o hiperintenso en relación al parénquima | Se refuerza con gadolinio | Variable | Calcificaciones se observan como artefacto de susceptibilidad magnética |
| Meningioma | Iso o hipointenso en relación a substancia gris | Se refuerza intensamente con gadolinio, signo de la “cola dural” | Iso o hiperintenso en relación a substancia gris | |
| Quiste Bolsa de Rathke | 50% hiperintensos, 50% hipointenso | No se refuerza con gadolinio. | 70% hiperintensos, 30% iso o hipointensos | Puede tener un nivel hemático en su interior si ha sangrado |
| Hipofisitis | Isointensa, levemente heterogénea | Refuerzo variable con Gadolinio. Puede tener refuerzo dural e infundíbulo engrosado | Hipointensidad en la región paraselar | |
| Aneurisma | Vacío de flujo o señal heterogénea | Hipointenso con o sin halo hiperintenso |
Adaptado de www.radiopaedia.org/articles.
Cuando un paciente se presenta con un adenoma hipofisiario con defecto visual, es de primera relevancia determinar el compromiso funcional de la visión. El escenario ideal corresponde a la evaluación del paciente por un oftalmólogo. El estudio complementario incluye un estudio de agudeza visual, fondo de ojo y estudio campimétrico 11,16. En este último, existen 2 alternativas, la campimetría computarizada y el campo visual de Goldmann. Este último tendría ventajas en la detección de defectos campimétricos iniciales, ya que la técnica computarizada analiza solamente los 30 grados internos 11. Otro elemento que puede ser útil es el estudio por tomografía de coherencia óptica (OCT) que permite evaluar el espesor de las fibras retinianas, y tener una aproximación a la severidad del daño (atrofia) y la eventual recuperación visual del paciente. El concepto importante es que ningún examen reemplaza la evaluación integral del paciente por un neuro-oftalmólogo con todos las herramientas complementarias 16. Otro aspecto importante de la evaluación, aparte de establecer la magnitud del daño sobre la vía visual, es definir factores pronósticos. Es así como pacientes mayores y con duración del defecto visual mayor a 4 meses deber ser advertidos que tienen menor probabilidad de recuperación visual (Nivel 3) 16.
ESTUDIO DE IMÁGENESUna vez con la sospecha clínica y que se objetiva el déficit visual, estos elementos son extremadamente localizadores de una lesión quiasmática. En ese sentido, el examen ideal para el estudio de la región selar es la RM de silla turca con y sin gadolinio 15,17. El uso de la tomografía computada de silla turca con y sin contraste es de inferior calidad y da menos detalles diagnósticos. Tiene valor para definir características de la anatomía ósea y septos intra-sinusales, lo que es de mucha utilidad en el caso de re-intervenciones quirúrgicas en el que la anatomía del seno esfenoidal y de la silla turca se encuentran alteradas. El uso del PET y SPECT no aporta información relevante 17.
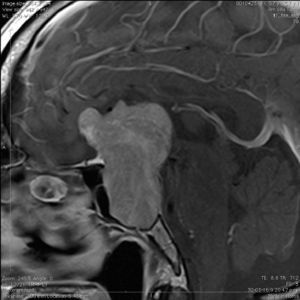
La información que el clínico obtiene de la RM es de mucha relevancia. Permite ver las características del tumor, su relación con la glándula normal y tallo hipofisiario, invasión del seno cavernoso, esfenoidal o clivus, grado de extensión supraselar. La figura 6 corresponde a la RM de silla turca en secuencia T1 post gadolinio en que se observa un microadenoma de hipófisis lateralizado a derecha de una paciente portadora de una Enfermedad de Cushing. La figura 7a y b, corresponde a una RM de silla turca en secuencia T1 post gadolinio de una paciente portadora de un macroadenoma de Hipófisis.
Todos estos aspectos son importantes tanto en la planificación pre-quirúrgica como en determinar factores importantes de la evolución (presencia de remanentes postoperatorios si existe invasión del seno cavernoso).
ESTUDIO ENDOCRINOLÓGICOEl estudio endocrino está enfocado a evaluar dos aspectos:
Estudiar el déficit de hormonas hipofisiarias y la sobreproducción de hormonas hipofisiarias.
El estudio rutinario de los diferentes ejes es de la mayor importancia para detectar el grado y severidad del compromiso hormonal 1,18.
En el primer caso, en general, uno solicita los exámenes teniendo en consideración la función de los efectores, por lo tanto solicita las hormonas reguladas por los secretagogos.
Un screening general para un paciente en que no se sospecha por la clínica hipersecreción sería 7:
- -
T4 libre
- -
TSH
- -
Cortisol
- -
Prolactina (diluir muestra 1/100 en tumores mayores a 3cm para descartar efecto hook)
- -
IGF1
- -
Testosterona en hombres
- -
LH
- -
FSH
- -
-Estrógenos
La medición de la prolactina es clave para descartar un Prolactinoma, especialmente en los casos subclínicos ya que tiene importantes implicancias terapéuticas como veremos más adelante. En el caso de los tumores mayores de 3cm, se debe solicitar dilución de la muestra para descartar valores bajos debido a la saturación del ligando por valores extremadamente altos de prolactina 1. Hay que tener en mente que un macroadenoma no secretor puede tener hiperprolactinemia moderada hasta 200ng/ml debido al efecto de compresión del tallo, sin ser secretores de prolactina y por lo tanto susceptibles a tratamiento médico 1,14,18.
En el caso de sospecha de Enfermedad de Cushing -basado en los síntomas y signos discutidos previamente-, hay que determinar el hipercortisolismo con dos de los siguientes exámenes: cortisol libre urinario, test de supresión de baja dosis con dexametazona o cortisol salival nocturno 19 y medición de ACTH para establecer la presencia de hipercortiolismo ACTH dependiente 20. En el caso en que los exámenes de laboratorio sean no concluyentes o no se identifique lesión en la RM, el diagnóstico confirmatorio se realiza mediante un examen invasivo de cateterismo de senos petrosos inferiores 34.
Para la acromegalia/gigantismo, la medición de IGF1da una medida integrada de la secreción pulsátil de GH. Es importante solicitar este examen en forma rutinaria para detectar acromegalia subclínica 18. En el caso de presentar valores de IGF1 altas, debe confirmarse el diagnóstico con un test de tolerancia a la glucosa, en el que no ocurre supresión de la GH ante la carga de glucosa 20,30. Nuestro grupo ha publicado un artículo detallando el diagnóstico y manejo de la acromegalia en particular 21.
TRATAMIENTOTratamiento médicoEn el caso de la presente monografía, no abordaremos el tratamiento médico de la Acromegalia y la Enfermedad de Cushing ya que escapan de los objetivos de esta revisión. El tratamiento médico tiene dos componentes. El primero, corresponde a la sustitución de las hormonas que se encuentran disminuidas en el estudio preoperatorio. Los ejes que requieren sustitución preoperatoria son el eje tiroideo y adrenal. Esto se realiza con Hidrocortisona 20mg/día y Levotiroxina 50 a 100ug/día según la severidad del déficit y la presencia de uno o más ejes comprometidos 18. Es importante que la sustitución se realice con suficiente tiempo para lograr la estabilización metabólica, especialmente en el caso del eje tiroideo. Otro aspecto importante es que antes de iniciar la sustitución tiroidea, debe asegurarse la indemnidad del eje adrenal, ya que la sola administración de levotiroxina puede desencadenar una insuficiencia suprarrenal.
La sustitución del eje gonadal, se reserva para el postoperatorio en general.
La otra variante del tratamiento médico es el caso específico de los Prolactinomas. En este caso, la efectividad del tratamiento es superior al 90%, especialmente en los microadenomas. Por otro lado, en el caso de macroadenomas además de ser altamente efectivo el tratamiento, la recuperación de la visión es rápida, incluso en casos severos 14,22. Por estos motivos, frente al diagnóstico de Prolactinoma, el tratamiento de primera línea es el médico y en el caso de progresión del déficit visual o resistencia a la terapia, se plantea el tratamiento quirúrgico.
Tratamiento quirúrgicoEl tratamiento quirúrgico sigue siendo el tratamiento de elección en el caso de los tumores no secretores con compromiso visual y en el caso de los tumores funcionantes en que el objetivo es la remisión bioquímica 23.
En la gran mayoría de los tumores, el tratamiento de elección es la resección vía trans-esfenoidal. Esta permite el acceso más expedito y menos invasivo a la silla turca, que normalmente es donde nace el tumor. El concepto data de principios del siglo XX, pero en su forma actual fue introducida por el Dr. Jules Hardy a principio de los años 60 con la ayuda del microscopio quirúrgico y radioscopía 24, y una variación de esta en que se cambia el microscopio por el uso del endoscopio a principio de los años 90 25,26, siguiendo ambas técnicas, el mismo concepto. En manos experimentadas, los resultados son muy similares, en términos de grado de resección, remisión quirúrgica en el caso de tumores secretores e incidencia de complicaciones y molestias nasales 27. La técnica endoscópica, tendría ventajas en los tumores grandes o con extensión lateral (Nivel 3) 28. La mayoría de los pacientes después de la cirugía tienen reducción del volumen tumoral y la tasa de tumor residual es entre un 10 y 36%. La función visual mejora entre un 75 y 91% de los pacientes y el hipopituitarismo entre un 35 y 50% de los pacientes. Las tasas de complicaciones asociadas a la resección transesfenoidal en las diversas series es cercana al 7.1% siendo las complicaciones más frecuentes la fístula de LCR (4.7%), meningitis (2%), y el deterioro de la función visual (2%) 23. En el caso de presencia de remanente significativo, se puede realizar una re-intervención por la misma vía para resecar el tumor residual 29.
Hay una serie de tecnologías que apoyan la cirugía trans-esfenoidal como la neuro-navegación o el uso de la RM intraoperatoria. Sin embargo, en ambos casos, no hay evidencia suficiente que recomiende su uso en forma sistemática 28.
Al analizar los resultados de remisión de pacientes con acromegalia secundaria a tumores hipofisiarios, se ha visto que el volumen de operaciones del cirujano es uno de los factores más importantes, produciéndose un quiebre cuando el número anual de cirugías supera las 50 30.
La cirugía transcraneal se utiliza primariamente cuando existe una configuración desfavorable de la silla turca, tales como, silla turca pequeña con gran masa supraselar, arterias carótidas muy próximas entre sí en el plano coronal o tumor en reloj de arena 7. También se utiliza en forma complementaria en el caso de pacientes con remanente luego de una resección trans-esfenoidal en que no se logra descenso del tumor, ya sea porque el tumor es de consistencia firme, tumores invasores o con importante extensión supraselar, Frontal o Temporal 28.
ESTUDIO HISTOPATOLÓGICOUno de los objetivos de la cirugía es obtener la confirmación diagnóstica del tumor, lo que siempre es importante. En el caso de los adenomas hipofisiarios, a diferencia de otros tumores, no hay marcadores categóricos de mal pronóstico o agresividad. Existe evidencia nivel 3 que recomienda prestar atención al grupo de tumores no funcionante secretores de ACTH (ACTH silentes) ya que este grupo tiende a comportarse de forma más agresiva, al igual que los pacientes con índice de proliferación de Ki67 alto (>3%). La recomendación de la guía con nivel 3 de recomendación, es considerar estos dos marcadores en la toma de decisión para el uso de terapias adyuvantes o control estrecho con imágenes 29.
TRATAMIENTOS ADYUVANTESEl uso de la radioterapia convencional o la radiocirugía como tratamiento primario tiene un sustento limitado basado en las publicaciones de la literatura 23. Sin embargo, son de extremada utilidad si luego de una o más cirugías queda remanente tumoral. Existe evidencia de Nivel 2 que apoya el uso de radioterapia o radiocirugía para manejo del remanente tumoral 29,31. En estos casos, se recomienda el uso de dosis ≥ 12Gy en el caso de la radiocirugía o dosis fraccionadas de 45-54Gy para lograr control local del tumor sobre un 90% a 5 años 29. Esto es especialmente útil en que pacientes en que el riesgo de una re-intervención se considere elevado debido a la edad o condiciones médicas asociadas (Nivel 3) 29.
En el caso de que no quede remanente tumoral después de la resección o el remanente sea pequeño, se recomienda seguimiento con imágenes (Nivel 2) 29.
SEGUIMIENTOExiste dos tipos, el seguimiento de la evolución intrahospitalaria y el seguimiento más tardío.
Dentro de la evolución postoperatoria inmediata lo más importante es evaluar al despertar el paciente, el estado de la visión. Lo esperable es que la visión se encuentre igual o mejor que en el preoperatorio. Cualquier deterioro debe ser estudiado inmediatamente con una neuro-imagen para descartar un hematoma del lecho operatorio, el que requerirá descompresión inmediata. Posteriormente, todos los pacientes son monitorizados y se realiza balance hídrico estricto y de ELP para el diagnóstico precoz de la diabetes insípida o secreción inapropiada de hormona antidiurética (SIADH). Se realiza medición de ELP en caso se que se sospeche estas dos entidades basados en la poliuria sostenida o balances persistentemente positivos y manejo con ELP seriados para evaluar la respuesta al tratamiento 7. En el caso de pacientes previamente hipopituitarios, se indica inmediatamente la suplementación en el postoperatorio, utilizado hidrocortisona endovenosa en dosis de stress desde la inducción para sustituir el eje adrenal. En el caso de los pacientes con el eje adrenal conservado, no administramos corticoides. La medición de niveles de cortisol al segundo día post-operatorio es sensible para determinar que pacientes los van a requerir posteriormente 32,33.
De no ocurrir complicaciones, los pacientes son dados de alta entre el tercer y cuarto día de operado. En general, en el caso de no ocurrir complicaciones, no realizamos RM de silla turca en el postoperatorio inmediato ya que es muy difícil interpretar que corresponde a tumor y que a hematoma, motivo por el cuál la utilidad de la RM intraoperatoria es muy cuestionada por los abundantes falsos positivos 28.
Para el seguimiento endocrinológico, realizamos un ELP a la semana de operado para descartar SIADH. Posteriormente se repiten los exámenes hormonales para evaluar los ejes entre las 4 y 6 semanas, a los 6 meses y al año. Si el paciente no tiene déficit, no se justifica continuar con las evaluaciones. Si el paciente presenta hipopituitarismo o ha sido irradiado, requiere seguimiento endocrinológico de por vida 32.
Para evaluar el estado de la visión, nuestro grupo solicitó entre los 2 y 3 meses el primer control neuro-oftalmológico, las recomendación de la guía no define plazos ni periodicidad del control oftalmológico.
En forma rutinaria, se solicita una neuro-imagen de control, una RM de silla turca con y sin gadolinio con técnica de saturación grasa para evaluar el remanente tumoral entre 3-4 meses después de la cirugía para disminuir los artefactos debido a la intervención 32. Sin embargo, no hay recomendaciones específicas que definan la periodicidad de los subsiguientes controles en el caso de remanentes, en el sentido de detectar crecimiento del tumor. El autor, solicita RM de control al año posterior al primer control en el caso de un remanente intraselar alejado del quiasma y a los 2 años en el caso de no haber remanente.
CONCLUSIONESEl manejo de los tumores de hipófisis, debido a las características de estas lesiones, requiere un manejo multidisciplinario. Si bien recientemente se publicaron las guías de manejo que contienen recomendaciones Nivel 2 y 3, con grado de recomendación C, hay muchos aspectos de su tratamiento que aún no están definidos, con estudios de suficiente calidad. En este sentido, un enfoque de un grupo de profesionales con experiencia en el manejo de la patología, con tratamientos adecuados a la medida de cada paciente, podrán ofrecer los mejores resultados.
El autor declara no tener conflictos de interés, en relación a este artículo.