52 - EFECTIVIDAD Y SEGURIDAD DE USTEKINUMAB EN LA COLITIS ULCEROSA: EVIDENCIA EN VIDA REAL DEL REGISTRO ENEIDA
1Servicio de Aparato Digestivo, Hospital Universitario de La Princesa, Instituto de Investigación Sanitaria Princesa (IIS-IP), Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD), Madrid. 2Servicio de Aparato Digestivo, Hospital Universitario y Politécnico La Fe y CIBERehd, Valencia. 3Servicio de Aparato Digestivo, Complejo Asistencial Universitario de León. 4Servicio de Aparato Digestivo, Hospital Clínico Universitario de Santiago, Santiago de Compostela. 5Servicio de Aparato Digestivo, Hospital Clínic i Provincial y CIBERehd, IDIBAPS, Barcelona. 6Servicio de Aparato Digestivo, Xerencia Xestion Integrada de Vigo, SERGAS. Grupo de Investigación en Enfermedades Digestivas, Instituto de Investigación Sanitaria Galicia Sur: IISGS Galicia Sur, Vigo. 7Servicio de Aparato Digestivo, Hospital Clínico de Valencia. Universitat de València, Valencia. 8Servicio de Aparato Digestivo, Hospital del Mar and Institut Hospital del Mar d’Investigacions Mèdiques, Barcelona. 9Servicio de Aparato Digestivo, Hospital General Universitario de Ciudad Real. 10Servicio de Aparato Digestivo, Complejo Hospitalario de Navarra, Pamplona. 11Servicio de Aparato Digestivo, Servicio de Aparato Digestivo, Hospital Universitario Río Hortega. Gerencia Regional de Salud de Castilla y León (SACYL). Valladolid. 12Servicio de Aparato Digestivo, Hospital Clínico Universitario Lozano Blesa, IIS Aragón y CIBERehd, Zaragoza. 13Servicio de Aparato Digestivo, Hospital General Universitario de Alicante y CIBERehd, IIS ISABIAL Alicante. 14Servicio de Aparato Digestivo, Hospital de Manises. 15Servicio de Aparato Digestivo, Hospital Virgen de la Luz, Cuenca. 16Servicio de Aparato Digestivo, Hospital Parc Taulí,. Departament de Medicina. Universitat Autònoma de Barcelona and CIBERehd, Sabadell. 17Servicio de Aparato Digestivo, Hospital Universitario Fuenlabrada e Instituto de Investigación Sanitaria del Hospital La Paz (IdiPAZ), Madrid. 18Servicio de Aparato Digestivo, Hospital Universitario Dr. Josep Trueta, Girona. 19Servicio de Aparato Digestivo, Hospital Universitario de Bellvitge, Barcelona. 20Servicio de Aparato Digestivo, Hospital Universitari Germans Trials i Pujol y CIBERehd, Badalona. 21Servicio de Aparato Digestivo, Hospital Infanta Sofía, San Sebastián de los Reyes. 22Servicio de Aparato Digestivo, Consorci Sanitari de Terrassa. 23Servicio de Aparato Digestivo, Hospital de Sant Joan Despí Moisès Broggi, Barcelona. 24Servicio de Aparato Digestivo, Hospital Universitario Fundación Alcorcón, Madrid. 25Servicio de Aparato Digestivo, Hospital Universitario de Canarias, Santa Cruz de Tenerife. 26Servicio de Aparato Digestivo, Hospital Universitario Marqués de Valdecilla e IDIVAL, Santander. 27Servicio de Aparato Digestivo, Hospital General de Tomelloso y CIBERehd, Ciudad Real. 28Servicio de Aparato Digestivo, Hospital General San Jorge, Huesca. 29Servicio de Aparato Digestivo, Complexo Hospitalario Universitario de Pontevedra. 30Servicio de Aparato Digestivo, Hospital Universitario Ramo y Cajal, Madrid. 31Servicio de Aparato Digestivo, Hospital de la Santa Creu i Sant Pau, Barcelona. 32Servicio de Aparato Digestivo, Hospital Santos Reyes, Burgos. 33Servicio de Aparato Digestivo, Hospital General Universitario de Valencia. 34Servicio de Aparato Digestivo, Hospital General de Granollers. 35Servicio de Aparato Digestivo, Hospital Universitario de Burgos. 36Servicio de Aparato Digestivo, Complejo Hospitalario Universitario de Ourense. 37Servicio de Aparato Digestivo, Hospital Universitari Germans Trials i Pujol y CIBERehd, Badalona.
Introducción: El programa de desarrollo de ustekinumab (UST) ha mostrado resultados prometedores en el tratamiento de la colitis ulcerosa (CU), que deben ser confirmados en la práctica clínica.
Objetivos: Primario: evaluar la supervivencia del tratamiento con UST en pacientes con CU en la práctica clínica. Secundario: evaluar la respuesta a corto plazo (en la semana 16) y la efectividad a largo plazo (en el seguimiento máximo) y conocer la seguridad de UST en la práctica clínica.
Métodos: Se incluyeron pacientes del registro ENEIDA (mantenido prospectivamente) que recibieron al menos una dosis intravenosa de UST por CU activa [Partial Mayo Score (PMS) > 2].La actividad clínica y la eficacia se categorizaron basadas en el PMS.
Resultados: Se incluyeron 95 pacientes (tabla). En la semana 16, el 53% de los pacientes tuvo respuesta clínica (incluido el 35% de los pacientes en remisión) (fig. 1). En el análisis multivariante, el presentar una PCR elevada en suero fue la única variable que se asoció significativamente con la probabilidad (menor) de alcanzar la remisión clínica. En la figura 2 se representa la probabilidad de mantener la remisión a largo plazo. El 36% de los pacientes interrumpieron el tratamiento con UST durante una mediana de seguimiento de 31 semanas. La probabilidad de mantener el tratamiento con UST fue del 87% en la semana 16, del 63% en la semana 56 y del 59% en la semana 72. El fracaso primario fue el motivo principal de la interrupción del tratamiento con UST. No se identificaron variables asociadas con una mayor probabilidad de interrupción del tratamiento. Tres pacientes presentaron eventos adversos; uno de ellos una infección mortal por SARS-CoV-2.
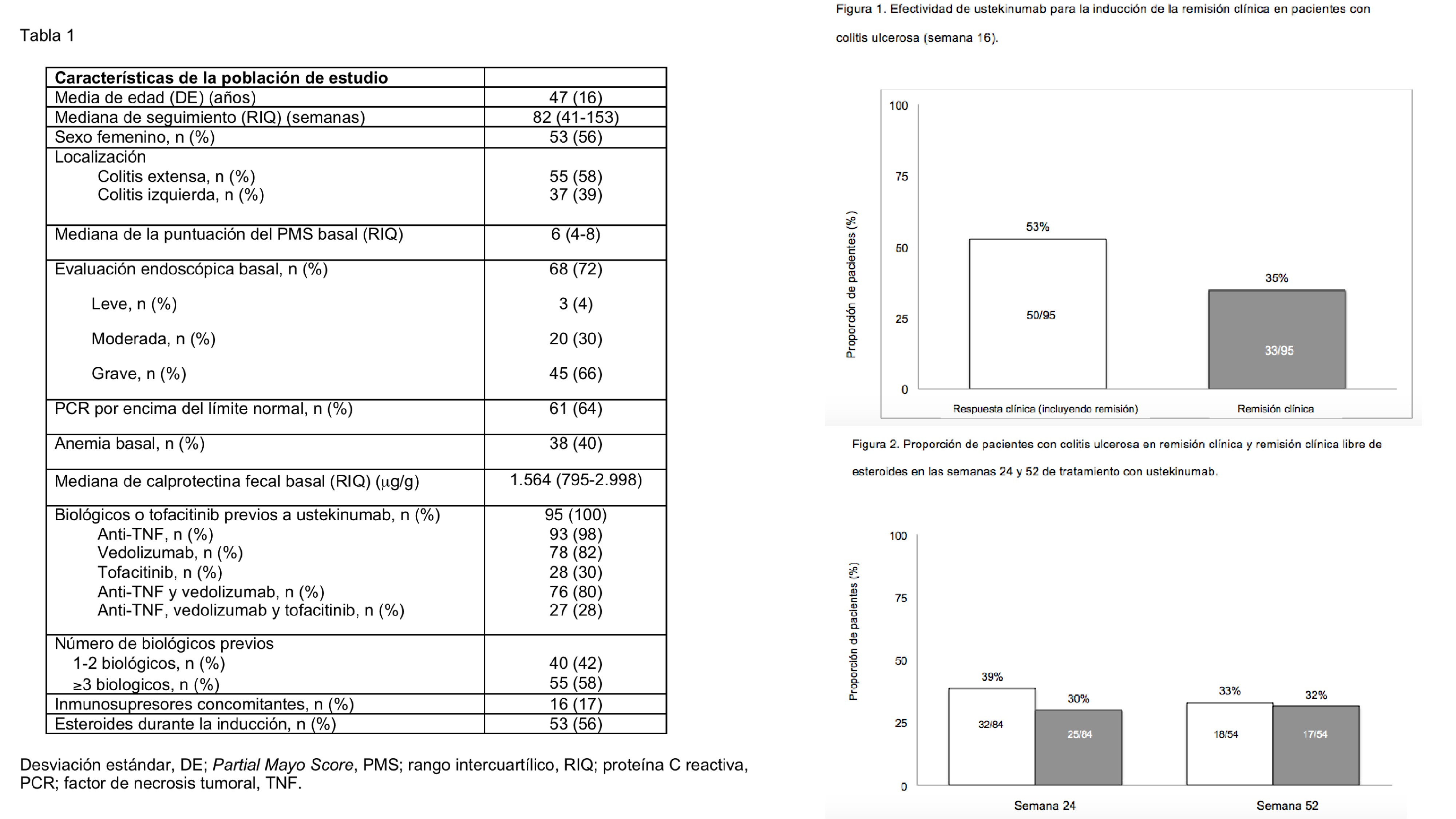
Conclusiones: UST es eficaz en la CU, tanto a corto como a largo plazo, en la vida real, incluso en una cohorte altamente refractaria. Una mayor carga inflamatoria al inicio del estudio se correlacionó con una menor probabilidad de lograr la remisión. La seguridad fue consistente con el perfil conocido de UST.









