P-46 - TRANSICIÓN DE VEDOLIZUMAB INTRAVENOSO A SUBCUTÁNEO EN PACIENTES CON ENFERMEDAD INFLAMATORIA INTESTINAL EN REMISIÓN CLÍNICA: UN ESTUDIO MULTICÉNTRICO DE GETECCU
1Hospital Universitario Reina Sofía, Córdoba. 2Western General Hospital, Edinburgh, Reino Unido. 3Gastroenterology Department, Hospital Universitario Infanta Sofía, San Sebastián de los Reyes. 4Gastroenterology Department, Bellvitge Hospital, L’Hospitalet de Llobregat. 5Inflammatory Bowel Disease Unit, Gastroenterology Department, Hospital Universitario de Canarias, Tenerife. 6Hospital Universitario de Galdakao. 7Department of Gastroenterology, Fundación Alcorcón University Hospital, Madrid. 8Gastroenterology department, Infanta Leonor University Hospital, Madrid. 9Gastroenterology department, Virgen Macarena University Hospital, Sevilla. 10Gastroenterology department, Hospital Ramón y Cajal, Madrid. 11Hospital Universitario de Fuenlabrada. 12Gastroenterology Department, IBD Unit, Hospital Universitari Germans Trias i Pujol, Badalona. 13Centro de Investigaciones Biomédicas en Red de Enfermedad Hepáticas y Digestivas (CIBEREHD), Madrid. 14Gastroenterology Department, University General Hospital of Alicante. 15Gastroenterology Department, University Hospital Mutua de Terrassa. 16Gastroenterology Department, Candelaria University Hospital of Tenerife. 17Gastroenterology Department, La Fe University Hospital, Valencia. 18Gastroenterology Department, Moises Broggi Hospital, Sant Joan Despí. 19Gastroenterology Department, Clínico San Cecilio Hospital, Granada. 20Department of Gastroenterology-IBD Unit, University Hospital Santiago de Compostela. 21Servicio de Patología Digestiva, Hospital General Universitario de Valencia. 22Gastroenterology department, Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí (I3PT-CERCA), Sabadell, Departament de Medicina, Universitat Autònoma de Barcelona. 23Gastroenterology Department. 12 de Octubre University Hospital, Madrid. 24Hospital Clínic i Provincial, Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Barcelona. 25Gastroenterology Department, University Hospital Mutua de Terrassa. 26Universitary Clinic Hospital of Valencia. 27Department of Gastroenterology, Valdecilla University Hospital, Santander. 28Instituto de Investigación Valdecilla (IDIVAL) Santander. 29Department of Gastroenterology-IBD Unit, University Hospital Santiago de Compostela. 30Instituto ISABIAL, Alicante.
Introducción: A pesar del uso establecido de vedolizumab intravenoso (IV) para tratar la enfermedad inflamatoria intestinal (EII), existe un creciente interés en explorar las ventajas de la novedosa vía de administración subcutánea (SC).
Métodos: Pacientes con EII en tratamiento con vedolizumab IV en 24 hospitales españoles que estaban en remisión clínica tuvieron la opción de cambiar a inyecciones SC o continuar con el tratamiento IV. Se recopilaron retrospectivamente datos que abarcaban la actividad clínica de la enfermedad, marcadores bioquímicos, eventos adversos y persistencia del tratamiento a partir de registros clínicos en las semanas 12, 24 y 48.
Resultados: Se identificaron 166 pacientes, 19 fueron excluidos por no estar en remisión clínica y 8 por ausencia de datos de seguimiento, lo que resultó en la inclusión final de 139 pacientes para el análisis. De estos, 36 (25,9%) continuaron con vedolizumab IV, mientras que 103 (74,1%) cambiaron a vedolizumab SC. Ambos grupos mostraron características demográficas comparables. Sin embargo, hubo diferencias en el comportamiento de la enfermedad de Crohn (EC) entre los grupos (p = 0,013). No hubo diferencias significativas en la remisión clínica, bioquímica y de calprotectina fecal en las semanas 12, 24 y 48 ni en la cohorte general ni al evaluar la EC o la CU por separado (fig.). Al final del seguimiento, duración mediana 47 semanas (29-49), 1 (2,8%) paciente en IV y 4 (3,9%) en SC suspendieron el fármaco (p = 0,810), 5 (4,8%) volvieron de SC a IV. Se reportaron eventos adversos en 1 (2,8%) IV vs. 11 (10,7%) vedolizumab SC (p = 0,292), la mayoría fueron reacciones cutáneas leves a la inyección SC 3 (2,9%).
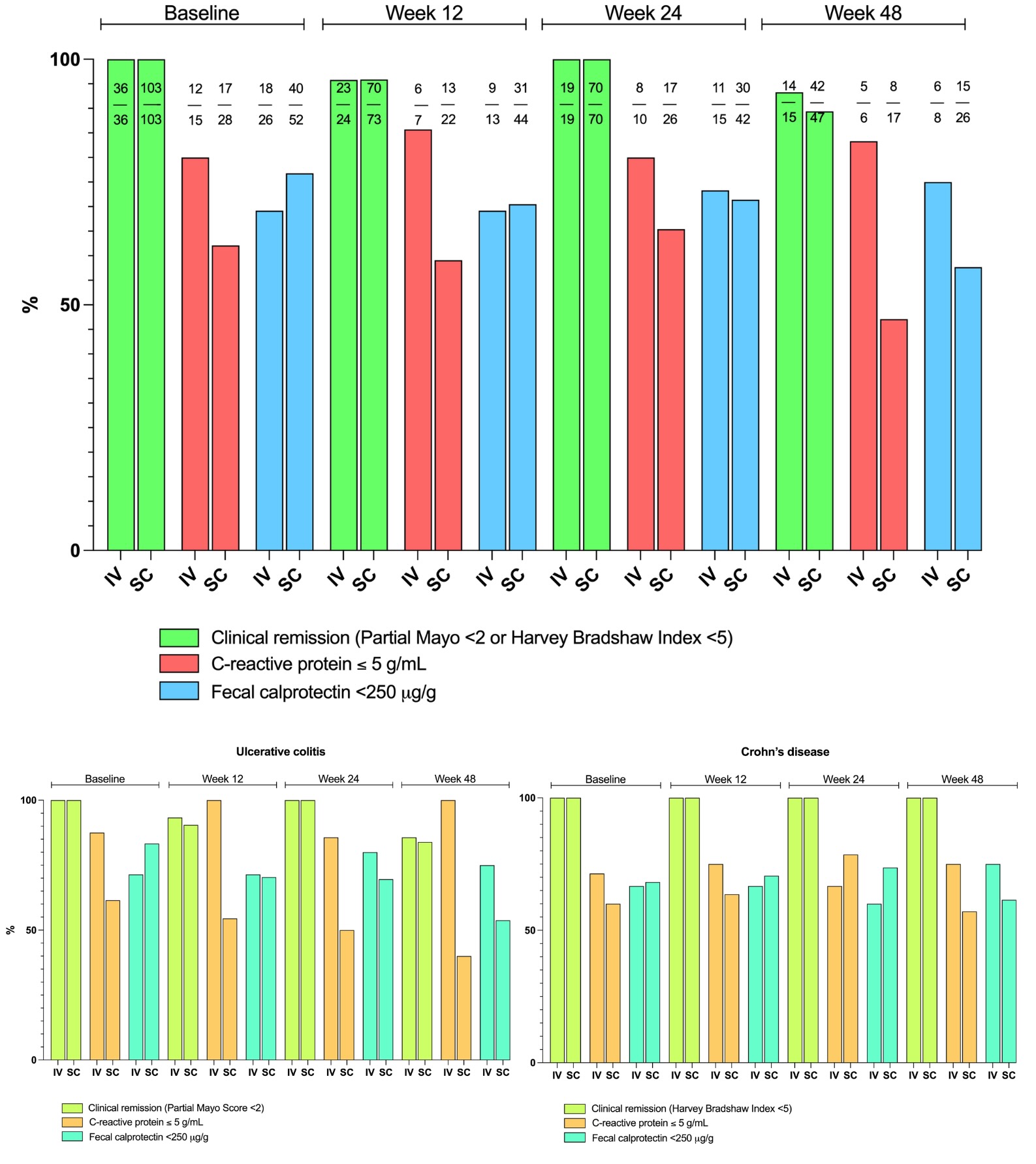
Conclusiones: La transición de vedolizumab IV a SC en pacientes con EII en remisión mostró una efectividad comparable en el mantenimiento de la remisión de la enfermedad. El cambio a la formulación SC fue seguro, sin identificar nuevas señales de seguridad y la mayoría de los eventos adversos fueron leves.









